Какими свойствами обладают полипептиды
Терминология: Олигопептиды и Полипептиды
Грань между олигопептидами и полипептидами (тот размер, при котором белковая молекула перестаёт считаться олигопептидом и становится полипептидом) достаточно условна. Часто пептиды, содержащие менее 10-20 аминокислотных остатков, называют олигопептидами, а вещества с большим числом аминокислотных звеньев — полипептидами. Во многих случаях эта грань в научной литературе не проводится вообще и небольшая белковая молекула (такая, как окситоцин) упоминается как полипептид (или просто как пептид).
История
Пептиды впервые были выделены из гидролизатов белков, полученных с помощью ферментирования.
- Термин пептид предложен Э. Фишером, который к 1905 г. разработал общий метод синтеза пептидов.
В 1953 В. Дю Виньо синтезировал окситоцин, первый полипептидный гормон. В 1963 г., на основе концепции твердофазного пептидного синтеза (P. Меррифилд) были созданы автоматические синтезаторы пептидов. Использование методов синтеза полипептидов позволило получить синтетический инсулин и др. ферменты.
Известные «семейства» пептидов
Семейства пептидов в этом разделе являются рибосомальными, обычно они обладают гормональной активностью.
Панкреатические молекулы полипептидного характера
- en:NPY
- Пептид YY
- APP Avian pancreatic polypeptide
- en:HPP Human pancreatic polypeptide
Опиоидные пептиды
Опиоидные пептиды — группа природных и синтетических пептидов, сходных с опиатами (морфин, кодеин и др.) по способности связываться с опиоидными рецепторами организма. Эндогенные морфиноподобные вещества были впервые выделены в 1975 году из целого мозга и гипофиза голубей, морских свинок, крыс, кроликов и мышей, а в 1976 году фракции таких олигопептидов были обнаружены в спинномозговой жидкости и крови человека . Различные виды этих олигопептидов получили название эндорфинов и энкефалинов. Лиганды опиоидных рецепторов были обнаружены и во многих периферических органах, тканях и биологических жидкостях. Присутствие опиоидов показано в гипоталамусе и гипофизе, плазме крови и спиномозговой жидкости, желудочно-кишечном тракте, лёгких, органах репродуктивной системы, иммунокомпетентных тканях и даже в коже. Наряду с эндорфинами обнаружены и так называемые экзорфины или параопиоиды — опиоидные пептиды, образующиеся при переваривании пищи. К настоящему времени опиоидные рецепторы и их эндогенные лиганды обнаружены практически во всех органах и тканях млекопитающих, а также у животных более низких ступеней классификации вплоть до простейших. Основная часть опиоидных пептидов образуется путём внутриклеточного расщепления высокомолекулярных предшественников, что приводит к образованию ряда биологически активных фрагментов, в том числе и опиоидных пептидов. Идентифицированы и наиболее изучены 3 таких предшественника: проопиомеланокортин (ПОМК), проэнкефалин А и продинорфин (проэнкефалин В). В состав ПОМК (локализованного главным образом в гипофизе) входят аминокислотные последовательности b-липотропина, АКТГ, a-, b- и g-меланоцитстимулирующих гормонов, a-, b- и g-эндорфинов. В настоящее время установлено, что основным источником энкефалинов (метионин-энкефалина и лейцин-энкефалина) в организме является проэнкефалин А, локализованный преимущественно в надпочечниках. В его составе содержится 4 аминокислотные последовательности мет-энкефалина и одна лей-энкефалина, а также ряд продленных форм мет-энкефалина: меторфамид, МЕРГЛ (мет-энкефалин-Arg6-Gly7-Leu8), МЕРФ (мет-энкефалин-Arg6-Phe7), пептид Ф и группы родственных пептидов, входящих в состав пептида Е: BAM 22, 20, 18, 12, взаимодействующих с опиоидными рецепторами mu-, kappa- и delta-типа. В структуре другого проэнкефалина — препроэнкефалина В (или продинорфина) — обнаружены последовательности a- и b-неоэндорфинов, динорфинов [динорфин 1-8, 1-17 (А), динорфин В (риморфин), 4кД-динорфин], обладающих наибольшим сродством к ОР k-типа, а также лей-энкефалина. Радиорецепторный анализ связывания эндорфинов и энкефалинов с опиоидными рецепторами показал, что сродство мет- и лей-энкефалинов к опиоидным рецепторам delta-типа выше, чем к рецепторам mu-типа; b-эндорфин имеет примерно одинаковое сродство к опиоидным рецепторам mu- и delta-типа, a- и g-эндорфины проявляют гораздо меньшее сродство к обоим типам рецепторов по сравнению с b-эндорфином. Несмотря на то, что мет-энкефалин взаимодействует преимущественно с опиоидными рецепторами d-типа, его аналоги с более длинной аминокислотной последовательностью — меторфамид и пептиды группы BAM (пептиды из мозгового вещества надпочечников) обладают противоположным профилем селективности взаимодействия с опиоидными рецепторами (mu > kappa > delta). Большинство эндогенных опиоидов в той или иной степени могут взаимодействовать с несколькими типами рецепторов. Так, b-эндорфин своим N-концевым фрагментом способен взаимодействовать с mu- и delta-опиоидными рецепторами, а С-концом с epsilon-рецепторами. В коже амфибий, а затем и в мозге и некоторых других органах теплокровных, обнаружен 4-ый предшественник ОП — продерморфин, который считается источником дерморфина (mu-агониста) и дельторфина (delta-агониста). В ЦНС обнаружены эндогенные пептиды, специфически взаимодействующие с mu-опиоидными рецепторами: Tyr-Pro-Trp-Phe-NH2 и Tyr-Pro-Phe-Phe-NH2, названные эндоморфинами, а также пептид ноцицептин, оказывающий свой анальгетический эффект через опиоидоподобные орфановые рецепторы.
Пептиды (Tachykinin peptides)
- Субстанция Р
- en:Kassinin
- Нейрокинин А (en:Neurokinin A)
- en:Eledoisin
- Нейрокинин В (en:Neurokinin B)
Терминология по теме
- Полипептиды простая линейная цепь, состоящая из аминокислот
- Олигопептиды или (просто) пептиды — полипептиды с числом аминокислот в цепи до 30-50
- Дипептиды
- Трипептиды
- Гексапептиды
- Нейропептиды пептиды, ассоциированные с нервной тканью
- Пептидные гормоны — петиды с Гормональной активностью
См. также
- Белки
- Аминокислоты
- Рибосома
Внешние ссылки
Wikimedia Foundation.
2010.
Синонимы:
Источник
1. Запишите формулу дипептида, образованного двумя молекулами аминокислот.
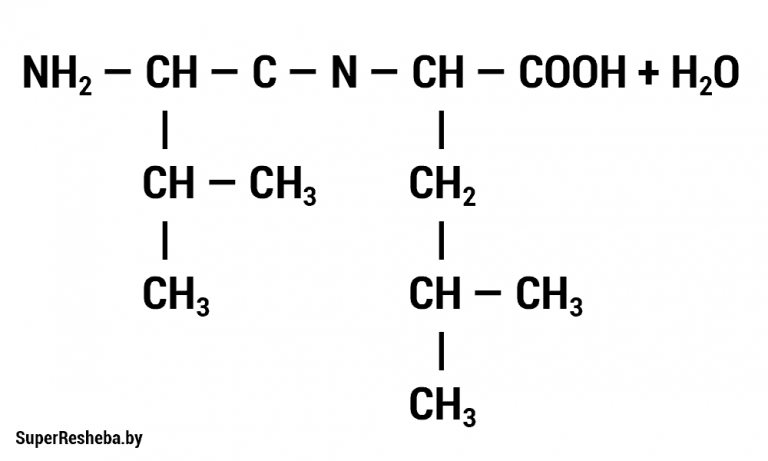
2. В состав полипептида входят следующие аминокислоты: аланин, лизин, глутаминовая кислота. Какими свойствами будет обладать полипептид — гидрофильными или гидрофобными? Ответ поясните. Формулы данных аминокислот приведены в учебнике (с. 19, рис. 6).
Полипептид будет гидрофильным.
3. Альбумин сыворотки крови человека имеет относительную молекулярную массу 68 400. Определите количество аминокислотных остатков в молекуле этого белка, принимая во внимание, что средняя относительная молекулярная масса одной аминокислоты равна 120.
$dfrac{68400}{120} = 570$ (аминокислотных остатков).
4. Определите, сколько остатков глюкозы содержится в моле- куле гликогена, если его относительная молекулярная масса составляет примерно $1.62 · 10^6.$
$1.62 · dfrac{10^6}{162} = 10 000$ (остатков глюкозы).
5. Рассчитайте, сколько граммов глицерина было израсходовано клетками организма на синтез жира, если известно, что при этом было затрачено 21 моль высших карбоновых кислот.
На 1 моль глицерина приходится 3 моль кислот. Было использовано 7 моль глицерина. $M(mathrm{C_3H_8O_3}) = 92$ г/моль.
6. В молекуле ДНК на долю цитидиловых нуклеотидов приходится 20 %. Определите процентное содержание остальных нуклеотидов в этой ДНК.
Гуаниловых кислот — 20 %; адениловых — 30 %; тимидиловых — 30 %.
7. Фрагмент молекулы ДНК содержит 280 остатков цитидиловых нуклеотидов, что составляет 14 % от общего количества нуклеотидов. Определите длину данного фрагмента молекулы ДНК.
Ц + Г = $560;$ А + Т = $72 % = 1440;$ $dfrac{560 + 1440}{2} = 1000;$ длина фрагмента равна $340$ нм.
8. Фрагмент молекулы ДНК состоит из 5760 нуклеотидов, из них 1125 тимидиловых нуклеотидов. Определите количество адениловых, гуаниловых и цитидиловых нуклеотидов в данном фрагменте молекулы ДНК.
А = Т = $1125;$ $5760 – 1125 – 1125 = 3510;$ Г = Ц = $dfrac{3510}{2} = 1755.$
9. Длина фрагмента молекулы ДНК равна 68 нм, что составляет 10 % от длины всей молекулы. На долю адениловых нуклеотидов в данной молекуле ДНК приходится 12 %. Определите относительную молекулярную массу фрагмента молекулы ДНК, принимая во внимание, что относительная молекулярная масса одного нуклеотида равна 354, и число всех видов нуклеотидов в данной молекуле ДНК.
$dfrac{68,нм}{0.34,нм} = 200;$ $200 · 354 = 70 800.$
10. У исследователя есть три молекулы ДНК одинаковой длины. Известно, что содержание тимидиловых нуклеотидов (Т) в первом образце составляет 20 % от общего числа нуклеотидов, во втором — 36 %, в третьем — 8 %. Исследователь начал нагревать данные молекулы ДНК, постепенно повышая температуру. При этом происходило отделение комплементарных цепей друг от друга — так называемое плавление ДНК. Какой образец начал плавиться первым, а какой расплавился в последнюю очередь? Почему?
Поскольку во втором образце содержится меньше Г–Ц (потому как больше тимидиловых нуклеотидов), он начал плавится первым, а в последнюю очередь расплавился третий, где содержание Г–Ц наибольшее (тимидиловых нуклеотидов наименьшее).
Источник
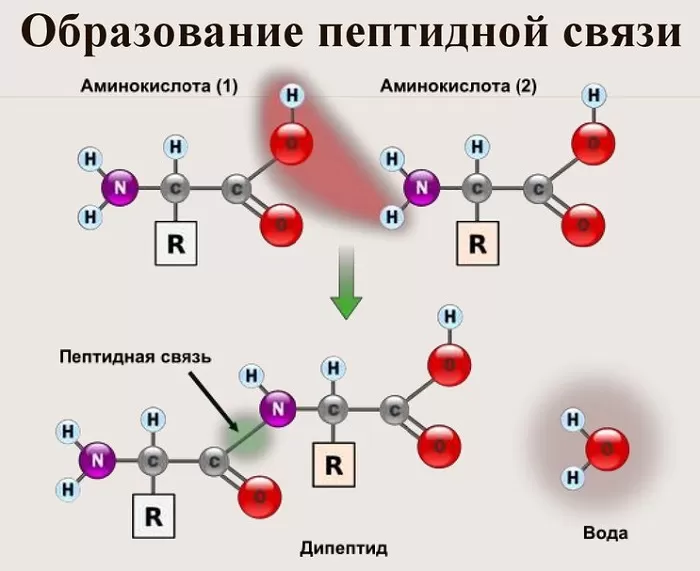
Именно пептидная связь является основой построения всех белковых молекул, из которых, в конечном счете, образуется вся живая материя. Особенности строения пептидной связи, ее структура оказали огромное влияние на саму возможность существования жизни на нашей планете. О том, что такое пептидная связь, как она образуется и какими свойствами обладает, читайте дальше.
Что такое пептидная связь?
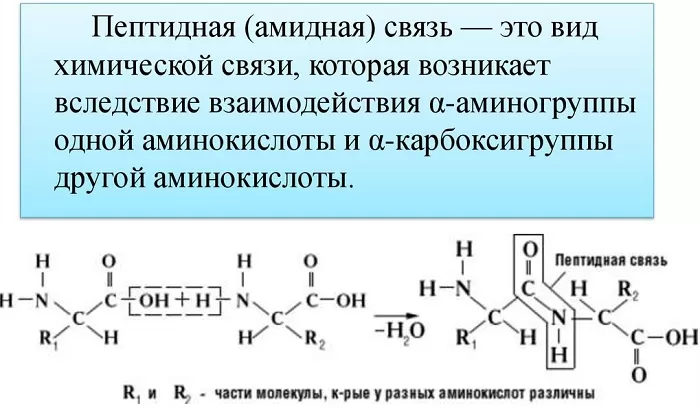
Пептидная связь это связь, возникающая между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-COOH). Две соединенные одна с другой кислоты образуют дипептид, три – трипепетид и так далее. Длинные цепи подобного рода зовутся полипептидами и белками.
Также академическое определение пептидной связи звучит так: пептидная связь – это вид химической связи, возникающей вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты.
Само же слово «пептид» происходит от греческого «питательный» и означает семейство веществ, молекулы которых построены из двух или более остатков аминокислот, соединенных в цепь пептидными связями —C(O)NH—.
Образование пептидной связи
Как образуется пептидная связь? Образование пептидной связи происходит внутри клеток на рибосомах при активном участии ферментов с затратой энергии. Аминокислоты при этом, будучи мономерами, играют роль таких себе строительных блоков белков. Для синтеза белка живыми организмами используется 20 видов различных аминокислот.
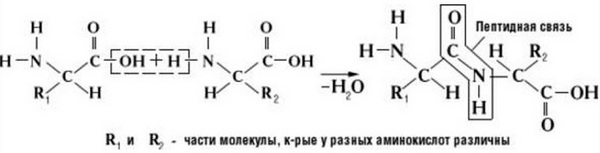
Что же касается самого процесса образования пептидной связи между аминокислотами, то она образуется при оттягивании электронной плотности с атома водорода аминогруппы одной аминокислоты и атомом кислорода карбоксильной группы другой аминокислоты.
Вот так процесс образования пептидной связи в молекуле выглядит схематически.
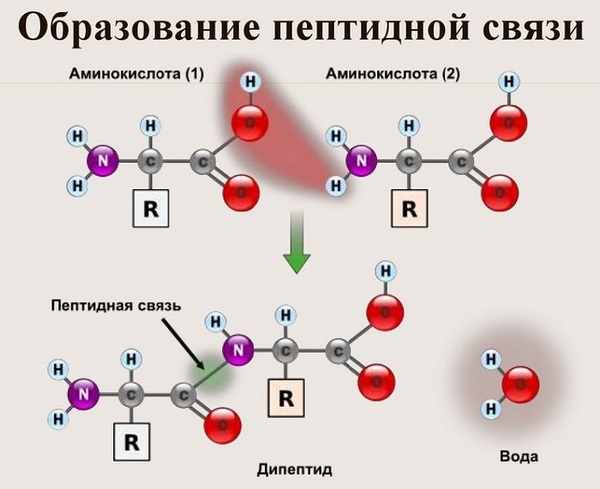
Как следствие разрываются соединения между N и H в аминогруппе и между C и OH в карбоксильной группе. Соединение протона и гидроксильной группы в результате образует воду, а два аминокислотных остатка – дипептид.
Свойства пептидной связи
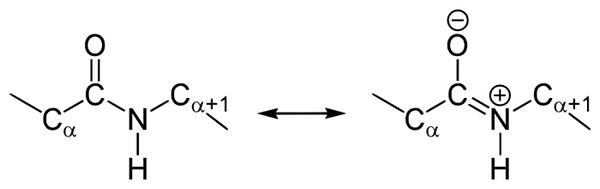
Пептидная связь, которая имеет место при первичной структуре белков, не является полностью одинарной. Длина ее равна 0,132 нм. Это среднее значение между истинной двойной и одинарной связями.
Важными свойствами пептидной связи являются копланарность и трансположение, далее подробно их поясним.
Копланарность означает, что все атомы, входящие в пептидную группу находятся на одной плоскости, а атомы H и О располагаются по разные стороны от пептидной связи. Но стоит заметить, что радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Трансположение означает, что кислород и водород пептидной связи находятся в транс-ориентации. Также в транс-ориентации ориентированы аминокислотные R-группы во всех белковых и пептидных молекулах естественного происхождения.
Строение пептидной связи
В чем особенности строения пептидной связи? В амидной группе –CO-NH- углеродный атом существует в форме sp2-гибридизации. К примеру, электронная пара атома азота сопрягается с π-электронами двойной связи между углеродом и кислородом. Тогда электронная плотность пептидной группы сместится к кислороду. В результате подобного сопряжения выровняются длины связей внутри радикала.
Структура подобной пептидной связи и формула отражена на картинке.
Методы определения пептидных связей
Наилучшим методом для определения пептидных связей является биуретовая реакция. Такое название она имеет потому, что впервые эта реакция была использована для получения биурета, который хотя и не является аминокислотой, но обладает при этом двумя пептидными связями.
Сам механизм определения сводится к тому, что аминокислоты, способные образовать как минимум две пептидные связи в щелочной среде при добавлении сульфата меди образуют медьсодержащее комплексное соединение фиолетового цвета.
Рекомендованная литература и полезные ссылки
- Nomenclature and Symbolism for Amino Acids and Peptides. Recommendations 1983″. European Journal of Biochemistry. 138 (1): 9–37. 1984. doi:10.1111/j.1432-1033.1984.tb07877.x. ISSN 0014-2956.
- Muller, P (1994-01-01). “Glossary of terms used in physical organic chemistry (IUPAC Recommendations 1994)”. Pure and Applied Chemistry. 66 (5): 1077–1184. doi:10.1351/pac199466051077. ISSN 1365-3075.
- Watson J, Hopkins N, Roberts J, Agetsinger Steitz J, Weiner A (1987) [1965]. Molecualar Biology of the Gene (hardcover) (Fourth ed.). Menlo Park, CA: The Benjamin/Cummings Publishing Company, Inc. p. 168. ISBN 978-0805396140.
- Miller BR, Gulick AM (2016). “Structural Biology of Nonribosomal Peptide Synthetases”. Methods in Molecular Biology. 1401: 3–29. doi:10.1007/978-1-4939-3375-4_1. ISBN 978-1-4939-3373-0. PMC 4760355. PMID 26831698.
- Griffiths AJ, Miller JH, Suzuki DT, Lewontin RC, Gelbart WM (2000). Protein synthesis. An Introduction to Genetic Analysis (7th ed.). New York: W. H. Freeman. ISBN 978-0716735205.
Пептидная связь, видео

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
Пептидная связь возникает между аминокислотами при взаимодействии аминогруппы (-NH2) и карбоксильной группы (-СООН). Две соединенные между собой аминокислоты дают дипептид, три – трипепетид и так далее. Более длинные цепи называют полипептиды и белки.
Образование полипептидной связи внутри клеток идет на рибосомах, при участии ферментов с затратой энергии. Аминокислоты являются мономерами – строительными блоками белков. Для синтеза белка живые организмы используют 20 видов аминокислот.
Как образуется пептидная связь
Данный вид образуется при оттягивании электронной плотности с атома водорода аминогруппы одной и атомом кислорода карбоксильной группы другой аминокислоты.

В результате разрываются соединение между N и Н в аминогруппе и между С и ОН в карбоксильной группе. Протон и гидроксильная группа, объединяясь, дают воду. Два аминокислотных остатка – дипептид.
Свойства пептидной связи
Пептидная связь, характерная для первичной структуры белков, не является полностью одинарной. Её длина составляет 0.132 нм. Это среднее значение между значением истинной двойной связью (C = N, 0,127 нм) и значением истинной одинарной связью (C – N, 0,149 нм).
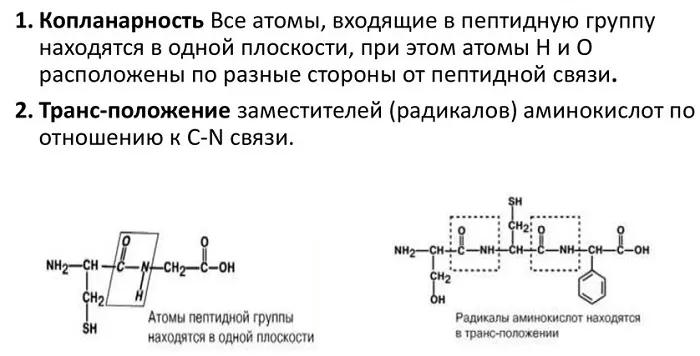
Свойства:
Атомы, непосредственно вступающие во взаимодействие (углерод, азот, кислород, водород) и два атома α-углерода расположены в общей плоскости. Радикальные группы аминокислот и водорода при α-углеродах лежат за пределами плоскости.
Водород и кислород пептидной связи и α-углероды аминокислот находятся в транс-ориентации. Во всех белковых и пептидных молекулах естественного происхождения, аминокислотные R-группы тоже ориентированы в транс-модификацию.
Резонансные формы пептидных связей
В основе феномена резонанса пептидной связи лежит то, что она на 40% является двойной.
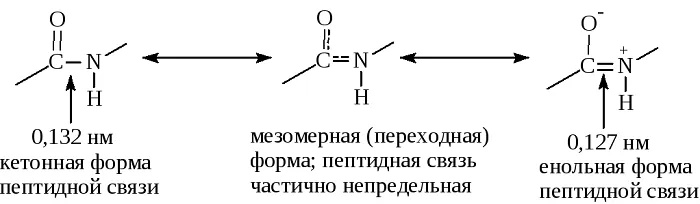
В результате этот вид существует в трех формах:
Кетольная (0,132 нм). Когда взаимодействие между атомами азота и углерода стабилизируется и становится полностью одиночной.
Переходная или мезомерная форма с неопределенными, промежуточными характеристиками.
Енольная (0,127 нм). В этой форме электронная плотность переходит с пептидной на связь между углеродом и кислородом, делая её полностью двойной, вследствие атом кислорода становится заряжен частично отрицательно.
Таким образом, причиной резонанса является делокализованность электронной плотности между азотом и углеродом.
Строение пептидной связи
В амидной группе -СО-NH- углеродный атом существует в форме sp2-гибридизации. Неподеленная пара электронов атома азота сопрягается с π-электронами двойной связи между углеродом и кислородом.
В итоге электронная плотность пептидной группы смещается к кислороду. В результате такого сопряжения выравниваются длины связей внутри радикала.
Структура и формула отражены на картинке:
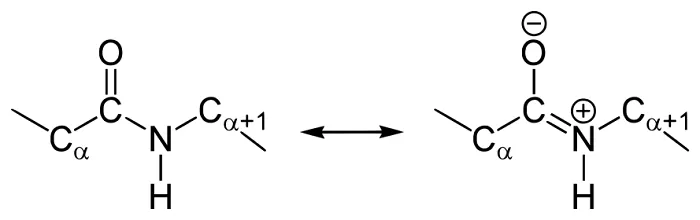
Методы определения пептидных связей
Качественной является биуретовая реакция. Такое название она получила, так как впервые была проведена для биурета, хоть и не являющегося аминокислотой, но обладающего двумя пептидными связями.
Принцип определения сводится к тому, что аминокислоты, могущие образовать минимум две пептидные связи, в щелочной среде, при добавлении сульфата меди (II), образуют медьсодержащее комплексное соединение фиолетового цвета.
Комплекс меди с биуретом образуется по схеме:
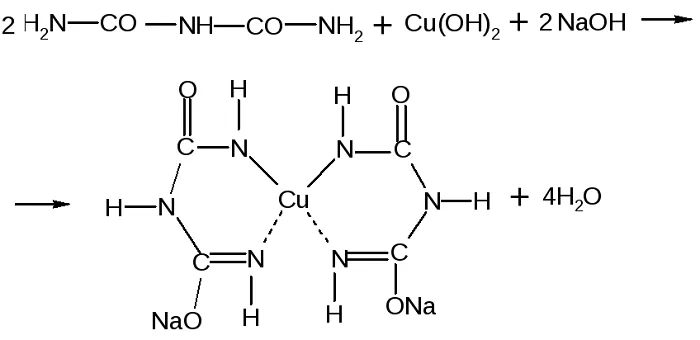
Заключение
Пептидная связь является основой построения белковых молекул, из которых, в конечном итоге, строятся все живые организмы. Особенности её строения и пространственной конфигурации оказали огромное влияние на саму возможность существования жизни на нашей планете.
Последовательность аминокислот в белке определяется другой важнейшей молекулой – ДНК.
Источник
