Какими свойствами обладают газы краткий ответ
На сегодняшний день известно о существовании более чем 3 миллионов различных веществ. И цифра эта с каждым годом растет, так как химиками-синтетиками и другими учеными постоянно производятся опыты по получению новых соединений, обладающих какими-либо полезными свойствами.
Часть веществ – это природные обитатели, формирующиеся естественным путем. Другая половина – искусственные и синтетические. Однако и в первом и во втором случае значительную часть составляют газообразные вещества, примеры и характеристики которых мы и рассмотрим в данной статье.

Агрегатные состояния веществ
С XVII века принято было считать, что все известные соединения способны существовать в трех агрегатных состояниях: твердые, жидкие, газообразные вещества. Однако тщательные исследования последних десятилетий в области астрономии, физики, химии, космической биологии и прочих наук доказали, что есть еще одна форма. Это плазма.
Что она собой представляет? Это частично или полностью ионизированные газы. И оказывается, таких веществ во Вселенной подавляющее большинство. Так, именно в состоянии плазмы находятся:
- межзвездное вещество;
- космическая материя;
- высшие слои атмосферы;
- туманности;
- состав многих планет;
- звезды.
Поэтому сегодня говорят, что существуют твердые, жидкие, газообразные вещества и плазма. Кстати, каждый газ можно искусственно перевести в такое состояние, если подвергнуть его ионизации, то есть заставить превратиться в ионы.
Газообразные вещества: примеры
Примеров рассматриваемых веществ можно привести массу. Ведь газы известны еще с XVII века, когда ван Гельмонт, естествоиспытатель, впервые получил углекислый газ и стал исследовать его свойства. Кстати, название этой группе соединений также дал он, так как, по его мнению, газы – это нечто неупорядоченное, хаотичное, связанное с духами и чем-то невидимым, но ощутимым. Такое имя прижилось и в России.
Можно классифицировать все газообразные вещества, примеры тогда привести будет легче. Ведь охватить все многообразие сложно.
По составу различают:
- простые,
- сложные молекулы.
К первой группе относятся те, что состоят из одинаковых атомов в любом их количестве. Пример: кислород – О2, озон – О3, водород – Н2, хлор – CL2, фтор – F2, азот – N2 и прочие.
Ко второй категории следует относить такие соединения, в состав которых входит несколько атомов. Это и будут газообразные сложные вещества. Примерами служат:
- сероводород – H2S;
- хлороводород – HCL;
- метан – CH4;
- сернистый газ – SO2;
- бурый газ – NO2;
- фреон – CF2CL2;
- аммиак – NH3 и прочие.
Классификация по природе веществ
Также можно классифицировать виды газообразных веществ по принадлежности к органическому и неорганическому миру. То есть по природе входящих в состав атомов. Органическими газами являются:
- первые пять представителей предельных углеводородов (метан, этан, пропан, бутан, пентан). Общая формула CnH2n+2;
- этилен – С2Н4;
- ацетилен или этин – С2Н2;
- метиламин – CH3NH2 и другие.
К категории газов неорганической природы относятся хлор, фтор, аммиак, угарный газ, силан, веселящий газ, инертные или благородные газы и прочие.
Еще одной классификацией, которой можно подвергнуть рассматриваемые соединения, является деление на основе входящих в состав частиц. Именно из атомов состоят не все газообразные вещества. Примеры структур, в которых присутствуют ионы, молекулы, фотоны, электроны, броуновские частицы, плазма, также относятся к соединениям в таком агрегатном состоянии.
Свойства газов
Характеристики веществ в рассматриваемом состоянии отличаются от таковых для твердых или жидких соединений. Все дело в том, что свойства газообразных веществ особенные. Частицы их легко и быстро подвижны, вещество в целом изотропное, то есть свойства не определяются направлением движения входящих в состав структур.
Можно обозначить самые главные физические свойства газообразных веществ, которые и будут отличать их от всех остальных форм существования материи.
- Это такие соединения, которые нельзя увидеть и проконтролировать, ощутить обычными человеческими способами. Чтобы понять свойства и идентифицировать тот или иной газ, опираются на четыре описывающих их все параметра: давление, температура, количество вещества (моль), объем.
- В отличие от жидкостей газы способны занимать все пространство без остатка, ограничиваясь лишь величиной сосуда или помещения.
- Все газы между собой легко смешиваются, при этом у этих соединений нет поверхности раздела.
- Существуют более легкие и тяжелые представители, поэтому под действием силы тяжести и времени, возможно увидеть их разделение.
- Диффузия – одно из важнейших свойств этих соединений. Способность проникать в другие вещества и насыщать их изнутри, совершая при этом совершенно неупорядоченные движения внутри своей структуры.
- Реальные газы электрический ток проводить не могут, однако если говорить о разреженных и ионизированный субстанциях, то проводимость резко возрастает.
- Теплоемкость и теплопроводность газов невысока и колеблется у разных видов.
- Вязкость возрастает с увеличением давления и температуры.
- Существует два варианта межфазового перехода: испарение – жидкость превращается в пар, сублимация – твердое вещество, минуя жидкое, становится газообразным.
Отличительная особенность паров от истинных газов в том, что первые при определенных условиях способны перейти в жидкость или твердую фазу, а вторые нет. Также следует заметить способность рассматриваемых соединений сопротивляться деформациям и быть текучими.

Подобные свойства газообразных веществ позволяют широко применять их в самых различных областях науки и техники, промышленности и народном хозяйстве. К тому же конкретные характеристики являются для каждого представителя строго индивидуальными. Мы же рассмотрели лишь общие для всех реальных структур особенности.
Сжимаемость
При разных температурах, а также под влиянием давления газы способны сжиматься, увеличивая свою концентрацию и снижая занимаемый объем. При повышенных температурах они расширяются, при низких – сжимаются.
Под действием давления также происходят изменения. Плотность газообразных веществ увеличивается и, при достижении критической точки, которая для каждого представителя своя, может наступить переход в другое агрегатное состояние.
Основные ученые, внесшие вклад в развитие учения о газах
Таких людей можно назвать множество, ведь изучение газов – процесс трудоемкий и исторически долгий. Остановимся на самых известных личностях, сумевших сделать наиболее значимые открытия.
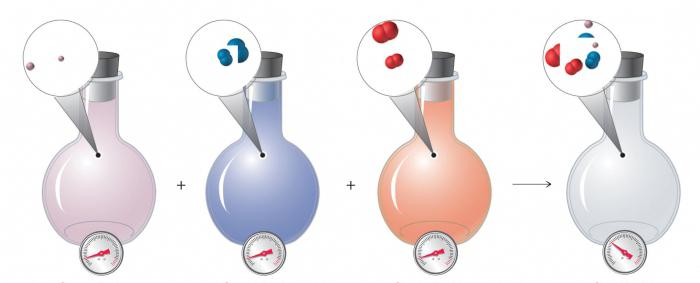
- Амедео Авогадро в 1811 году сделал открытие. Неважно, какие газы, главное, что при одинаковых условиях их в одном объеме их содержится равное количество по числу молекул. Существует рассчитанная величина, имеющая название по фамилии ученого. Она равна 6,03*1023 молекул для 1 моль любого газа.
- Ферми – создал учение об идеальном квантовом газе.
- Гей-Люссак, Бойль-Мариотт – фамилии ученых, создавших основные кинетические уравнения для расчетов.
- Роберт Бойль.
- Джон Дальтон.
- Жак Шарль и многие другие ученые.
Строение газообразных веществ
Самая главная особенность в построении кристаллической решетки рассматриваемых веществ, это то, что в узлах ее либо атомы, либо молекулы, которые соединяются друг с другом слабыми ковалентными связями. Также присутствуют силы ван-дер-ваальсового взаимодействия, когда речь идет о ионах, электронах и других квантовых системах.
Поэтому основные типы строения решеток для газов, это:
- атомная;
- молекулярная.
Связи внутри легко рвутся, поэтому эти соединения не имеют постоянной формы, а заполняют весь пространственный объем. Это же объясняет отсутствие электропроводности и плохую теплопроводность. А вот теплоизоляция у газов хорошая, ведь, благодаря диффузии, они способны проникать в твердые тела и занимать свободные кластерные пространства внутри них. Воздух при этом не пропускается, тепло удерживается. На этом основано применение газов и твердых тел в совокупности в строительных целях.

Простые вещества среди газов
Какие по строению и структуре газы относятся к данной категории, мы уже оговаривали выше. Это те, что состоят из одинаковых атомов. Примеров можно привести много, ведь значительная часть неметаллов из всей периодической системы при обычных условиях существует именно в таком агрегатном состоянии. Например:
- фосфор белый – одна из аллотропных модификаций данного элемента;
- азот;
- кислород;
- фтор;
- хлор;
- гелий;
- неон;
- аргон;
- криптон;
- ксенон.
Молекулы этих газов могут быть как одноатомными (благородные газы), так и многоатомными (озон – О3). Тип связи – ковалентная неполярная, в большинстве случаев достаточно слабая, но не у всех. Кристаллическая решетка молекулярного типа, что позволяет этим веществам легко переходить из одного агрегатного состояния в другое. Так, например, йод при обычных условиях – темно-фиолетовые кристаллы с металлическим блеском. Однако при нагревании сублимируются в клубы ярко-фиолетового газа – I2.

К слову сказать, любое вещество, в том числе металлы, при определенных условиях могут существовать в газообразном состоянии.
Сложные соединения газообразной природы
Таких газов, конечно, большинство. Различные сочетания атомов в молекулах, объединенные ковалентными связями и ван-дер-ваальсовыми взаимодействиями, позволяют сформироваться сотням различных представителей рассматриваемого агрегатного состояния.
Примерами именно сложных веществ среди газов могут быть все соединения, состоящие из двух и более разных элементов. Сюда можно отнести:
- пропан;
- бутан;
- ацетилен;
- аммиак;
- силан;
- фосфин;
- метан;
- сероуглерод;
- сернистый газ;
- бурый газ;
- фреон;
- этилен и прочие.
Кристаллическая решетка молекулярного типа. Многие из представителей легко растворяются в воде, образуя соответствующие кислоты. Большая часть подобных соединений – важная часть химических синтезов, осуществляемых в промышленности.
Метан и его гомологи
Иногда общим понятием “газ” обозначают природное полезное ископаемое, которое представляет собой целую смесь газообразных продуктов преимущественно органической природы. Именно он содержит такие вещества, как:
- метан;
- этан;
- пропан;
- бутан;
- этилен;
- ацетилен;
- пентан и некоторые другие.
В промышленности они являются очень важными, ведь именно пропан-бутановая смесь – это бытовой газ, на котором люди готовят пищу, который используется в качестве источника энергии и тепла.

Многие из них используются для синтеза спиртов, альдегидов, кислот и прочих органических веществ. Ежегодное потребление природного газа исчисляется триллионами кубометров, и это вполне оправданно.
Кислород и углекислый газ
Какие вещества газообразные можно назвать самыми широко распространенными и известными даже первоклассникам? Ответ очевиден – кислород и углекислый газ. Ведь это они являются непосредственными участниками газообмена, происходящего у всех живых существ на планете.
Известно, что именно благодаря кислороду возможна жизнь, так как без него способны существовать только некоторые виды анаэробных бактерий. А углекислый газ – необходимый продукт “питания” для всех растений, которые поглощают его с целью осуществления процесса фотосинтеза.
С химической точки зрения и кислород, и углекислый газ – важные вещества для проведения синтезов соединений. Первый является сильным окислителем, второй чаще восстановитель.
Галогены
Это такая группа соединений, в которых атомы – это частицы газообразного вещества, соединенные попарно между собой за счет ковалентной неполярной связи. Однако не все галогены – газы. Бром – это жидкость при обычных условиях, а йод – легко возгоняющееся твердое вещество. Фтор и хлор – ядовитые опасные для здоровья живых существ вещества, которые являются сильнейшими окислителями и используются в синтезах очень широко.
Источник
ГЛАВНАЯ » МАТЕРИАЛЫ » Что такое природный газ, каков его состав и как его добывают?
Природный газ — газообразные углеводороды, образующиеся в недрах земли. Его относят к полезным ископаемым, а составляющие используются в качестве топлива.
Свойства и состав природного газа
Природный газ горюч и взрывоопасен в соотношении примерно с 10% объемом воздуха. Он легче воздуха в 1,8 раз, бесцветен и не имеет запаха, эти свойства обусловлены высоким содержанием газообразных алканов (СН4 — С4Н10). В составе природного газа преобладает метан (СH4), он занимает от 70 до 98%, остальной объем заполнен его гомологами, углекислым газом, сероводородом, меркаптанами, ртутью и инертными газами.
Классификация природных газов
Существует всего 3 группы:
- Первая из них — почти исключающие содержание углеводородов с более чем двумя углеродными соединениями, так называемые сухие газы, получаемые исключительно в месторождениях, предназначенных только для добычи газов.
- Вторая — газы, добываемые одновременно с первичным сырьем. Это сухой, сжиженный газы и газовый бензин, смешанные между собой.
- К третьей группе относятся газы, состоящие из сухого газа и значительного объема тяжелых углеводородов, из коих выделяют бензиновые, лигроиновые и керосиновые. К тому же в составе присутствует незначительное количество других веществ. Добываются эти вещества из газоконденсатных месторождений.
Свойства составляющих веществ
Четыре первых члена гомологического ряда при обычных условиях — горючие газы, не обладающие цветом и запахом, взрывоопасны и горючи:
Метан
 Первое вещество ряда алканов наиболее устойчиво к температурам. Оно малорастворимо в воде и легче воздуха. Горение метана в воздухе знаменуется появлением голубого пламени. Самый мощный взрыв происходит, при смешивании одного объема метана с десятью объемами воздуха. При других объемных соотношениях тоже происходит взрыв, но меньшей силы. Помимо этого, человеку может быть нанесен непоправимый вред при вдыхании газа высокой концентрации.
Первое вещество ряда алканов наиболее устойчиво к температурам. Оно малорастворимо в воде и легче воздуха. Горение метана в воздухе знаменуется появлением голубого пламени. Самый мощный взрыв происходит, при смешивании одного объема метана с десятью объемами воздуха. При других объемных соотношениях тоже происходит взрыв, но меньшей силы. Помимо этого, человеку может быть нанесен непоправимый вред при вдыхании газа высокой концентрации.
Метан может находиться в твердом агрегатном состоянии в виде газовых гидратов.
Применение:
Его используют в качестве промышленного топлива и сырья. Метан применяют для получения ряда важных продуктов — водорода, фреонов, муравьиной кислоты, нитрометана и многих других веществ. С помощью для производства метилхлорида и его гомологичных соединений, метан подвергают хлорированию. При незаконченном сгорании метана получается мелкодисперсный углерод:
CH4 + O2 = C + 2H2O
Формальдегид появляется посредством протекания реакции окисления, а при реакции с серой — сероуглерод.
Разлом углеродных связей метана под воздействием температур и тока реализует получение ацетилена, используемого в промышленности. Синильная кислота производится посредством окисления метана с аммиаком. Метан — производное водорода в генерации аммиака, а также получения синтез-газа происходит с его участием:
CH4 + H2O —> CO+ 3H2
Используемого для связки углеводородов, спиртов, альдегидов и других веществ. Метан активно используют в качестве горючего для транспортных средств.
Этан
Углеводород предельного ряда С2Н6 — это бесцветное вещество в газообразном состоянии, слабо освещающее при горении. Растворяется в спирте в отношении 3:2, как говорится, «подобное в подобном», но почти нерастворим в воде. При температуре свыше 600° С, в отсутствие ускорителя реакции этан разлагается на этилен и водород:
CH4 + H2O —> CO+ 3H2
Этан не используют топливной промышленности, основная цель его использования в промышленности — получение этилена.
Пропан
Этот газ плохо растворяется водой и является широко используемым видом топлива. Он производит много тепла при сгорании, практичен в использовании. Пропан — побочный продукт процесса kracking в нефтепромышленности.
Бутан
Имеет малую токсичность,специфический запах, обладает одурманивающими свойствами, вдыхание бутана вызывает асфиксию и сердечную аритмию, негативно влияет на нервную систему. Появляется при крекинге попутного нефтяного газа.
Применение:
 Неоспоримыми достоинствами пропана являются низкая стоимость простота транспортировки. Пропан-бутановую смесь используют в качестве топлива в населенных пунктах, где не подведен природный газ, при обработке легкоплавких материалов с небольшой толщиной, вместо ацетилена. Пропан зачастую применим при заготовке сырья и переработке металлолома. В быту сферой необходимости является отопление помещений и приготовление пищи на газовых плитах.
Неоспоримыми достоинствами пропана являются низкая стоимость простота транспортировки. Пропан-бутановую смесь используют в качестве топлива в населенных пунктах, где не подведен природный газ, при обработке легкоплавких материалов с небольшой толщиной, вместо ацетилена. Пропан зачастую применим при заготовке сырья и переработке металлолома. В быту сферой необходимости является отопление помещений и приготовление пищи на газовых плитах.
Помимо предельных алканов в состав природного газа входят:
Азот
Азот состоит из двух изотопов 14A и 15A, используется для поддержания давления в скважинах при бурении. Для получения азота сжижают воздух и разделяют его разгонкой, этот элемент составляет 78% состава воздуха. В основном его используют для производства аммиака, из которого получают азотную кислоту, удобрения и взрывчатые вещества.
Диоксид углерода
Соединение, переходящее при атмосферном давлении из твердого (сухой лед) в газообразное состояние. Оно выделяется при дыхании живых существ, также содержится в минеральных источниках и воздухе. Диоксид углерода является пищевой добавкой, используется в баллонах огнетушителей и пневматическом оружии.
Сероводород
Очень токсичный газ — самый активный из серосодержащих соединений, а потому очень опасен для человека прямым воздействием на нервную систему. Бесцветный газ в нормальных условиях, характеризующийся сладковатым вкусом и отвратительным запахом протухших яиц. Хорошо растворим в этаноле, в отличие от воды. Из него получают серу, серную кислоту и сульфиты.
Гелий
 Это уникальный продукт, медленно накапливающийся в коре Земли.Его получают методом глубокой заморозки содержащих гелий газов. В газообразном состоянии — инертный газ, не обладающий внешним выражением. Гелий в жидком состоянии, также не имеющая ни запаха, ни цвета, но может поражать живые тканей. Гелий не токсичный, не может взорваться или воспламениться, однако при высоких концентрациях в воздухе вызывает удушье. Его используют при работе с металлами и в качестве наполнителя воздушных шаров и дирижаблей.
Это уникальный продукт, медленно накапливающийся в коре Земли.Его получают методом глубокой заморозки содержащих гелий газов. В газообразном состоянии — инертный газ, не обладающий внешним выражением. Гелий в жидком состоянии, также не имеющая ни запаха, ни цвета, но может поражать живые тканей. Гелий не токсичный, не может взорваться или воспламениться, однако при высоких концентрациях в воздухе вызывает удушье. Его используют при работе с металлами и в качестве наполнителя воздушных шаров и дирижаблей.
Аргон
Благородный негорючий, не ядовитый, не имеющий вкусовых и цветовых качеств. Добывается как эскортный разделению воздуха на кислород и азот газ. Используется для вытеснения воды и кислорода, с целью продлить срок хранения продуктов питания, его также используют при сварке металлов и резке.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Источник
![]()
1
2 ответа:
![]()
4
0
Газы обладают, в общем-то, многими из тех свойств, которыми обладают другие тела (конечно, у них нет таких свойств твердых тел, как твердость). Например, среди свойств газов – давление, температура, объем, удельная и мольная теплоемкость, молярный объем, плотность, температура перехода в жидкое состояние, теплопроводность, скорость звука при данных температуре и давлении, степень отклонения от идеального поведения (например, параметры уравнения Ван-дер-Ваальса), магнитная восприимчивость, молярная энтальпия и энтропия, приведенный термодинамический потенциал, показатель преломления света при разных длинах волн и так далее. Есть у большинства газов, кроме физических, также химические свойства.
![]()
3
0
Я бы сказала, что главное свойство газа, которое отличает его от твердого тела и жидкости – это способность газа полностью заполнять тот объем в котором находится. Например стакан воды может быть наполовину полон, а стакан газа оказывается полным всегда.
Зато в отличии от твердого тела газы не имеют постоянной формы и постоянного объема, а принимают ту форму, которую имеет сосуд в котором газ находится, в этом заметно сходство со свойствами жидкости.
Газы могут сжиматься, могут нагреваться и охлаждаться, имеют некую плотность и следовательно массу. Есть и многие другие физические свойства газов, но основные я уже перечислила.
Читайте также
![]()
Вопрос сформулирован не корректно. В нем содержится неверное утверждение. Как раз наоборот , постоянные магниты теряют свои магнитные свойства и качество магнитов как раз и обусловлено , как долго они сохраняются. В окружающей нас жизни самые долговечные и сильные магниты можно встретить в жестких дисках запоминающих устройств.
![]()
Может вы имеете в виду материал “Винил/искожа”? Тканевая основа, сверху нанесён цветной резиноподобный слой? Он же в простонародье дермантин. А кожа – то бишь натуральная кожа – суть шкура животного с эпилированной шерстью, выделанная особым образом для мягкости и эластичности – к этому исскуственному материалу (дермантину) прямого отношения не имеет. Только по внешности. То бишь дермантин – искусственный заменитель кожи.
![]()
Этот металл платиновой группы широко применим в промышленности- защитные покрытия на его основе, долговечны, “вечные перья”, эталоны мер, в химической промышленности,( в виде сплавов с платиной, осмием и др. в общем, применение этому тугоплавкому и инертному металлу находится.
![]()
Кал это отходы жизнедеятельности ЖКТ. И в его составе находится как не полностью переваренная,так и переваренная пища.Ответ такой,что все,что с физической стороны легче,то оно не тонет,потому что имеет наименьшую плотность, чем у самой воды.
Если кал не тонет,то значит у него избыток газов, а это не совсем хорошо. По калу можно судить о показателях здоровья.Самый правильный кал не должен плавать на поверхности воды, а также и не должен быстро идти ко дну,типа камня.
Здоровый кал кал должен находиться как бы в притопленном состоянии в воде, но не до конца.В кале образуются микропоры, которые и влияют на его плавучесть.Чем больше в нем растительной будет пищи переработанной,тем дольше он не будет тонуть.
![]()
по моему мнению это стекло, насколько мне известно, если его перекалить, то оно становится очень хрупким. А при ударе оно разлетается вдребезги.
Источник
