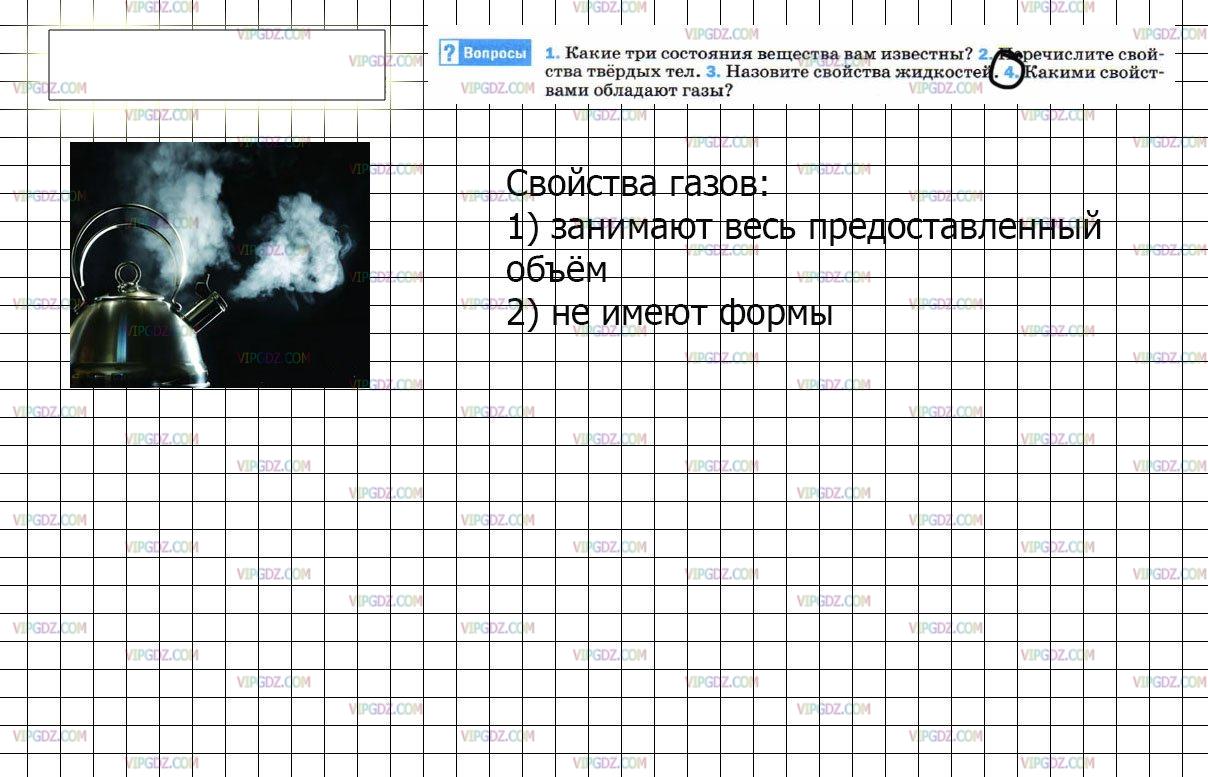
Какими свойствами обладают газы физика

Как известно, абсолютно все вещества в природе обладают собственным агрегатным состоянием, наиболее распространенным из которых является газ. Составляющие его элементы – молекулы и атомы – находятся друг от друга на большом расстоянии. При этом они расположены в свободном постоянном движении. Эта особенность указывает на то, что взаимодействие элементарных частиц осуществляется только в момент сближения, внезапно увеличивая скорость сталкивающихся атомов и их величину. Именно этим свойством газообразное состояние любого вещества отличается от жидкого и твердого.
Законы, определяющие характеристики и поведение такого вещества, проще всего сформулировать и исследовать на примере состояния, в котором наблюдается низкая плотность молекул и атомов низкая.
Данное явление получило в физике название «идеальный газ», предполагающее максимальное расстояние между частицами, которое превышает радиус взаимодействия межмолекулярных сил.
Определение 1
Итак, идеальный газ – это теоретическая и комплексная модель физического вещества, в которой практически полностью отсутствует взаимодействие элементарных частиц.
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Для него обязательно должны существовать такие условия:
- достаточно маленькие размеры молекул;
- отсутствие силы взаимодействия между элементами;
- столкновения должны происходят как столкновения упругих шариков.
Пример 1
Ярким примером указанного состояния вещества можно назвать газы, в которых относительное давление при крайне низкой температуре не превышает атмосферное в 100 раз. Они в основном причисляются к разряженным.
Само определение “физика” дало возможность современной науке выстроить универсальную молекулярно-кинетическую гипотезу, выводы которой находят экспериментальной подтверждение во многих сферах. По такому различаются газы классические и квантовые.
Классические и квантовые газы: особенности и различие
Характеристики классических газов находят отражение в законах и методах статистической физики. Движение элементарных частиц в этом газе не зависит друг от друга, а оказываемое давление на стенку приравнивается сумме внутренних импульсов, которые при очередном столкновении передаются конкретным молекулами за определенный период времени. Их начальная энергия же в общем составляет объединенную элементами систему.
Работа газа в этом случае всегда рассчитывается посредством уравнения Клапейрона $p = nkT$. Наиболее ярким примером такого явления выступают законы, которые были ранее выведены известными физиками-теоретиками Бойль-Мариоттом и Гей-Люссаком. Если идеальный газ самостоятельно понижает температуру или увеличивает плотность движущихся частиц до определенного показателя, следовательно, повышаются его волновые свойства. Происходит трансформация газа в квантовое состояние, при котором длина волн молекул и атомов сравнима с первостепенным расстоянием между ними. Здесь выделяют два типа идеального газа: в виде учений Бозе и Эйнштейна, где элементы одного вида имеют целочисленный спин; а также статистику Ферми и Дирака, предполагающую наличие частиц, имеющих полуцелый спин.
Замечание 1
Основное отличие классического газа от квантового заключается в том, что даже при абсолютно нулевой температуре параметр плотности внутренней энергии и давления будет отличаться от нуля.
Эти физические величину способны стать больше только при увеличении плотности. В такой ситуации частицы обладают максимальным энергетическим потенциалом. С этой точки зрения необходимо рассматривать теорию строения звезд: в тех из них, в которых начальная плотность выше 1—10 кг/см3, работает закон электронов. А где указанный параметр превышает 109 кг/см3, физическое вещество постепенно превращается в нейроны.
В металлах применение теории, при которой классический газ трансформируется в квантовый, позволяет точно объяснить большую часть металлических характеристик состояния вещества: чем плотнее элементарные частицы, тем система ближе к идеалу. При явно выраженных низких температурах разнообразных тел в жидких и твердых состояниях хаотичное движение молекул возможно изучать, как работу идеального газа, который представлен слабыми возбуждениями. В этих случаях наблюдается вклад в энергию вещества, который добавляют частицы.
Зависимость плотности газа от температуры
Рисунок 1. Плотность газа. Автор24 — интернет-биржа студенческих работ
Плотность газа считается одной из важнейших особенностей его свойств. Говоря о данной величине, ученые в основном имеют в виду плотность тел при нормальных условиях (то есть при температуре примерно 0° С и давлении не более 760 мм рт. ст.). Кроме того, зачастую пользуются относительной плотностью идеального газа, которая предполагает правильное соотношение давления веществ к плотности воздуха при аналогичных условиях.
Таким образом, относительная плотность газа не зависит от условий, в которых он расположен, так как согласно гипотезам газового состояния, объемы всех элементов меняются при изменениях температуры и давления одинаково.
Что же на самом деле происходит с плотностью некоторой массы исследуемого объекта, если температура увеличивается, а давление остается прежним? Здесь необходимо вспомнить, что плотность любого физического вещества равна массе тела, деленной на его объем. Так как масса газа всегда постоянна, то при нагревании плотность будет уменьшаться во столько раз, во сколько увеличился сам объем.
Рисунок 2. Относительная плотность газа. Автор24 — интернет-биржа студенческих работ
Объем газа прямо пропорционален абсолютной и начальной температуре, если давление остается неизменным. Следовательно, данная величина при постоянном давлении обратно пропорциональна абсолютной температуре.
Теплоемкость газов
Рисунок 3. Тепловые процессы в газах. Автор24 — интернет-биржа студенческих работ
Представим, что у нас есть 1 г газа. Сколько необходимо сообщить теплоты для того, чтобы его температура возросла на 1°С? На этот вопрос, как показывает практика, невозможно предоставить однозначный ответ. Все зависит от того, в каких условиях осуществляется нагревание газа. Если объем его в результате не меняется, то для нагревания элементов нужно определенное количество теплоты; при этом автоматически увеличивается давление самого газа.
Если же нагревание происходит так, что начальное давление его остается неизменным, то следует использовать большее количество теплоты, при которой объем газа увеличится в несколько раз. Наконец, возможны и другие случаи, когда при нагревании меняются и давление, и объем: при этом потребуется такое количество теплоты, которое зависит от того, в какой степени происходят эти преобразования. Согласно сказанному, газ может иметь самые различные удельные теплоемкости, находящиеся в зависимости от условий нагревания.
Обычно выделяют две из всех этих удельных теплоемкостей:
- удельную теплоемкость при неизменном объеме ($C_v$);
- удельную теплоемкость при постоянном давлении ($C_p$).
Для определения $C_v$ необходимо нагревать газ, который помещен в замкнутый сосуд. Расширением самого предмета при нагревании можно иногда пренебречь. При определении $C_p$ желательно нагревать газ, находящийся в цилиндре, закрытый поршнем, нагрузка на который остается в любых условиях неизменной.
Теплоемкость при стабильном давлении $C_p$ значительно больше, чем теплоемкость при постоянном объеме $C_v$.
Действительно, при медленном нагревании 1 г вещества на 1° при неизменном объеме подводимая теплота направлена на увеличение внутреннего энергетического потенциала. Для нагревания же на 1° аналогичной массы газа при постоянном давлении необходимо сообщить ему определенное количество тепла, за счет которого увеличивается и внутренняя энергия газа, и совершится работа, непосредственно связанная с расширением газа.
Источник
ГДЗ по классам
2 класс
- Математика
3 класс
- Математика
4 класс
- Математика
5 класс
- Математика
- Русский язык
- Английский язык
6 класс
- Математика
- Русский язык
- Английский язык
7 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
8 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
9 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
10 класс
- Геометрия
- Химия
11 класс
- Геометрия
ГДЗ и решебники
вип уровня
- 2 класс
- Математика
- 3 класс
- Математика
- 4 класс
- Математика
- 5 класс
- Математика
- Русский язык
- Английский язык
- 6 класс
- Математика
- Русский язык
- Английский язык
- 7 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- 8 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
- 9 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
- 10 класс
- Геометрия
- Химия
- 11 класс
- Геометрия
- ГДЗ
- 7 класс
- Физика
- Пёрышкин
- Вопрос 4, Параграф 12

Назад к содержанию
Условие
Какими свойствами обладают газы?
Решение 1

Решение 2

Решение 3
Другие задачи из этого учебника
- 1
- 2
- 3
- 4
Поиск в решебнике
Популярные решебники
 ГДЗ по Физике за 7 класс: Пёрышкин А.В.
ГДЗ по Физике за 7 класс: Пёрышкин А.В.
Издатель: А. В. Перышкин – 2013г.
 ГДЗ по Физике за 7-9 класс: Пёрышкин А.В. (сборник задач)
ГДЗ по Физике за 7-9 класс: Пёрышкин А.В. (сборник задач)
Издатель: А.В. Пёрышкин, 2013г.
Источник
На сегодняшний день известно о существовании более чем 3 миллионов различных веществ. И цифра эта с каждым годом растет, так как химиками-синтетиками и другими учеными постоянно производятся опыты по получению новых соединений, обладающих какими-либо полезными свойствами.
Часть веществ – это природные обитатели, формирующиеся естественным путем. Другая половина – искусственные и синтетические. Однако и в первом и во втором случае значительную часть составляют газообразные вещества, примеры и характеристики которых мы и рассмотрим в данной статье.

Агрегатные состояния веществ
С XVII века принято было считать, что все известные соединения способны существовать в трех агрегатных состояниях: твердые, жидкие, газообразные вещества. Однако тщательные исследования последних десятилетий в области астрономии, физики, химии, космической биологии и прочих наук доказали, что есть еще одна форма. Это плазма.
Что она собой представляет? Это частично или полностью ионизированные газы. И оказывается, таких веществ во Вселенной подавляющее большинство. Так, именно в состоянии плазмы находятся:
- межзвездное вещество;
- космическая материя;
- высшие слои атмосферы;
- туманности;
- состав многих планет;
- звезды.
Поэтому сегодня говорят, что существуют твердые, жидкие, газообразные вещества и плазма. Кстати, каждый газ можно искусственно перевести в такое состояние, если подвергнуть его ионизации, то есть заставить превратиться в ионы.
Газообразные вещества: примеры
Примеров рассматриваемых веществ можно привести массу. Ведь газы известны еще с XVII века, когда ван Гельмонт, естествоиспытатель, впервые получил углекислый газ и стал исследовать его свойства. Кстати, название этой группе соединений также дал он, так как, по его мнению, газы – это нечто неупорядоченное, хаотичное, связанное с духами и чем-то невидимым, но ощутимым. Такое имя прижилось и в России.
Можно классифицировать все газообразные вещества, примеры тогда привести будет легче. Ведь охватить все многообразие сложно.
По составу различают:
- простые,
- сложные молекулы.
К первой группе относятся те, что состоят из одинаковых атомов в любом их количестве. Пример: кислород – О2, озон – О3, водород – Н2, хлор – CL2, фтор – F2, азот – N2 и прочие.
Ко второй категории следует относить такие соединения, в состав которых входит несколько атомов. Это и будут газообразные сложные вещества. Примерами служат:
- сероводород – H2S;
- хлороводород – HCL;
- метан – CH4;
- сернистый газ – SO2;
- бурый газ – NO2;
- фреон – CF2CL2;
- аммиак – NH3 и прочие.
Классификация по природе веществ
Также можно классифицировать виды газообразных веществ по принадлежности к органическому и неорганическому миру. То есть по природе входящих в состав атомов. Органическими газами являются:
- первые пять представителей предельных углеводородов (метан, этан, пропан, бутан, пентан). Общая формула CnH2n+2;
- этилен – С2Н4;
- ацетилен или этин – С2Н2;
- метиламин – CH3NH2 и другие.
К категории газов неорганической природы относятся хлор, фтор, аммиак, угарный газ, силан, веселящий газ, инертные или благородные газы и прочие.
Еще одной классификацией, которой можно подвергнуть рассматриваемые соединения, является деление на основе входящих в состав частиц. Именно из атомов состоят не все газообразные вещества. Примеры структур, в которых присутствуют ионы, молекулы, фотоны, электроны, броуновские частицы, плазма, также относятся к соединениям в таком агрегатном состоянии.
Свойства газов
Характеристики веществ в рассматриваемом состоянии отличаются от таковых для твердых или жидких соединений. Все дело в том, что свойства газообразных веществ особенные. Частицы их легко и быстро подвижны, вещество в целом изотропное, то есть свойства не определяются направлением движения входящих в состав структур.
Можно обозначить самые главные физические свойства газообразных веществ, которые и будут отличать их от всех остальных форм существования материи.
- Это такие соединения, которые нельзя увидеть и проконтролировать, ощутить обычными человеческими способами. Чтобы понять свойства и идентифицировать тот или иной газ, опираются на четыре описывающих их все параметра: давление, температура, количество вещества (моль), объем.
- В отличие от жидкостей газы способны занимать все пространство без остатка, ограничиваясь лишь величиной сосуда или помещения.
- Все газы между собой легко смешиваются, при этом у этих соединений нет поверхности раздела.
- Существуют более легкие и тяжелые представители, поэтому под действием силы тяжести и времени, возможно увидеть их разделение.
- Диффузия – одно из важнейших свойств этих соединений. Способность проникать в другие вещества и насыщать их изнутри, совершая при этом совершенно неупорядоченные движения внутри своей структуры.
- Реальные газы электрический ток проводить не могут, однако если говорить о разреженных и ионизированный субстанциях, то проводимость резко возрастает.
- Теплоемкость и теплопроводность газов невысока и колеблется у разных видов.
- Вязкость возрастает с увеличением давления и температуры.
- Существует два варианта межфазового перехода: испарение – жидкость превращается в пар, сублимация – твердое вещество, минуя жидкое, становится газообразным.
Отличительная особенность паров от истинных газов в том, что первые при определенных условиях способны перейти в жидкость или твердую фазу, а вторые нет. Также следует заметить способность рассматриваемых соединений сопротивляться деформациям и быть текучими.

Подобные свойства газообразных веществ позволяют широко применять их в самых различных областях науки и техники, промышленности и народном хозяйстве. К тому же конкретные характеристики являются для каждого представителя строго индивидуальными. Мы же рассмотрели лишь общие для всех реальных структур особенности.
Сжимаемость
При разных температурах, а также под влиянием давления газы способны сжиматься, увеличивая свою концентрацию и снижая занимаемый объем. При повышенных температурах они расширяются, при низких – сжимаются.
Под действием давления также происходят изменения. Плотность газообразных веществ увеличивается и, при достижении критической точки, которая для каждого представителя своя, может наступить переход в другое агрегатное состояние.
Основные ученые, внесшие вклад в развитие учения о газах
Таких людей можно назвать множество, ведь изучение газов – процесс трудоемкий и исторически долгий. Остановимся на самых известных личностях, сумевших сделать наиболее значимые открытия.
- Амедео Авогадро в 1811 году сделал открытие. Неважно, какие газы, главное, что при одинаковых условиях их в одном объеме их содержится равное количество по числу молекул. Существует рассчитанная величина, имеющая название по фамилии ученого. Она равна 6,03*1023 молекул для 1 моль любого газа.
- Ферми – создал учение об идеальном квантовом газе.
- Гей-Люссак, Бойль-Мариотт – фамилии ученых, создавших основные кинетические уравнения для расчетов.
- Роберт Бойль.
- Джон Дальтон.
- Жак Шарль и многие другие ученые.
Строение газообразных веществ
Самая главная особенность в построении кристаллической решетки рассматриваемых веществ, это то, что в узлах ее либо атомы, либо молекулы, которые соединяются друг с другом слабыми ковалентными связями. Также присутствуют силы ван-дер-ваальсового взаимодействия, когда речь идет о ионах, электронах и других квантовых системах.
Поэтому основные типы строения решеток для газов, это:
- атомная;
- молекулярная.
Связи внутри легко рвутся, поэтому эти соединения не имеют постоянной формы, а заполняют весь пространственный объем. Это же объясняет отсутствие электропроводности и плохую теплопроводность. А вот теплоизоляция у газов хорошая, ведь, благодаря диффузии, они способны проникать в твердые тела и занимать свободные кластерные пространства внутри них. Воздух при этом не пропускается, тепло удерживается. На этом основано применение газов и твердых тел в совокупности в строительных целях.

Простые вещества среди газов
Какие по строению и структуре газы относятся к данной категории, мы уже оговаривали выше. Это те, что состоят из одинаковых атомов. Примеров можно привести много, ведь значительная часть неметаллов из всей периодической системы при обычных условиях существует именно в таком агрегатном состоянии. Например:
- фосфор белый – одна из аллотропных модификаций данного элемента;
- азот;
- кислород;
- фтор;
- хлор;
- гелий;
- неон;
- аргон;
- криптон;
- ксенон.
Молекулы этих газов могут быть как одноатомными (благородные газы), так и многоатомными (озон – О3). Тип связи – ковалентная неполярная, в большинстве случаев достаточно слабая, но не у всех. Кристаллическая решетка молекулярного типа, что позволяет этим веществам легко переходить из одного агрегатного состояния в другое. Так, например, йод при обычных условиях – темно-фиолетовые кристаллы с металлическим блеском. Однако при нагревании сублимируются в клубы ярко-фиолетового газа – I2.

К слову сказать, любое вещество, в том числе металлы, при определенных условиях могут существовать в газообразном состоянии.
Сложные соединения газообразной природы
Таких газов, конечно, большинство. Различные сочетания атомов в молекулах, объединенные ковалентными связями и ван-дер-ваальсовыми взаимодействиями, позволяют сформироваться сотням различных представителей рассматриваемого агрегатного состояния.
Примерами именно сложных веществ среди газов могут быть все соединения, состоящие из двух и более разных элементов. Сюда можно отнести:
- пропан;
- бутан;
- ацетилен;
- аммиак;
- силан;
- фосфин;
- метан;
- сероуглерод;
- сернистый газ;
- бурый газ;
- фреон;
- этилен и прочие.
Кристаллическая решетка молекулярного типа. Многие из представителей легко растворяются в воде, образуя соответствующие кислоты. Большая часть подобных соединений – важная часть химических синтезов, осуществляемых в промышленности.
Метан и его гомологи
Иногда общим понятием “газ” обозначают природное полезное ископаемое, которое представляет собой целую смесь газообразных продуктов преимущественно органической природы. Именно он содержит такие вещества, как:
- метан;
- этан;
- пропан;
- бутан;
- этилен;
- ацетилен;
- пентан и некоторые другие.
В промышленности они являются очень важными, ведь именно пропан-бутановая смесь – это бытовой газ, на котором люди готовят пищу, который используется в качестве источника энергии и тепла.

Многие из них используются для синтеза спиртов, альдегидов, кислот и прочих органических веществ. Ежегодное потребление природного газа исчисляется триллионами кубометров, и это вполне оправданно.
Кислород и углекислый газ
Какие вещества газообразные можно назвать самыми широко распространенными и известными даже первоклассникам? Ответ очевиден – кислород и углекислый газ. Ведь это они являются непосредственными участниками газообмена, происходящего у всех живых существ на планете.
Известно, что именно благодаря кислороду возможна жизнь, так как без него способны существовать только некоторые виды анаэробных бактерий. А углекислый газ – необходимый продукт “питания” для всех растений, которые поглощают его с целью осуществления процесса фотосинтеза.
С химической точки зрения и кислород, и углекислый газ – важные вещества для проведения синтезов соединений. Первый является сильным окислителем, второй чаще восстановитель.
Галогены
Это такая группа соединений, в которых атомы – это частицы газообразного вещества, соединенные попарно между собой за счет ковалентной неполярной связи. Однако не все галогены – газы. Бром – это жидкость при обычных условиях, а йод – легко возгоняющееся твердое вещество. Фтор и хлор – ядовитые опасные для здоровья живых существ вещества, которые являются сильнейшими окислителями и используются в синтезах очень широко.
Источник

