Какими свойствами обладают ферменты как белки
В каждой клетке организме постоянно происходят сотни различных биохимических процессов. Все они сопровождаются распадом и окислением питательных веществ, поступающих извне.
Процессы сложные, многосоставные, и об их особенностях можно рассказывать долго. Но все они протекают быстро благодаря катализаторам биохимических реакций, которыми являются белки-ферменты.
Что они собой представляют? Какова их роль, свойства, функции? Об этом сейчас речь и пойдет.
Определение
Итак, белок-фермент – это совокупность сложных молекул белка и рибосом либо их целые комплексы. Именно они ускоряют все происходящие в живых системах химические реакции. Происходит это, разумеется, определенным образом.
Каждый фермент «свернут» в определенную структуру. И он ускоряет конкретную, соответствующую его характеристикам реакцию. Кстати, в таком «тандеме» реагенты именуют субстратами. А получившиеся в результате реакции вещества – продуктами.
Ферменты по отношению к субстратам весьма специфичны. Аденозинтрифосфатазы, например, катализируют исключительно отщепление остатков фосфорной кислоты от аденозинтрифосфорной. Другой пример – киназа фосфорилазы. Она, в свою очередь, переносит к субстрату остатки только фосфорной кислоты.

Регуляция активности
Белки-ферменты могут действовать по-разному. Их активность регулируется двумя типами веществ:
- Активаторы. Вследствие их воздействия активность повышается. При ассоциации с ДНК эти вещества усиливают транскрипцию определенного гена. Яркий пример – Gal8. Он активирует гены, которые ответственны за усвоение дрожжами галактозы.
- Ингибиторы. Они, как можно предположить, активность понижают, задерживая течение физико-химических и физиологических процессов. В качестве примера можно привести гидрохинон. Это ароматическое органическое соединение является ингибитором окисления бензальдегида.
К слову, синтезируются белки-ферменты на рибосомах. Эти органеллы производят их из аминокислот, основываясь на генетическую информацию.

Состав
Есть еще множество вопросов, касающихся белков-ферментов, расщепляющие различные вещества, поступающие в организм. Почему, например, их молекулы больше, чем у субстратов? И каким вообще образом аминокислоты, которые сами не могут ускорять химические реакции, создают мощнейшие каталитические системы, соединяясь в специфические последовательности?
Но зато медицине многое известно об их составе. Каждый фермент представляет собой соединение собственно белковых частей и связанные с ними активные центры. В их молекулах принято отличать активный А-центр – это место в пространственной структуре, с которым контактирует субстрат S. Также есть белковая часть – ее именуют либо апоэнзимом, либо апоферментом.
Можно еще объяснить иначе. Ферменты образованы из полипептидов – это такие вещества, которые состоят из остатков аминокислот. А те, в свою очередь, являются органическими соединениями, содержащие в себя как аминные, так и карбоксильные группы.
Специфика воздействия
Состоящие из остатков аминокислот белки-ферменты обеспечивают одну либо несколько однотипных реакций (каждый).
К примеру, жиры внутри клеток и в пищеварительном тракте расщепляются липазой. Это водорастворимый фермент, не действующий на белки и полисахариды. В то же время вещество, расщепляющее гликоген или крахмал, не оказывает никакого эффекта на жиры.
Интересно, что каждый молекула фермента осуществляет от нескольких тысяч до миллионов действий в минуту. В ходе этих процессов белок не расходуется вообще. Наоборот, он образует симбиоз с реагирующими веществами, ускоряя их превращения. После окончания он выходит из реакции в неизменном виде.
Свойства
Их тоже надо рассмотреть, изучая роль белков-ферментов. Вообще, свойства этих веществ можно выделить в такой список:
- Способность путем высаливания осаждаться из растворов.
- Амфотерность.
- Электрофоретическая подвижность.
- Способность к кристаллизации.
- Высокая специфичность действия.
- Зависимость реакции от рН-среды, активаторов, ингибиторов и температуры.
Последние качества обусловлены регулируемой активностью ферментов. Благодаря этой специфике удается изменять скорость превращения веществ вы зависимости от условий среды, в которых они находятся.
Интересно, что у некоторых белков-ферментов, расщепляющих жиры, углеводы и прочие элементы, есть стереохимическая специфичность. Так называется их способность катализировать превращение лишь одного стереоизомера субстрата. К примеру, фумароза способна расщепить исключительно транс-изомер-фумаровую кислоту. Взаимодействовать с cis-изомером она уже не будет.
Зависимость от температуры
Она довольно весомая. С повышением температуры на каждые десять градусов скорость ферментативной реакции увеличивается примерно в два-три раза.
Но, если сравнивать с минеральными катализаторами, то закономерность эта дает о себе знать только в конкретном температурном интервале, который может варьироваться от 0°C до 37-40 °C.
Когда же фермент начинает работать на максимуме? Наибольшая активность проявляется тогда, когда и температура достигает предела в 40 °C. Если она поднимется еще выше, то начнется денатурация.
Ферменты, подчиняющиеся данной закономерности, принято называть термолабильностью. Это – ключевое качество, отличающие белки от минеральных катализаторов.
Но есть среди ферментов термостабильные соединения, на которые высокие температуры негативно не воздействуют. Более того, некоторые из них их выдерживают, и даже под их влиянием проявлять максимальную активность. К таковым относится миокиназа мышц. Она сохранит активность даже в том случае, если температура достигнет 100 °C.
При 0 °C ферментативная реакция практически прекращается. Но это ингибирование обратимо. При нормальном температурном режиме активность вещества восстановится. Это доказывают ферменты, которые были выделены из туши мамонтов, годами находившихся в условиях ледникового периода. При создании нормальной температуры они проявляли хорошую активность.
А некоторые ферменты и при низкой температуре ее демонстрируют. Например, амилаза картофеля. При -4 °C она действует в разы более активно, чем при плюсовых показателях. Кстати, этим обусловлен сладковатый вкус слегка замерзшей картошки.

Классификация
Рассказывая об особенностях и функциях белков-ферментов, нужно отметить, что на данный момент известно более 2000 их видов. Но количество постоянно увеличивается.
Условно ферменты делятся на 6 групп. В качестве критерия классификации выступает характер реакций, который они вызывают.
Также стоит упомянуть, что процесс синтеза или расщепления какого-либо вещества в клетке обычно делится на ряд химических операций. Каждая из них выполняется отдельным белком-ферментом. Группы таких элементов составляют некий биохимический конвейер.
По сути, каждый фермент – это своеобразная молекулярная машина. Благодаря определенному расположению аминокислот и пространственной структуре своих компонентов, он имеет способность узнавать «свой» субстрат среди остальных. Поэтому присоединение выполняется мгновенно, что и обуславливает скорость химических реакций.
Обратные связи
Всем вышеперечисленным не ограничиваются свойства белков-ферментов. Не был отмечен вниманием еще один немаловажный нюанс.
Дело в том, что в белковых молекулах многих ферментов имеются участки, способные узнавать еще и конечный продукт – тот, который, так сказать, «сходит» с полиферментного биохимического конвейера.
Плохо, если его слишком много. Потому что в таком случае активность начального фермента начинает тормозиться. Ничем не лучше, если конечного продукта мало. Потому что тогда фермент активируется.
Собственно говоря, таким образом множество биохимических процессов и происходит. Это – обратные связи, обеспечивающие саморегуляцию. Если задуматься и провести параллель, то такие же принципы прослеживаются в работе современной технике. В природных механизмах, в живых клетках, все аналогично.
Сходство с минеральными катализаторами
Что же, исходя из вышесказанного, можно понять, какую функцию выполняют белки-ферменты. Теперь нужно немного поговорить об их сходствах с минеральными катализаторами. Можно выделить такой перечень:
- Ферменты проявляют свое действие в крайне небольших концентрациях. Амилаза способна ускорить гидролиз крахмала, будучи разведенной в пропорциях 1:1000000.
- В ходе катализируемой белком реакции он сам не расходуется, покидая ее в неизменном виде (это уже упоминалось ранее).
- Ферменты не смещают химическое равновесие. Эти вещества могут ускорить как обратную, так и прямую реакцию. Направленность определит концентрация исходных субстратов, а также конечных продуктов.
- Ферменты не способны инициировать реакцию. Они только влияют на скорость химических превращений.
- Они уменьшают уровень энергии активации. Ферменты могут обеспечить течение реакции, обойдя так называемый энергетический барьер.
Последний факт особенно интересен. Такая особенность обусловлена тем, что фермент в ходе своей реакции начинает взаимодействовать с субстратом, образуя промежуточное соединение – фермент-субстратный комплекс.
Что же происходит? Конформация субстрата меняется, ковалентные связи напрягаются, а потому энергии, необходимой для разрыва, требуется меньше.
Как можно видеть, казалось бы сложный процесс на самом деле можно очень просто объяснить, если вникнуть в подробности.
Источник
В каждой живой клетке происходит множество химических реакций. Ферменты (энзимы) – белки с особыми и крайне важными функциями. Их называют биокатализаторами. Основная функция белков-ферментов в организме заключается в ускорении биохимических реакций. Исходные реагенты, взаимодействие которых катализируется этими молекулами, именуются субстратами, а конечные соединения – продуктами.
В природе белки-ферменты работают только в живых системах. Но в современной биотехнологии, клинической диагностике, фармацевтике и медицине применяются очищенные энзимы или их комплексы, а также дополнительные компоненты, необходимые для работы системы и визуализации данных для исследователя.
Биологическое значение и свойства ферментов
Без этих молекул живой организм не смог бы функционировать. Все процессы жизнедеятельности слажено работают благодаря энзимам. Главная функция белков-ферментов в организме – регулирование обмена веществ. Без них невозможен нормальный метаболизм. Регуляция активности молекул происходит под действием активаторов (индукторов) или ингибиторов. Контроль действует на разных уровнях синтеза белков. Он также «работает» в отношении уже готовой молекулы.
Основное свойства белков-ферментов – специфичность к определенному субстрату. И, соответственно, способность катализировать только одну или реже ряд реакций. Обычно подобные процессы обратимы. За выполнение обоих функций ответственен один фермент. Но это еще не все.
Роль белков-ферментов существенна. Без них не протекают биохимические реакции. За счет действия ферментов появляется возможность реагентам преодолеть активационный барьер без существенных затрат энергии. В организме нет возможности нагреть температуру более 100 °С или использовать агрессивные компоненты наподобие химической лаборатории. Белок-фермент соединяется с субстратом. В связанном состоянии происходит модификация с последующим освобождением последнего. Именно так действуют все катализаторы, применяемые в химическом синтезе.
Какие уровни организации молекулы белка-фермента?
Обычно эти молекулы имеют третичную (глобула) или четвертичную (несколько соединенных глобул) белковую структуру. Сначала они синтезируются в линейном виде. А потом сворачиваются в требуемую структуру. Для обеспечения активности биокатализатору необходимо определенное строение.
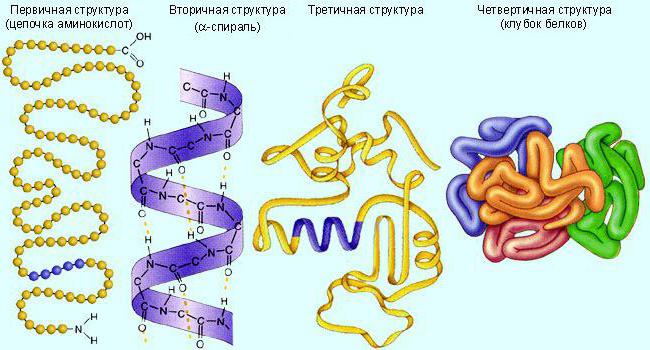
Ферменты, как и другие белки, разрушаются при нагреве, экстремальных значениях pH, агрессивных химических соединений.
Дополнительные свойства ферментов
Среди них выделяют следующие особенности компонентов:
- Стереоспецифичность – образование только одного продукта.
- Региоселективность – разрыв химической связи или модификация группы только в одном положении.
- Хемоселективность – катализ только одной реакции.
Особенности работы
Уровень специфичности ферментов варьируется. Но любой энзим всегда активен в отношении конкретного субстрата или группы соединений, аналогичных по структуре. Небелковые катализаторы не обладают таким свойством. Специфичность измеряется константой связывания (моль/л), которая может достигать 10−10 моль/л. Работа активного фермента стремительна. Одна молекула катализирует тысячи-миллионы операций в секунду. Степень ускорения биохимических реакций существенно (в 1000-100000 раз) выше, чем у обычных катализаторов.
Действие ферментов построено на нескольких механизмах. Наиболее простое взаимодействие происходит с одной молекулой субстрата с последующим образованием продукта. Большинство энзимов способны связывать 2-3 разные молекулы, вступающие в реакцию. Например, перенос группы или атома от одного соединения к другому или двойное замещение по принципу «пинг-понг». В данных реакциях обычно соединяется один субстрат, а второй связывается посредством функциональной группы с ферментом.
Изучение механизма действия фермента происходит с помощью методов:
- Определения промежуточных и конечных продуктов.
- Изучения геометрии структуры и функциональных групп, связываемых с субстратом и обеспечивающих высокую скорость реакции.
- Мутации генов фермента и определения изменения в его синтезе и активности.

Активный и связывающий центр
Молекула субстрата значительно меньше по размеру, чем белок-фермент. Поэтому связывание происходит за счет небольшого числа функциональных групп биокатализатора. Они формируют активный центр, состоящий из определенного набора аминокислот. В сложных белках в структуре присутствует простетическая группа небелковой природы, которая также может входить в состав активного центра.
Следует выделить отдельную группу энзимов. У них в состав молекулы входит кофермент, постоянно связывающийся с молекулой и освобождающийся от нее. Полностью сформированный белок-фермент называется холоферментом, а при удалении кофактора – апоферментом. В качестве коферментов часто выступают витамины, металлы, производные азотистых оснований (НАД – никотинамидадениндинуклеотид, ФАД – флавинадениндинуклеотид, ФМН – флавинмононуклеотид).
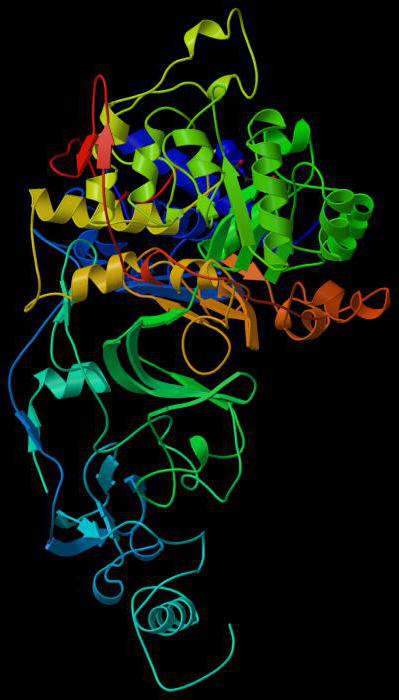
Связывающий центр обеспечивает специфичность сродства к субстрату. За счет него формируется устойчивый субстратно-ферментный комплекс. Структура глобулы построена так, чтобы иметь на поверхности нишу (щель или впадину) определенного размера, обеспечивающего связывание субстрата. Располагается эта зона обычно недалеко от активного центра. У отдельных ферментов есть участки для соединения с кофакторами или ионами металлов.
Заключение
Белок-фермент играет важную роль в организме. Подобные вещества катализируют химические реакции, отвечают за процесс обмена веществ – метаболизм. В любой живой клетке постоянно происходит сотни биохимических процессов, включающих восстановительные реакции, расщепление и синтез соединений. Постоянно происходит окисление веществ с большим выделением энергии. Она в свою очередь тратится на формирование углеводов, белков, жиров и их комплексов. Продукты расщепления являются структурными элементами для синтеза необходимых органических соединений.
Источник
Тимоха Змановский
30 января 2019 · 1,2 K
Имею естественно научное образование, в юношестве прикипел к литературе, сейчас…
Основные свойства ферментов:
- Каталитические
- Высокая специфичность действия
- Неустойчивость
- Зависимость от температуры
- Зависимость от pH
Чем различаются витамины и ферменты что общего между ними?
Мои интересы: разнообразны, но можно выделить следующие: литература, история…
Ферменты (биологические катализаторы) – это белки, в молекуле которых имеется активный центр. В этом центре происходит процесс катализа. Активный центр многих ферментов содержит витамин или получаемое из него вещество. То есть витамин – часть фермента и без витаминов ферменты не работают. По своему биологическому действию витамины близки к ферментам, но ферменты образуются клетками организма, а витамины обычно поступают с пищей.
Что такое ферменты? Чем они отличаются от не органических катализаторов?
Пеку тортики, ищу работу, живу с двумя котами, читаю книги, слушаю и играю…
Ферменты – белковые вещества, изменяющие скорость проекания биохимических процессов в организме.
Вещества, подвергающиеся действию ферментов, называются субстратом.
Ферменты классифицируются на 6 классов, каждый класс еще делится на подклассы, подкласс – на подподклассы, внутри последних идет нумерация ферментов по списку.
Т.е. фермент пепсин 3.4.23.1 относится к классу гидролаз.
Оксидоредуктазы – регулируют окислительно-восстановительные реакции (альдегиддегидрогеназа, алкогольдегидрогеназа).
Трансферазы – регулируют перенос различных функциональных группировок атомов с одной молекулы субстрата на другую.
Гидролазы – ускоряют гидролиз химических связей (амилаза, пепсин)
Лиазы – распад связей без участия гидролиза, обратные реакции.
Изомеразы – образование геометрических, структурных изменений в молекулах субстрата, т.е. изомерных форм.
Лигазы (видел еще название Синтетазы) – отвечают за образование органических химических связей между атомами в субстрате.
Активность ферментов может ускоряться активаторами и замедляться ингибиторами.
Этот параметр является основным фактором саморегуляции обмена веществ в организме. Здесь часто действует обратная связь.
Активаторами могут быть ионы металлов, лекарства, различные соли и пр.
Ингибиторами то же самое, еще разные яды, токсины, отравляющие газы, блокирующие работу фермента частично или полностью, а также обратимо или необратимо.
Неорганические катализаторы – это в основном металлы, соли, а также значения давления и температуры.
Ферменты же – органические вещества, состоящие из “органических” элеметов: углерода, водорода, кислорода, азота, фосфора + опционально ионов металлов, других группировок атомов, модифицирующих их биологическую активность.
Что происходит с пищей под действием ферментов?
Хорошо разбираюсь в биологии, изучаю китайский язык, смотрю китайские…
Под действием ферментов пища и питательные вещества, поступаемые вместе с ней расщепляются на простые, легко усваемые организмом соединения. Пищеварительные ферменты синтезируются пищеварительными железами: слюнными железами, железами слизистой оболочки желудка, поджелудочной железой, железами тонкого кишечника.
Какие бывают химические реакции?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Типы химической реакций????
✅Реакции соединения
А+В➡️АВ
Мg+Cl2➡️MgCl2
✅Реакции разложения :
АВ➡️А+В
Cu(OH)2➡️CuO+H2O
✅Реакции замещения:
АВ+С➡️СВ+А
CuCl2+2K➡️2KCl+Cu
✅Реакции обмена:
AB+CD➡️AD+СВ
Cu(OH)2+H2SO4➡️CuSO4+2H2O
Прочитать ещё 1 ответ
Чем отличается симбиоз от синтеза?
Новоиспеченный врач-педиатр. Люблю путешествовать, музыку, кино, вкусно поесть…
Это просто разные понятия. Если по простому, симбиоз – взаимовыгодное сосуществование (например, бактерий кишечника человека и организма в целом: бактерии вырабатывают витамин К, необходимый для образования в печени витамин-К зависимых факторов свёртывания, необходимых организму для нормальной работы плазменного звена гемостаза, т.е остановки кровотечения; организм же в свою очередь обеспечивает их питание). А синтез, если в химическом/физическом/биологическом смысле, – это процесс создания более сложных веществ из простых. (например, скушали вы белковый продукт, белки в ЖКТ расщепились до аминокислот, которые из кишечника всосались в кровь. Она доставила эти аминокислоты в клетки органов и тканей, где из них произошел синтез собственных белков организма).
Источник
