Какими свойствами обладают буферные растворы во внеклеточной жидкости
Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов. рН буферных растворов мало изменяется при прибавлении к ним небольших количеств сильного основания или сильной кислоты, а также при разбавлении и концентрировании.
Принцип действия буферных систем[править | править код]
Буферные системы представляют из себя смесь кислоты (донора протонов) и сопряженного с ней основания (акцептора протонов), то есть частиц, различающихся на . В растворе устанавливаются равновесия:
(автопротолиз воды)
(диссоциация кислоты, заряды поставлены условно, из предположения, что кислота является нейтральной молекулой)
Каждое из этих равновесий характеризуется своей константой: первое — ионным произведением воды, второе — константой диссоциации кислоты.
При добавлении в систему сильной кислоты, она протонирует основание[1], входящее в буферную смесь, а добавление сильного основания связывает протоны и смещает второе равновесие в сторону продуктов, при этом в итоге концентрация в растворе меняется незначительно[2].
Буферные системы[править | править код]
В качестве буферных смесей могут быть использованы системы:
- слабая кислота и её соль с сильным основанием, например, ацетатный буфер СН3СООН + CH3COONa
- слабое основание и его соль с сильной кислотой, например, аммиачный буфер NH4OH + NH4Cl
- кислая соль и средняя соль слабой кислоты с сильным основанием, например, карбонатный буфер Na2CO3 + NaHCO3
Значение pH буферных растворов можно рассчитать по формулам:
- Для слабой кислоты HA и её соли с сильным основанием BA
- Для слабого основания BOH и его соли с сильной кислотой BA
Например, pH аммиачного буферного раствора NH4OH + NH4Cl определяется формулой:
pH карбонатного буферного раствора выражается формулой:
Буферная ёмкость[править | править код]
Буферные растворы сохраняют своё действие только до определённого количества добавляемой кислоты, основания или степени разбавления, что связано с изменением концентраций его компонентов.
Способность буферного раствора сохранять свой pH определяется её буферной ёмкостью — количеством сильной кислоты или основания, которые следует прибавить к 1 л буферного раствора, чтобы его pH изменился на единицу. Буферная ёмкость тем выше, чем больше концентрация его компонентов.
Буферная ёмкость π определяется по формуле
где dx — концентрация введённой сильной кислоты (основания), т. е. её количество, отнесённое к объёму буферного раствора.
Область буферирования — интервал pH, в котором буферная система способна поддерживать постоянное значение pH. Обычно он равен pKa±1.
Биологическая роль[править | править код]
Буферные растворы имеют большое значение для протекания реакций в живых организмах. Например, в крови постоянство водородного показателя рН (химический гомеостаз) поддерживается тремя независимыми буферными системами: бикарбонатной, фосфатной и белковой. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Примеры буферных растворов[править | править код]
- Калий-фосфатный буфер
- Натрий-фосфатный буфер
- Натрий-ацетатный буфер
- Буферные системы крови
Примечания[править | править код]
- ↑ Алексеев, В.Н. Количественный анализ / Под ред. П.К. Агасяна. – Изд. 4-е, перераб. – М. : Химия, 1972. – 504 с. : 24 табл., 76 рис. С.280
- ↑ Ленинджер А. Основы биохимии. — Мир, 1985. — Т. 1. — С. 93-96. — 367 с.
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Ссылки[править | править код]
- Кислоты и основания
- Примеры составов буферных растворов
Источник
Буферные системы – это системы, способные сохранять постоянное значение рН при разбавлении и при добавлении определенных количеств сильных кислот и оснований.
Буферные системы могут быть образованы:
1. слабой кислотой и ее солью (СН3СООН + СН3СООNa; С6Н5СООН + С6Н5СООNa; НСООН + НСООNa;)
2. слабым основанием и его солью (NН4ОН (NН3.Н2О) + NН4С1)
3. кислой и средней солью слабой кислоты (NаНСО3 + Nа2СО3; Nа2НРО4 + Nа3РО4)
4. одно- и двухзамещенной солью слабой кислоты (Nа2НРО4 + NаН2РО4)
Растворы, содержащие буферные смеси, способные вследствие этого противостоять изменению рН, называются буферными растворами.
Для количественной характеристики способности буферного раствора противостоять влиянию сильных кислот и оснований используется величина, называемая буферной емкостью. По мере увеличения концентрации буферного раствора возрастает его способность сопротивляться изменению рН при добавлении кислот или щелочей.
Буферная емкость – число эквивалентов кислоты или щелочи, которое следует добавить к 1 л буферного раствора, чтобы изменить рН на единицу (понизить при добавлении кислоты и повысить при добавлении щелочи)
В | = | ν(1/Z*кислоты) | или | В | = | ν(1/Z*основания) |
ΔpH×V | ΔpH×V |
где V – объем буферного раствора, л.;
ν(1/Z*Х) – количество эквивалента кислоты или щелочи, моль;
ν(1/ Z*Х) = C(1/ Z*Х)×V(Х);
c(1/ Z*Х) – молярная концентрация эквивалента кислоты (щелочи), моль/л;
V(Х) – объем раствора кислоты (щелочи), л;
∆рН – изменение рН после добавления кислоты (щелочи).
Величина буферной емкости зависит от концентрации компонентов буферной смеси и их отношения между этими концентрациями. С увеличением концентрации компонентов буферной смеси буферная емкость увеличивается. При разбавлении буферной смеси буферная емкость уменьшается.
Буферная емкость максимальна при одинаковых концентрациях соли и кислоты или соли и основания в буферной смеси. Если молярные концентрации эквивалента кислоты и соли равны, то рН буферной смеси будет равен рК к-ты.
Следовательно, для приготовления буферной системы с наибольшей буферной емкостью надо выбирать кислоту с наиболее близкой к заданному значению рН величиной рКк-ты (рН ≈ рКк-ты).
Для смесей, образованных слабым основанием и его солью, рН = 14 – рКосн., т.е. рКосн. ≈ 14 – рН.
Свойства буферных растворов
1. рН буферного раствора зависит от отношения концентраций компонентов буферных систем, а также свойств буферной пары и растворителя.
2. Различные буферные растворы обладают определенной буферной емкостью и сохраняют постоянство рН только до прибавления определенного количества кислоты или щелочи.
3. Буферная емкость тем больше, чем выше концентрация компонентов буферного раствора. Максимальная буферная емкость наблюдается у растворов, которые содержат равные концентрации компонентов буферной пары.
Во внеклеточной и внутриклеточной жидкости существуют четыре основные буферные системы:
– бикарбонатная;
– белковая;
– гемоглобиновая;
– фосфатная.
Главными буферами внеклеточной жидкости является бикарбонатный и гемоглобиновый, в то время как белки и фосфаты — это основные внутриклеточные буферы.
Бикарбонатный буфер является основным и наиболее лабильным внеклеточным буфером. Он состоит из угольной кислоты и бикарбоната (гидрокарбоната) натрия; константой, характеризующей буфер соотношение концентраций кислоты и ее кислой соли.
Внеклеточная буферная система угольной кислоты и гидрокарбоната натрия нейтрализует примерно 40% всех высвобождаемых ионов водорода.
Эта буферная система уникальна тем, что Н2СО3 может диссоциировать на Н2О воду и СО2. В то время как другие буферы быстро становятся неэффективными в результате связывания водородных ионов и анионов слабой кислоты, бикарбонатные системы поддерживают работоспособность в связи с удалением Н2СО3в виде СО2. Лимитирующим параметром эффективности бикарбонатной системы является, по сути дела, начальная концентрация бикарбоната
Гемоглобиновый буфер играет важную роль в регуляции концентрации Н+. Его буферная емкость определяется наличием полярных групп в аминокислотных остатках гемоглобина. Гемоглобин является более важным буфером по сравнению с другими белками, что определяется тремя причинами:
– относительно высокой молярной концентрацией гемоглобина;
– относительно высокой концентрацией в гемоглобине гистидина, рК которого (~7) близко к значению pH крови;
– ролью гемоглобина в транспорте газов крови.
Белковый буфер. Белки, отличные от гемоглобина, представляют собой относительно слабый буфер во внеклеточной жидкости, но в связи с высокой концентрацией белков внутри клеток эта буферная система важна в нейтрализации внутриклеточных сдвигов pH.
Фосфатная буферная пара (НРО2-4 и Н2РО-4) во внеклеточной жидкости представлена в низких концентрациях, но является важной буферной системой мочи.
Буферные системы организма
– Буферы ограничивают изменения pH, вызываемые внесением сильной кислоты или основания.
– Основные буферы внеклеточной жидкости — бикарбонатный и гемоглобиновый.
– Основные буферы внутриклеточной жидкости — белковый и фосфатный.
ПЛОТНОСТЬ ВОДЫ В ИНТЕРВАЛЕ -10÷100 °С
t, °С | ρ·10-3, кг/м3 | t, °С | ρ·10-3, кг/м3 | t, °С | ρ·10-3, кг/м3 | t, °С | ρ·10-3, кг/м3 | t, °С | ρ·10-3, кг/м3 |
-10 | 0,99815 | 17 | 0,99880 | 24 | 0,99732 | 35 | 0,99406 | 70 | 0,97781 |
-5 | 0,99930 | 18 | 0,99862 | 25 | 0,99707 | 40 | 0,99224 | 75 | 0,97489 |
0,99987 | 19 | 0,99843 | 26 | 0,99681 | 45 | 0,99025 | 80 | 0,97183 | |
4 | 1,00000 | 20 | 0,99823 | 27 | 0,99654 | 50 | 0,98807 | 85 | 0,96865 |
5 | 0,99999 | 21 | 0,99802 | 28 | 0,99626 | 55 | 0,98573 | 90 | 0,96534 |
10 | 0,99973 | 22 | 0,99780 | 29 | 0,99597 | 60 | 0,98324 | 95 | 0,96192 |
15 | 0,99913 | 23 | 0,99756 | 30 | 0,99567 | 65 | 0,98059 | 100 | 0,95838 |
16 | 0,99897 |
* Источник: Краткий справочник физико-химических величин. Издание десятое, испр. и дополн. / Под ред. А.А. Равделя и А.М. Пономаревой – СПб.: «Иван Федоров», 2003 г. С. 15
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 августа 2018;
проверки требуют 15 правок.
Бу́ферные систе́мы кро́ви (от англ. buffer, buff — «смягчать удар») — физиологические системы и механизмы, обеспечивающие заданные параметры кислотно-основного равновесия в крови[1]. Они являются «первой линией защиты», препятствующей резким перепадам pH внутренней среды живых организмов.
Циркулирующая кровь представляет собой взвесь живых клеток в жидкой среде, химические свойства которой очень важны для их жизнедеятельности. У человека за норму принят диапазон колебаний pH крови 7,37—7,44 со средней величиной 7,4. Буферные системы крови слагаются из буферных систем плазмы и клеток крови и представлены следующими системами[1][2]:
- бикарбона́тная (водородкарбонатная) бу́ферная систе́ма;
- фосфа́тная бу́ферная систе́ма;
- белко́вая бу́ферная систе́ма;
- гемоглоби́новая бу́ферная система;
- эритроциты.
Помимо этих систем также активно участвуют дыхательная и мочевыделительная системы[1].
Бикарбонатная буферная система[править | править код]
Одна из самых мощных и вместе с тем самая управляемая система[2] внеклеточной жидкости и крови, на долю которой приходится около 53 % всей буферной ёмкости крови. Представляет собой сопряжённую кислотно-основную пару, состоящую из молекулы угольной кислоты H2CO3, являющейся источником протона, и бикарбонат-аниона HCO3−, выполняющего функцию акцептора протона:
Вследствие того, что концентрация гидрокарбоната натрия в крови значительно превышает концентрацию H2CO3, буферная ёмкость этой системы будет значительно выше по кислоте. Иначе говоря, гидрокарбонатная буферная система особенно эффективно компенсирует действие веществ, увеличивающих кислотность крови. К числу таких веществ прежде всего относят молочную кислоту, избыток которой образуется в результате интенсивной физической нагрузки. Гидрокарбонатная система наиболее «быстро» отзывается на изменение pH крови[2].
Фосфатная буферная система[править | править код]
В крови ёмкость фосфатной буферной системы невелика (составляет около 2 % общей буферной ёмкости), в связи с низким содержанием фосфатов в крови. Фосфатный буфер выполняет значительную функцию в поддержании физиологических значений рН во внутриклеточных жидкостях и моче.
Буфер образован неорганическими фосфатами. Функцию кислоты в этой системе выполняет однозамещённый фосфат (NaH2PО4), а функцию сопряженного основания — двузамещённый фосфат (Na2HPО4). При рН 7,4 соотношение [НРО42-/Н2РО4-] равняется поскольку при температуре 25+273,15K pKa, ортоII=7,21[3], при этом средний заряд аниона ортофосфорной кислоты < q >=((-2)*3+(-1)*2)/5=-1,4 единиц заряда позитрона.
Буферные свойства системы при увеличении в крови содержания водородных ионов реализуются за счет их связывания с ионами НРО42- с образованием Н2РО4-:
а при избытке ионов ОН- — за счет связывания их с ионами Н2РО4-:
Фосфатная буферная система крови тесно взаимосвязана с бикарбонатной буферной системой.
Белковая буферная система[править | править код]
В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия (7—10 % буферной ёмкости).
Белки́ плазмы крови благодаря наличию кислотно-основных групп в молекулах белков (белок—H+ — кислота, источник протонов и белок− — сопряжённое основание, акцептор протонов) образуют буферную систему, наиболее эффективную в диапазоне pH 7,2—7,4[1].
Основную часть белков плазмы крови (около 90 %) составляют альбумины и глобулины. Изоэлектрические точки этих белков (число катионных и анионных групп одинаково, заряд молекулы белка равен нулю) лежат в слабокислой среде при pH 4,9—6,3, поэтому в физиологических условиях при pH 7,4 белки находятся преимущественно в формах «белок-основание» и «белок-соль».
Буферная ёмкость, определяемая белками плазмы, зависит от концентрации белков, их вторичной и третичной структуры и числа свободных протон-акцепторных групп. Эта система может нейтрализовать как кислые, так и основные продукты. Однако вследствие преобладания формы «белок-основание» её буферная ёмкость значительно выше по кислоте.
Буферная ёмкость свободных аминокислот плазмы крови незначительна как по кислоте, так и по щелочи. При физиологическом значении pH их мощность мала. Практически только одна аминокислота — гистидин — обладает значительным буферным действием при значении pH, близком к плазме крови.[2]
Эритроциты[править | править код]
Во внутренней среде эритроцитов в норме поддерживается постоянное значение pH, равное 7,30. Здесь также действуют гидрокарбонатная и фосфатная буферные системы. Однако их мощность отличается от таковой в плазме крови. Кроме того, в эритроцитах белковая система гемоглобин-оксигемоглобин играет важную роль как в процессе дыхания (транспортная функция по переносу кислорода к тканям и органам и удалению из них метаболической CO2), так и в поддержании постоянства pH внутри эритроцитов, а в результате и в крови в целом. Эта буферная система в эритроцитах тесно связана с гидрокарбонатной системой.[2]
Гемоглобиновая буферная система[править | править код]
Буферная система крови (75 % буферной ёмкости). Играет важную роль как в процессе дыхания (транспортная функция по переносу кислорода к тканям и органам и удалению из них метаболической CO2), так и в поддержании постоянства pH внутри эритроцитов, а в результате и в крови в целом.[2]
См. также[править | править код]
- Буферный раствор
Примечания[править | править код]
- ↑ 1 2 3 4 Березов Т. Т., Коровкин Б. Ф. Биологическая химия: Учебник — 1990 г. — стр. 452—455.
- ↑ 1 2 3 4 5 6 Ершов. Общая химия.Биофизическая химия.Химия биогенных элементов. — Издание восьмое, стериотипное. — Москва: Высшая школа, 2010. — 559 с. — ISBN 978-5-06-006180-2.
- ↑ И.Т.Гороновский, Ю.П.Назаренко, Е.Ф.Некряч. Краткий справочник по химии. — Пятое издание, исправленное и дополненное. — Киев: Наукова Думка, 1987. — С. 348. — 828 с.
Литература[править | править код]
- Березов Т. Т., Коровкин Б. Ф. [www.xumuk.ru/biologhim/ Биологическая химия: Учебник] / Под. ред. акад. АМН СССР С. С. Дебова.— 2-е изд., перераб. и доп.— М.: Медицина,— 1990.— 528 с., С. 452—455. ISBN 5-225-01515-8.
- Ершов. Общая химия.Биофизическая химия.Химия биогенных элементов. — Издание восьмое,стереотипное. — Москва: Высшая школа, 2010. — 559 с. — ISBN 978-5-06-006180-2.
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). |
Источник
БУФЕРНЫЕ СВОЙСТВА, способность многих веществ ослаблять изменение активной реакции раствора, которое без них произошло бы при прибавлении к раствору кислот или щелочей. Это стабилизирующее влияние на реакцию раствора называется буферным действием.
Буферное действие
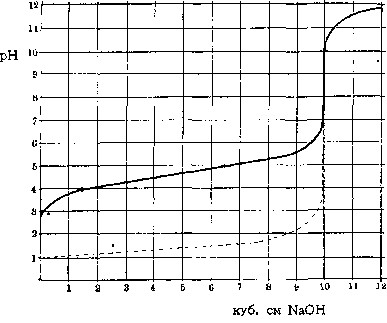
Если к десяти кубических см децинормального раствора уксусной кислоты постепенно добавлять раствор едкого натра такой же концентрации, то кислотность раствора, определяемая концентрацией содержащихся в нем свободных водородных ионов, будет уменьшаться. При прибавлении 10 кубических см NaOH процесс связывания кислоты щелочью, процесс нейтрализации, окажется законченным, вся уксусная кислота превратится в соответствующую соль – уксуснокислый натрий, а соединившиеся Н и ОН-ионы дадут молекулы воды. Дальнейшее добавление NaOH даст преобладание свободным гидроксильным ионам – щелочную реакцию. Помещаемая здесь кривая (смотрите рисунок 1, сплошная линия) передает изменения реакции, выраженной через рН (водородный показатель, – смотрите Водородные ионы), наблюдаемые при нейтрализации уксусной кислоты.

Рисунок 1. Изменение реакции (буферные свойства в действии)
Прерывистая линия на том же рисунке изображает соответствующее изменение реакции (рН) при прибавлении NaOH к децинормальной соляной кислоте. Если сравнить обе кривые и посмотреть, сколько потребовалось щелочи для одинакового изменения реакции, напр., для изменения рН от 4 до 5, то результаты окажутся весьма различными: в первом случае – около 5 кубических см NaOH, во втором – едва уловимые следы последнего. Количество щелочи (или соответственно кислоты), которое требуется для определенного изменения реакции, и является мерилом устойчивости реакции раствора, величины его буферного действия. В первом случае оно весьма значительно, во втором – совершенно ничтожно. Если количество грамм-эквивалентов щелочи (или, соответственно, кислоты), прибавленной к литру испытуемого раствора, обозначить знаком ДВ, а вызванное этим изменение реакции через ДрН, то, по Ван-Слайку (Van-Slyke), буферное действие будет равно отношению этих величин: Буферное действие = отношение ДВ к ДрН. Различие в хорде кривых для обоих рассмотренных выше растворов обусловлено свойствами обеих кислот. Соляная кислота принадлежит к сильным кислотам, полностью диссоциированным на свои ионы. Напротив, уксусная кислота сравнительно слабо диссоциирована: только небольшая часть ее молекул (в децинормальном растворе около 1,3%) распадается и дает водородные ионы, определяющие кислую реакцию раствора. Поэтому, уксусная кислота имеет значительно менее кислую реакцию (больший рН), чем соляная в одинаковой молекулярной концентрации. При прибавлении NaOH гидроксильные ионы щелочи связывают водородные ионы. Но в силу общих условий химическом равновесия удаление продуктов диссоциации вызывает распад новых, прежде недиссоциированных молекул, освобождая все новые количества Н-ионов на место связываемых щелочью. Таким образом, уксусная кислота (в отличие от полностью диссоциированной соляной), кроме свободных, активных Н-ионов, обусловливающих активную реакцию раствора, обладает еще в своих недиссоциированных молекулах запасными, резервными водородными ионами, резервной кислотностью, способной быстро пополнять убыль свободных ионов. Эти кислотные резервы (или щелочные, если раствор может освобождать запасные ОН-ионы и связывать прибавляемые кислоты) и обусловливают его буферное действие; оно тем значительнее, чем больше резервных ионов мобилизуется при данном изменении реакции. Самое название (буферное действие) было дано по аналогии с железнодорожными буферами, смягчающими резкость механических толчков. Более правильным было бы сравнение с сосудами различной емкости, в которых прибавление одинакового количества жидкости вызывает различное изменение уровня. Чем значительнее емкость сосуда, тем больше требуется жидкости для определенного повышения уровня; подобным же образом от количества резервных Н – или О Н-ионов («буферной емкости») зависит количество щелочи (или кислоты), необходимое для данного изменения «уровня» реакции.
Буферные растворы
Электролитическая диссоциация слабых кислот и щелочей резко понижается в присутствии солей, имеющих общий с ними ион. Напр., уксусная кислота значительно слабее диссоциирована в присутствии своей натриевой соли (уксуснокислого натрия, дающего, подобно уксусной кислоте, ацетат-ион) и дает значительно меньше водородных ионов, чем в чистом растворе. Концентрация водородных ионов прямо пропорциональна концентрации молекул уксусной кислоты и обратно пропорциональна концентрации ацетат-ионов. Так как нейтральные соли принадлежат к сильным электролитам, почти полностью диссоциированным на свои ионы, можно с достаточным приближением, вместо концентрации ацетат-ионов, взять просто концентрацию соответствующей соли. Концентрация водородных ионов в таком растворе, содержащем слабую кислоту и ее соль, выразится тогда простой формулой (в которой прямоугольные скобки обозначают концентрацию стоящих в них веществ): [Н’]=К [кислота] / [соль] (1).
Подобным же образом в смеси слабой щелочи и ее соли концентрация гидроксильных ионов (по которой точно так же легко вычислить тесно связанную с ней концентрацию Н-ионов и реакцию раствора) определяется аналогичным выражением: [Н’]=К [щелочь] / [соль] (2).
Для более точного расчета необходимо было бы в обеих формулах несколько уменьшить знаменатель, умножив его на степень диссоциации соли (величину меньшую единицы). Такие смеси имеют особенно большие количества резервных, легко мобилизуемых Н- и ОН-ионов и соответственно особенно большое буферное действие. При этом они делают реакцию раствора устойчивой одновременно по отношению и к щелочам и к кислотам. Так, напрример, смесь уксусной кислоты с уксуснокислым натрием (получающаяся при частичной нейтрализации уксусной кислоты едким натром, смотрите рисунок), как мы видели, сравнительно мало изменяет свою реакцию при подщелачивании. Точно так же при прибавлении сильной кислоты, напр., соляной, действие ее ослабляется благодаря тому, что она соединяется с натрием, вытесняя эквивалентное количество слабой уксусной кислоты из ее соли. Растворы подобных смесей слабой кислоты или щелочи с соответствующей солью, так называемые буферные растворы, приобрели особенное значение благодаря той легкости, с которой по приведенным формулам (1) и (2) может быть вычислена их реакция. Постоянная К в этих формулах представляет характерную для каждой кислоты или щелочи константу – т. н. константу диссоциации. Если кислота и ее соль присутствуют в равной (эквивалентной) концентрации, то, очевидно, концентрация водородных ионов делается численно равной константе диссоциации ([Н’]=К). Таким образом, константа диссоциации кислоты (или, соответственно, щелочи) непосредственно указывает среднюю реакцию, в районе которой проявляется буферное действие данной смеси. В этой точке буферное действие более чем особенно велико. В следующей таблице приведен водородный показатель нескольких буферных растворов: смеси уксусной кислоты и уксуснокислого натрия (ацетатная смесь), однометаллического (первичного) и двуметаллического (вторичного) фосфата натрия (NaH2PO4 и Na2HPO4) и аммиака с хлористым аммонием.
Таблица рН буферных смесей.
Уксусная кислота
Молярное соотношение
Уксусно- кисл. Na
32:1 3,2 16:1 3,5 8:1 3,8 4:1 4,1 2:1 4,4 1:1 4,7 1:2 5,0 1:4 5,3 1:8 5,6 1:16 5,9 1:32 6,2 Первичный фосфат
Вторичный фосфат
Хлор. аммоний
Аммиан
1 4 7 0 3 7 3,3 8,0 8,3 8,6 8,9 9,2 9,5 9,8 10,1 10,4 10,7 11,0
Из формул (1) и (2) можно непосредственно вывести одно очень важное свойство буферных растворов: реакция, даваемая буферной смесью, зависит (в первом приближении) исключительно от соотношения и её компонентов, а не от их абсолютной концентрации. Поэтому и в приведенной таблице можно было, не приводя концентрации кислоты (или щелочи) и соли, ограничиться указанием их соотношения. Разбавление буферного раствора не влияет на его реакцию. Конечно, того же нельзя сказать о буферном действии. При данной реакции оно тем значительнее, чем выше концентрация буферов. Рассмотренные свойства буферных растворов определяют их важнейшие практические применения:
- Очень многие биохимические и биологические процессы в высокой степени чувствительны даже к незначительным изменениям реакции (смотрите Активная реакция и Водородные ионы). В самом ходе этих процессов часто вырабатываются большие количества кислых или щелочных продуктов, которые могли бы изменить или даже совершенно остановить их дальнейшее течение. Для точного изучения подобных процессов необходимо их проводить в условиях, исключающих возможность сколько-нибудь значительных колебаний реакции. Для этого служат буферные растворы, применяемые здесь как регуляторы реакции. Этот метод был применен Серенсеном (Sorensen, 1909 г.) для изучения влияния активной реакции на деятельность ферментов. В зависимости от количества вырабатываемых кислых или щелочных продуктов, с одной стороны, от желательной степени постоянства реакции – с другой, приходится применять растворы с более или менее значительным буферным действием.
- В других случаях величина буферного действия не имеет особенно существенного значения, а применение буферных растворов основано на даваемой ими возможности готовить стойкие растворы любой желательной реакции (смотрите таблицу). При помощи индикаторов – веществ, меняющих свою окраску в зависимости от активной реакции раствора, можно сравнивать исследуемый раствор с серией буферных растворов известной реакции. Устанавливая, в каком из этих растворов данный индикатор принимает такую же окраску, как и в испытуемом, можно определить реакцию последнего. Таким образом, буферы применяются здесь как стандартные растворы, путем сравнения с которыми измеряется реакция. Применение таких стандартных буферных растворов лежит в основе индикаторного, или колориметрического метода измерения реакции. Другие буферные системы. Другие хим. системы также могут оказывать более или менее значительное буферное действие. Оно может зависеть, например, от выпадения в осадок прибавляемой щелочи или кислоты. Так, если к морской воде прибавлять едкий натр, раствор будет подщелачиваться до тех пор, пока его рН не сделается равным, приблизительно 8,6. При этой реакции начнет осаждаться Mg(OH)2, образующийся из магниевых солей и прибавляемого NaOH; дальнейшее увеличение щелочности приостановится, пока весь магний не выпадет из раствора. Далее, даже нерастворимые вещества (например, животный уголь) могут захватывать прибавляемые кислоты или щелочи путем адсорпции. Наконец, очень сильным буферное действием отличаются белки и другие амфотерные вещества (смотрите Амфолиты). Благодаря своей двойственной («амфотерной») природе, они могут связывать как кислоты, так и щелочи. Амфотерный характер клеточных коллоидов имеет большое значение для постоянства внутриклеточной реакции.
Буферы морской воды
Изменения реакции оказывают огромное влияние на жизненные явления; жизнь возможна лишь в определенном, для большинства организмов сравнительно узком, интервале концентраций Н- и ОН-ионов. Поэтому в природе буферы играют большую роль в поддержании необходимого для жизни постоянства реакции. Морская вода, представляющая естественную внешнюю среду большинства водных организмов, обладает весьма значительным буферное действием, которое зависит от содержащейся в ней бикарбонатной смеси – сочетания углекислоты и двууглекислого натрия (бикарбоната натрия). Благодаря наличию этого буфера, сохраняется обычная слабощелочная реакция морской воды и умеряются колебания реакции, которые производят водные организмы, поглощающие при фотосинтезе CO2 или выделяющие кислые продукты обмена веществ.
Буферные свойства крови
Особенный интерес представляют буферные свойства внутренней среды организма, в частности, крови. Кровь имеет слабощелочную реакцию, отличающуюся большим постоянством. Даже in vitro кровь стойко удерживает свою реакцию и обладает весьма большим буферным действием. К ней приходится прибавлять в несколько десятков раз больше едкого натра, чем к дистиллированной воде, чтобы вызвать одинаковое подщелачивание раствора, и в несколько сот раз больше НС1 для одинакового подкисления. Так же, как и в морской воде, главным буфером кровяной сыворотки является бикарбонатная смесь – сочетание CO2 и NaHCO3. Даваемая ею концентрация Н-ионов приближенно определяется так: [Н’]=К [СO2] / [NaHCO3] (3), где К равняется, приблизительно, 3 * 10-7. В сыворотке содержатся также фосфаты, однако, по сравнению с бикарбонатами, их количество и их роль невелики. В отношении буферного действия бикарбонатный раствор вполне сходен с кровяной сывороткой.
Так, например, обе жидкости растворяют одинаковое количество CO2, пропорциональное ее парциальному давлению в окружающем воздухе. При изменении этого давления, как показывает формула (3), во столько же раз изменяется в них концентрация водородных ионов. Цельная кровь со своими форменными элементами обнаруживает при тех же условиях заметно большее постоянство реакции. Это добавочное, по сравнению с сывороткой, Буферное действие зависит от амфотерных белковых веществ крови, в частности – от находящегося в эритроцитах НЬ. Последний представляет очень слабую кислоту, настолько слабую, что его кислый характер не может проявиться при избытке CO2. Но, когда давление последней понижено, например, в артериальной крови, оксигемоглобин, как кислота, разлагает некоторое количество бикарбоната, вытесняя из него CO2. В результате уменьшается знаменатель в формуле (3) и отчасти компенсируется влияние пониженного содержания CO2.
Таким образом, НЬ оказывает существенное влияние на кривую связывания углекислоты, а тем самым и на реакцию крови. В частности, он умеряет различия, связанные с различным давлением CO2 в артериальной и в венозной крови. Во всяком случае, в конечном итоге реакция крови вполне определяется соотношением углекислоты и бикарбоната, т. е. отношением свободной (растворенной) CO2 и CO2 химически связанной. Первая легко выделяется из крови, вторая может быть вытеснена путем разложения бикарбонатов кислотами. Обе эти величины – количество свободной и связанной CO2 – совместно характеризуют буферные свойства и реакцию крови. Их измерение получило в последнее время большое распространение и значение.
В отношении своей реакции кровь обладает теми же свойствами, что и другие буферные растворы. Мы видели, что реакция буферной смеси определяется соотношением кислоты и ее соли, а не их абсолютной концентрацией. Соответственно этому и реакция крови остается практически неизменной даже при многократном разбавлении ее изотоническим раствором NaCl (или любым другим безбуферным раствором). Этим свойством крови нередко пользуются при измерении ее реакции, применяя с этой целью небольшое количество крови, разбавленной раствором NaCl. Оно же делает безвредным внутривенное вливание различных так наз. «физиологических растворов», нередко имеющих ненормальную реакцию, которая оказалась бы гибельной для организма, если бы уже небольшая примесь крови не приближала ее к физиологической норме. При прибавлении к крови in vitro щелочи эта последняя нейтрализуется углекислотой; напротив, всякая кислота реагирует с бикарбонатом и, образуя нейтральную соль, заменяется эквивалентным количеством вытесненной ею из бикарбоната CO2. Этим объясняется замечательный факт, не раз уже обращавший на себя внимание исследователей: путем введения в кровь (in vivo) различных кислот – от наиболее слабых до самых сильных – оказывается совершенно невозможным добиться различного (соответственно силе применяемой кислоты) изменения реакции крови.
Пока в крови остается некоторое количество бикарбонатного буфера, изменения реакции оказываются во всех случаях одинаково ничтожными. Затем, одновременно с резким нарушением реакции, наступает смерть. Эти грубые экспериментальные воздействия дают наглядное представление о том, что происходит в организме в естественных условиях. Огромное большинство продуктов обмена веществ имеет кислый характер (фосфорная, угольная, молочная, масляная и другие кислоты). От этих непрерывно поступающих из тканей кислот и должны буферы крови предохранить ее нормальную реакцию. Последняя является слабощелочной, то есть характеризуется небольшим избытком активных гидроксил-ионов. Водородный показатель (рН) крови равняется, в среднем, 7,4, концентрация Н-ионов – 0,44 * 10-7, концентрация ОН-ионов – около 7 * 10-7 (при 37°). По сравнению с этой незначительной концентрацией свободных ОН-ионов количество резервных ионов, которое может быть освобождено для связывания прибавляемых кислот, весьма велико (около 2 * 10-2). Их количество, однако, далеко не отличается таким постоянством, как активная реакция крови, и может подвергаться сильным изменениям, особенно в патологических условиях.
Щелочные растворы представляют лишь первый барьер против вводимых извне или вырабатываемых в организме кислых продуктов. Производимое последними нарушение реакции во много раз ослабляется буферами крови, но не может быть ими совершенно устранено: связывание части молекул бикарбоната и освобождение CO2 смещает первоначальное соотношение этой основной буферные смеси. Более тонкая регуляция реакции совершается легкими. Всякое увеличение концентрации водородных ионов служит возбудителем дыхательного центра и немедленно усиливает вентиляц?
