Какими свойствами обладают аминокислоты напишите уравнения реакций

Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
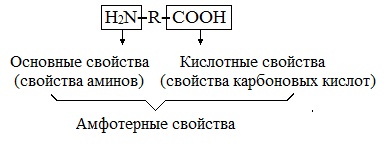
Кислотно-основное равновесие в водных растворах
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
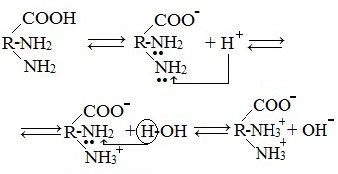
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
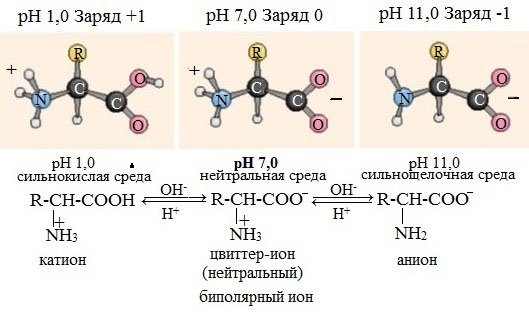
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
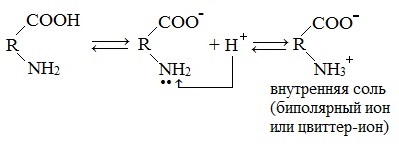
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
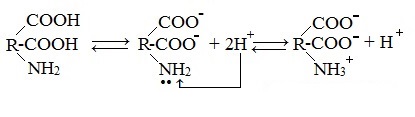
Водные растворы моноаминодикарбоновых кислот имеют рН<7 (кислая среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток ионов водорода Н+.
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН— .
2. Взаимодействие с основаниями и кислотами
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
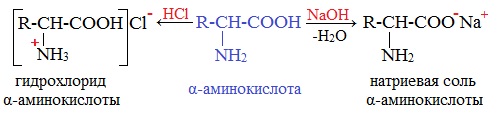
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
Образуются соли:
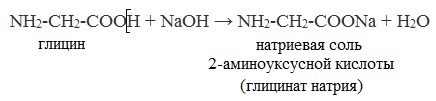
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Образуются амиды:
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
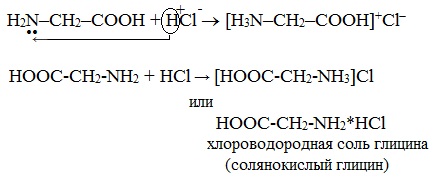
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.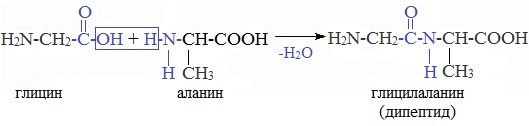
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Аминокислоты
Источник
Среди
азотсодержащих органических веществ имеются соединения с двойственной функцией.
Особенно важными из них являются аминокислоты.
В клетках и тканях живых организмов
встречается около 300 различных аминокислот, но только 20 (α-аминокислоты) из них служат звеньями (мономерами), из которых построены пептиды и
белки всех организмов (поэтому их называют белковыми аминокислотами).
Последовательность расположения этих аминокислот в белках закодирована в
последовательности нуклеотидов соответствующих генов. Остальные аминокислоты
встречаются как в виде свободных молекул, так и в связанном виде. Многие из
аминокислот встречаются лишь в определенных организмах, а есть и такие, которые
обнаруживаются только в одном из великого множества описанных организмов.
Большинство микроорганизмов и растения синтезируют необходимые им аминокислоты;
животные и человек не способны к образованию так называемых незаменимых
аминокислот, получаемых с пищей. Аминокислоты участвуют в обмене белков и
углеводов, в образовании важных для организмов соединений (например, пуриновых
и пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот),
входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов,
антибиотиков и т. д.; некоторые аминокислоты служат посредниками при передаче
нервных импульсов.
Аминокислоты — органические амфотерные соединения, в состав
которых входят карбоксильные группы – СООН и аминогруппы -NH2.
Аминокислоты можно рассматривать как
карбоновые кислоты, в молекулах которых атом водорода в радикале замещен
аминогруппой.
КЛАССИФИКАЦИЯ

Аминокислоты классифицируют по структурным признакам.
1.
В
зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты
подразделяют на α-, β-, γ-, δ-, ε- и
т. д.
2.
В
зависимости от количества функциональных групп различают кислые, нейтральные и
основные.
3.
По
характеру углеводородного радикала различают алифатические (жирные), ароматические,
серосодержащие и гетероциклические
аминокислоты. Приведенные выше аминокислоты относятся к жирному ряду.
Примером
ароматической аминокислоты может служить пара-аминобензойная
кислота:
Примером
гетероциклической аминокислоты может служить триптофан – незаменимая α- аминокислота
НОМЕНКЛАТУРА
По систематической номенклатуре названия
аминокислот образуются из названий соответствующих кислот прибавлением
приставки амино- и указанием места расположения аминогруппы по отношению
к карбоксильной группе. Нумерация углеродной цепи с атома углерода карбоксильной группы.
Например:
Часто используется также другой способ
построения названий аминокислот, согласно которому к тривиальному названию
карбоновой кислоты добавляется приставка амино- с указанием положения
аминогруппы буквой греческого алфавита.
Пример:
Для α-аминокислот R-CH(NH2)COOH

, которые играют исключительно важную
роль в процессах жизнедеятельности животных и растений, применяются тривиальные
названия.
Таблица. Некоторые важнейшие α-аминокислоты
Аминокислота | Сокращённое обозначение | Строение радикала ( R ) |
Глицин | Gly (Гли) | H – |
Аланин | Ala (Ала) | CH3 – |
Валин | Val (Вал) | (CH3)2CH – |
Лейцин | Leu (Лей) | (CH3)2CH – CH2 – |
Серин | Ser (Сер) | OH- CH2 – |
Тирозин | Tyr (Тир) | HO – C6H4 – CH2 – |
Аспарагиновая кислота | Asp (Асп) | HOOC – CH2 – |
Глутаминовая кислота | Glu (Глу) | HOOC – CH2 – CH2 – |
Цистеин | Cys (Цис) | HS – CH2 – |
Аспарагин | Asn (Асн) | O = C – CH2 – │ NH2 |
Лизин | Lys (Лиз) | NH2 – CH2- CH2 – CH2 – |
Фенилаланин | Phen (Фен) | C6H5 – CH2 – |
Если
в молекуле аминокислоты содержится две аминогруппы, то в ее названии
используется приставка диамино-, три группы NH2 – триамино-
и т.д.
Пример:
Наличие
двух или трех карбоксильных групп отражается в названии суффиксом –диовая
или -триовая кислота:
ИЗОМЕРИЯ
1. Изомерия углеродного скелета
2. Изомерия положения функциональных
групп
3. Оптическая изомерия
α-аминокислоты, кроме глицина NН2-CH2-COOH.
ФИЗИЧЕСКИЕ СВОЙСТВА
Аминокислоты представляют собой
кристаллические вещества с высокими (выше 250°С) температурами плавления,
которые мало отличаются у индивидуальных аминокислот и поэтому нехарактерны.
Плавление сопровождается разложением вещества. Аминокислоты хорошо растворимы в
воде и нерастворимы в органических растворителях, чем они похожи на
неорганические соединения. Многие аминокислоты обладают сладким вкусом.
ПОЛУЧЕНИЕ
3. Микробиологический синтез. Известны микроорганизмы, которые
в процессе жизнедеятельности продуцируют α – аминокислоты белков.
ХИМИЧЕСКИЕ СВОЙСТВА
Аминокислоты
амфотерные органические соединения, для них характерны кислотно-основные
свойства.
I.Общие свойства
1. Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные
растворы электропроводны. Эти свойства объясняются тем, что молекулы
аминокислот существуют в виде внутренних солей, которые образуются за счет
переноса протона от карбоксила к аминогруппе:
цвиттер-ион
Водные растворы аминокислот имеют нейтральную, кислую
или щелочную среду в зависимости от количества функциональных групп.
Видео-опыт «Свойства аминоуксусной кислоты»
2. Поликонденсация→ образуются полипептиды (белки):
При взаимодействии двух
α-аминокислот образуется дипептид.
3. Разложение → Амин +
Углекислый газ:
NH2-CH2-COOH → NH2-CH3 + CO2↑
II. Свойства карбоксильной группы
(кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH
+ NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa – натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные
эфиры – летучие вещества (р.
этерификации): NH2-CH2-COOH
+ CH3OH HCl(газ)→ NH2-CH2-COOCH3
+ H2O
NH2-CH2-COOCH3 – метиловый эфир 2- аминоуксусной кислоты
3. С аммиаком → образуются
амиды:
NH2-CH(R)-COOH + H-NH2 →
NH2-CH(R)-CONH2 + H2O
4. Практическое значение имеет
внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой
кислоты, в результате которого образуется ε-капролактам (полупродукт для
получения капрона):
III. Свойства аминогруппы (основность)
1. С сильными кислотами → соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl
или HOOC-CH2-NH2*HCl
2. С азотистой кислотой (подобно
первичным аминам):
NH2-CH(R)-COOH +
HNO2 → HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота
Измерение
объёма выделившегося азота позволяет определить количество аминокислоты (метод
Ван-Слайка)
IV.Качественная реакция
1. Все аминокислоты окисляются
нингидрином с образованием продуктов сине-фиолетового цвета!
2. С ионами тяжелых металлов α-аминокислоты
образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую
синюю окраску, используются для обнаружения α-аминокислот.
Видео-опыт “Образование медной соли аминоуксусной кислоты”.
Генетическая связь аминокислот с другими классами органических соединений
ПРИМЕНЕНИЕ
1) аминокислоты широко
распространены в природе;
2) молекулы аминокислот – это те
кирпичики, из которых построены все растительные и животные белки;
аминокислоты, необходимые для построения белков организма, человек и животные
получают в составе белков пищи;
3) аминокислоты прописываются при
сильном истощении, после тяжелых операций;
4) их используют для питания
больных;
5) аминокислоты необходимы в
качестве лечебного средства при некоторых болезнях (например, глутаминовая
кислота используется при нервных заболеваниях, гистидин – при язве желудка);
6) некоторые аминокислоты
применяются в сельском хозяйстве для подкормки животных, что положительно
влияет на их рост;
7) имеют техническое значение:
аминокапроновая и аминоэнантовая кислоты образуют синтетические волокна –
капрон и энант.
О РОЛИ АМИНОКИСЛОТ
Нахождение в природе и биологическая роль аминокислот
Источник
Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы –NH2.
Природные аминокислоты можно разделить на следующие основные группы:
| 1) Алифатические предельные аминокислоты (глицин, аланин) | NH2-CH2-COOH глицин NH2-CH(CH3)-COOH аланин |
| 2) Серосодержащие аминокислоты (цистеин) | цистеин |
| 3) Аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2OH)-COOH серин |
| 4) Ароматические аминокислоты (фенилаланин, тирозин) | фенилаланин
тирозин |
| 5) Аминокислоты с двумя карбоксильными группами (глутаминовая кислота) | HOOC-CH(NH2)-CH2-CH2-COOH глутаминовая кислота |
| 6) Аминокислоты с двумя аминогруппами (лизин) | CH2(NH2)-CH2-CH2-CH2-CH(NH2)-COOH лизин |
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
- Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):

При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
1. Кислотно-основные свойства аминокислот
Аминокислоты — это амфотерные соединения.
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп.
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:
1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с основаниями:
2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
Например, глицин взаимодействует с азотистой кислотой:
3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
Например, глицин взаимодействует с этиловым спиртом:
5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
Например, глицин взаимодействует с гидроксидом бария при нагревании:
Например, глицин разлагается при нагревании:
6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Например, глицин реагирует с аланином с образованием дипептида (глицилаланин):

Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Источник
Амины – органические производные аммиака, в молекулах которого один, два или все три атома водорода замещены органическими радикалами.
По числу радикалов амины делятся на первичные, вторичные и третичные.
По типу простейших радикалов амины делятся на предельные, непредельные и ароматические:
| Предельный амин: | Непредельный амин: | Ароматический амин: |
| CH3—CH2—NH2 этиламин (аминоэтан) | CH2=CH—CH2—NH2 аллиламин (3-аминопропен-1) | C6H5—NH2 фениламин (анилин) |
Изомеры и гомологи
| г о м о л о г и | CH3—NH2 аминометан (этиламин) | ||||
| CH3—CH2—NH2 аминоэтан (этиламин) | CH3—NH—CH3 диметиламин | ||||
| CH3—CH2—CH2—NH2 1-аминопропан (пропиламин) | 2-аминопропан | CH3—NH—CH2—CH3 метилэтиламин | триметиламин | ||
| CH3—CH2—CH2—CH2—NH2 1-аминобутан (бутиламин) | 2-аминобутан | 2-амино-2-метилпропан | CH3—NH—CH2CH2CH3 метилпропиламин | диметилэтиламин | |
| и з о м е р ы | |||||
У атома азота в молекулах аминов есть неподеленная пара электронов, которая может участвовать в образовании связи по донорно-акцепторному механизму. В ряду
анилин аммиак первичный амин вторичный амин третичный амин
электронная плотность на атоме азота возрастает.
Из-за наличия в молекулах неподеленной пары электронов амины, как и аммиак, проявляют основные свойства. В ряду
анилин аммиак первичный амин вторичный амин
основные свойства усиливаются, из-за влияния типа и числа радикалов.
Физические свойства. Простейшие амины – газы с запахом аммиака, более сложные – жидкости с запахом рыбы, высшие – твердые нерастворимые в воде вещества. Температуры кипения и растворимость в воде у аминов меньше, чем у соответствующих спиртов.
Химические свойства
- Горение:
4CH3NH2 + 9O2 4CO2 + 10H2O +2N2
4C6H5NH2 + 31O2 24CO2 + 14H2O + 2N2
- Взаимодействие с водой:
CH3NH2 + H2O CH3NH3+ + OH-
Анилин с водой практически не реагирует.
- Взаимодействие с кислотами (основные свойства):
2CH3NH2 + H2SO4 (CH3NH3)2SO4 сульфат метиламмония C6H5NH2 + HCl (C6H5NH3)Cl хлорид фениламмония - Реакции замещения в ароматических аминах (реакция анилина с бромной водой или с азотной кислотой):
В этих реакциях (бромирование и нитрование) преимущественно образуются орто– и пара-производные.
Получение анилина: C6H5NO2 + 6[H] C6H5NH2 + 2H2O.
В промышленности эта реакция протекает при нагревании нитробензола с водяным паром в присутствии железа. В лаборатории водород “в момент выделения” образуется по реакции цинка со щелочью или железа с соляной кислотой. В последнем случае образуется хлорид анилиния.
Аминокислоты – органические вещества, в молекулах которых содержатся две функциональные группы: аминогруппа и карбоксильная группа.
Общая формула молекул аминокислот – NH2—R—COOH, где R – двухвалентный радикал. В твердом состоянии и частично в растворах аминокислоты представляют собой “внутренние соли”, то есть состоят из биполярных ионов +NH3—R—COO-, образующихся при обратимом переносе протона (H+) от карбоксильной группы к аминогруппе, например:
Общая формула предельных аминокислот с одной карбоксильной и одной аминогруппой – CnH2n+1NO2.
Изомеры и гомологи
Межклассовыми изомерами для аминокислот являются нитросоединения R—NO2.
| г о м о л о г и | NH2—CH2—COOH аминоэтановая кислота (глицин) | CH3CH2NO2 нитроэтан | ||
| 2-аминопропановая кислота -аминопропановая кислота (аланин) | NH2—CH2CH2—COOH 3-аминопропановая кислота -аминопропановая кислота | CH3CH2CH2—NO2 1-нитропропан | ||
| 2-аминобутановая кислота -аминобутановая кислота 2-аминомасляная кислота | 3-аминобутановая кислота -аминобутановая кислота | 2-амино-2-метилпропановая кислота | CH3CH2CH2CH2—NO2 1-нитробутан | |
| и з о м е р ы | ||||
Физические свойства: бесцветные кристаллические вещества с температурами плавления 150 – 250oС, хорошо растворимы в воде (лучше, чем в органических растворителях), многие – сладкие.
Химические свойства
- Горение:
4NH2CH2COOH + 13O2 8CO2 + 10H2O + 2N2
- Взаимодействие с водой:
Аминокислоты – амфотерные органические вещества. В водных растворах большинства аминокислот среда слабокислотная. - Реакции с растворами щелочей:
NH2CH2COOH + NaOH NH2CH2COO—Na+ + H2O (NH2CH2COONa -аминоацетат натрия)
- Реакции с растворами кислот:
2NH2CH2COOH + H2SO4 (NH3CH2COOH)2SO4 (сульфат глициния)
- Этерификация:
NH2CH2COOH + C2H5OH NH2CH2COOC2H5 + H2O (упрощенное уравнение реакции) - Конденсация:
а) димеризацияNH2—(CH2)5—COOH + H—NH—(CH2)5—COOH H2N—(CH2)5—CO—NH—(CH2)5—COOH + H2O аминокапроновая (6-аминогексановая) кислота димер б) поликонденсация
nNH2—(CH2)5—COOH [—NH—(CH2)5—COO—]n + (n – 1)H2O аминокапроновая кислота капрон Группа —CO—NH— называется амидной группой, а образующиеся полимеры – полиамидами.
Полиамиды -аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды. В таких соединениях группы —CO—NH— называют пептидными группами, а связь C—N – пептидной связью.
К полипептидам относятся белки. В их молекулах присутствуют остатки не одной, а нескольких аминокислот. При гидролизе белков (в кислотной среде или под действием ферментов) образуется смесь аминокислот.
Получение -аминокислот.
- Из карбоновых кислот:
CH3—CH2—COOH + Cl2 CH3—CHCl—COOH + HCl
CH3—CHCl—COOH + 3NH3 CH3—CH(NH2)—COONH4 + NH4Cl
CH3—CH(NH2)—COONH4 + HCl CH3—CH(NH2)—COOH + NH4Cl - Гидролиз белков.
Качественные (“цветные”)реакции на белки:
а) Ксантопротеиновая – появление желтой окпаски при взаимодействии белка с концентрированной азотной кислотой.
б) Биуретовая – появление фиолетово-синей окраски при взаимодействии белков с гидроксидом меди(II).
Задачи и тесты по теме “Амины. Аминокислоты”
Рекомендации к теме
Проверьте, правильно ли Вы усвоили следующие понятия: аминогруппа, амины, первичные амины, вторичные амины, третичные амины, ароматические амины, амфотерность, биполярный ион, пептидная связь; знаете ли Вы общие формулы аминов, первичных аминов, вторичных аминов, третичных аминов, аминокислот, формулы пептидной группы, метиламина, этиламина, анилина, глицина, аланина. Знаете ли Вы реакции горения, реакции с кислотами, с водой, со щелочами (для аминокислот), со спиртами (для аминокислот). Знаете ли Вы реакции поликонденсации для аминокислот и реакцию гидролиза белков. Знаете ли Вы качественные реакции на белки.
Убедившись, что все необходимое усвоено, переходите к выполнению заданий. Желаем успехов.
Рекомендованная литература:
- О. С. Габриелян и др. Химия 10 кл. М., Дрофа, 2002;
- Л. С. Гузей, Р. П. Суровцева, Г. Г. Лысова. Химия 11 кл. Дрофа, 1999.
- Г. Г. Лысова. Опорные конспекты и тесты по органической химии. М., ООО “Глик плюс”, 1999.
- Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 10 кл. М., Просвещение, 2001.
Источник

