Какими свойствами обладает водный раствор аммиака

Аммиак – NH3

Аммиак
(в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на
перекрестке караванных путей. В жарком климате мочевина (NH2)2CO,
содержащаяся в продуктах жизнедеятельности животных, разлагается
особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского
слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
1. Строение молекулы


Молекула аммиака имеет форму тригональной пирамиды с
атомом азота в вершине. Три неспаренных
p-электрона атома азота участвуют в образовании полярных ковалентных
связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара
внешних электронов является неподелённой, она может образовать
донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Вид химической связи: ковалентная полярная, три одинарные σ – сигма связи N-H
2. Физические свойства аммиака
При нормальных условиях
— бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти
вдвое легче воздуха, ядовит. По
физиологическому действию на организм относится к группе веществ удушающего и
нейротропного действия, способных при ингаляционном поражении вызвать
токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают
слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и
воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение,
боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы
кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно
велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме
воды.
3. Получение аммиака
В лаборатории | В |
Для получения аммиака в лаборатории NH4Cl (NH4)2SO4 Внимание! Гидроксид аммония неустойчивое основание, При получении аммиака держите пробирку – приёмник дном кверху, так как аммиак легче воздуха: | Промышленный способ получения аммиака N2(г) + 3H2(г) ↔ 2NH3(г) Условия: катализатор температура давление Это так называемый процесс Габера (немецкий |
4. Химические свойства аммиака
Для аммиака характерны реакции:
- с
изменением степени окисления атома азота (реакции окисления) - без
изменения степени окисления атома азота (присоединение)
Реакции N-3 → N0 → N+2 NH3 – сильный |
с кислородом 1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O Видео – Эксперимент ” Окисление аммиака в |
с оксидами металлов 2 NH3 |
с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl |
аммиак – непрочное соединение, при 2NH3↔ N2 + 3H2 |
5. Применение аммиака
По объемам производства
аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100
миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде
водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду
применяют также непосредственно в виде удобрения, а иногда поля поливают из
цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого
хладагента в промышленных холодильных установках.
Аммиак используется
также для получения синтетических
волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка,
шерсти и шелка. В нефтехимической промышленности аммиак используют для
нейтрализации кислотных отходов, а в производстве природного каучука аммиак
помогает сохранить латекс в процессе его перевозки от плантации до завода.
Аммиак используется также при производстве соды по методу Сольве. В
сталелитейной промышленности аммиак используют для азотирования – насыщения
поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики
используют водные растворы аммиака (нашатырный спирт)
в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека
из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ТРЕНАЖЁРЫ
Тренажёр №1 “Горение аммиака”
Тренажёр №2 “Химические свойства аммиака”
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Источник
Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.

Строение
Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.
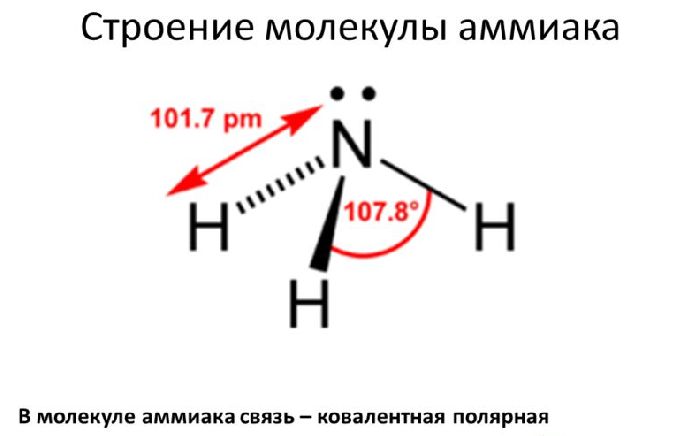
Рис. 1. Строение молекулы аммиака.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – CH3NH2);
- вторичные (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.

Рис. 2. Образование аминов.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Физические
Основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°С, при 0°С – 1200);
- легче воздуха.
Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С. Концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Химические
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.
Взаимодействие | Продукты реакции | Уравнение |
С кислородом | Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота | – 4NH3 +3O2 → 2N2 + 6H2O; – 4NH3 + 5O2 → 4NO + 6H2O |
С галогенами | Азот, кислота | 2NH3 + 3Br2 → N2 + 6HBr |
С водой | Гидроксид аммония или нашатырный спирт | NH3 + H2O → NH4OH |
С кислотами | Соли аммония | – NH3 + HCl → NH4Cl; – 2NH3 + H2SO4 → (NH4)2SO4 |
С солями | Замещает металл, образуя новую соль | 2NH3 + CuSO4 → (NH4)2SO4 + Cu |
С оксидами металлов | Восстанавливает металл, образуется азот | 2NH3 + 3CuO → 3Cu + N2 + 3H2O |

Рис. 3. Горение аммиака.
Что мы узнали?
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Тест по теме
Оценка доклада
Средняя оценка: 4.3. Всего получено оценок: 293.
Источник

Бесцветный газ NH3 с резким запахом отлично растворяется в жидкости и при этом выделяет тепло. Смесь получается во время взаимодействия вещества с молекулами Н2О. Она получила широкое применение в растениеводстве и животноводстве, в пищевой и медицинской отраслях, в промышленности для производства кальцинированной соды, марганца и ферросплавов. В статье мы постараемся подробно рассказать вам о составе и свойствах аммиачной воды, применении и формуле, о пользе и вреде и о том, чем опасен избыток аммиака.
Что это такое

Водный раствор приобретает ряд свойств, которые позволяют его использовать в самых различных отраслях. Наиболее известное — нашатырь. За счет резкого запаха он применялся как средство выведения из обморочных состояний. Этим же соединением хозяйки мыли окна,так как оно заменяло современные моющие средства, эффективно удаляло грязь и не оставляло разводов на стекле.
Знакомой картиной являются огромные бочки, стоящие в полях. Еще двадцать лет назад это было очень популярное удобрение, способствующее насыщением почвы азотом. На сегодняшний день такая форма стала неактуальной из-за высоких затрат и резкого запаха.
Нормативная концентрация аммиака

В зависимости от целей, разработаны оптимальные и минимально допустимые количества растворенного вещества. Как правило, доля гидроокиси аммония составляет от 22 до 25 процентов. В бытовых нуждах применяются более слабые смеси. Это обусловлено соображениями безопасности.
Основным требованием к хранению является герметично закрытая тара и сбережение от нагрева. Сосуд должен быть сделан из пластика или стекла. Допустимо использование алюминия.
Определение и норма содержания аммиака в питьевой воде

В естественных природных условиях азотные соединения присутствуют часто, так как они являются одним из продуктов разложения биологических материалов. Поэтому возможно их попадание и в систему водоснабжения. Самым ярким признаком является резкий запах, который невозможно перепутать с другим. При подозрениях необходимо отдать образец на исследования в химическую лабораторию. В малых дозах это вещество практически безвредно, но при некоторых реакциях получаются опасные соединения. Поэтому целесообразно избавиться от нитратов с помощью фильтров. На даче или в полевых условиях можно дать влаге отстояться. Летучие соединения достаточно быстро выветриваются.
Однако этот метод не решает всех проблем. Правильнее будет использование фильтрующих систем одного из надежных производителей, например, от компании «Вода Отечество».
Нормативом по содержанию гидроокиси аммония в питьевой жидкости является не более 2 миллиграмм на один литр.
Физические характеристики

За счет того, что азот — один из самых легких химических элементов, плотность аммиачной воды составляет 888 грамм на кубический дециметр при концентрации ингредиента 25 %.
Температура замерзания — от -31 до -54 градуса. Все остальные свойства подобны чистому Н2О. При повышенной t происходит активное выветривание вещества. Этим обусловлены потери при транспортировке и хранении.
Молярная масса составляет 35,046 г/моль.
Химические свойства

Этот продукт довольно активно вступает в реакции. Он окисляет почти все цветные металлы. За счет образования катионов аммония и анионов -ОН он окрашивает лакмус в синий цвет, а фенолфталеин — в малиновый. Активно реагирует с кислотами (получаются соли аммония), сильными окислителями, галогенами, серебром и ртутью.
Сфера использования

За счет ряда специфичных свойств раствор нашел широкое применение в разных сферах народного хозяйства. В быту мы часто используем нашатырь для очищения стеклянных поверхностей, удаления загрязнений на ковровых покрытиях и одежде, для чистки серебряных предметов, устранения неприятных запахов.
Сельское хозяйство

В восьмидесятые годы прошлого столетия на каждом поле стояли цистерны. Их задействовали для хранения азотистых жидких удобрений. Внесение производилось непосредственно перед посевом или уже по росткам. Метод был обусловлен быстрым выветриванием вещества из грунта. Сейчас фактически все аграрии отказались от такой формы и перешли на гранулированное удобрение. Второй причиной замены является опасность аммиачной воды для здоровья человека. Единственный плюс — низкая стоимость продукта. Необходимая концентрация азота в почве достигается затратами в несколько раз меньше, чем при использовании твердых соединений.
Чтобы предотвратить преждевременное испарение, практиковалось внесение раствора на глубину 10-15 сантиметров при помощи специальной техники.
В животноводстве до сих пор широко употребляется гидроокись аммония для обработки грубых кормов и дезинфекции помещений для скота.
Промышленность

Высокая химическая активность азота обеспечило ему применение в самых разных сферах производственной деятельности.
- Военная индустрия. На основе этого элемента изготавливается большая часть взрывчатых веществ.
- Аммиачная вода является необходимым компонентом при окрашивании тканей, выработке хладагентов для морозильных камер.
- Использование массы для предотвращения размораживания бетонных конструкций при возведении зданий в условиях Крайнего Севера.
- Добавка Е 527 широко распространена в пищевой промышленности.
- Химики на основе NH3 выпускают соду, марганцовку, лакокрасочные материалы, полимеры. Без этого состава нельзя обойтись и в металлургии.
- С давних времен и по сей день реакция субстанции с серебром употребляется при изготовлении зеркал.
Медицина

В лечебных учреждениях нашатырь разной концентрации применяется как противообморочное средство, для вызывания рвоты при отравлениях, для обработки рук медицинских работников. Кроме того, раствор используют как препарат при невралгии, миозите.
Следует отметить, что в этой сфере имеет применение массы с низкой концентрацией аммиака. В противном случае такое действие может привести к травмам (химический ожог, паралич дыхания и т.д.).
Виды аммиачной воды

В зависимости от назначения промышленность выпускает разные категории. Они могут отличаться по процентному содержанию NH3 и степени очистки.
Для внесения удобрения в почву или мойки окон вполне достаточно марки «В», так как незначительные примеси не повлияют на желаемый результат. При производстве такой смеси используются ингредиенты низкого уровня фильтрации.
Если сферой применения является медицина, то к химическому составу предъявляются более высокие требования. В производстве под маркой «А» наличие посторонних примесей сведено до минимума. Более подробную информацию можно найти в соответствующих ГОСТах.
Подобное внимание к чистоте вещества требуется в некоторых химических и промышленных процессах (копировальная техника, светопоглощающие покрытия и т.д.).
Получение и хранение аммиачной воды

Наиболее широкое распространение при изготовлении получили три технологии.
- Обогащение Н2О газообразной фракции аммиака. Процесс заключается в многократном пропускании через жидкость с последующим охлаждением.
- Смешивание двух компонентов в жидком состоянии под давлением.
- Непрерывная подача в смеситель дозированных объемов ингредиентов. Этот способ позволяет сделать большие партии субстанции.
При транспортировке и последующем складировании особое внимание уделяется предотвращению испарения. Тара должна быть герметичной. Не допускается нагрев. Емкость изготавливается из материалов нейтральных к этой субстанции (многие цветные металлы подвержены коррозии).
Меры предосторожности

Основным фактором опасности является резкий запах и возможность химического ожога. Особенно это актуально при высоких концентрациях. Поэтому при работе с составом необходимо применять перчатки и средства защиты органов дыхания.
Ожог может вызвать и попадание на кожу. Поэтому лучше использовать спецодежду.
Самая распространенная опасность исходит от паров, вдыхание которых может вызвать головокружение, рвотные позывы, дезориентацию в пространстве и слезоточивость. При первых симптомах необходимо прервать работу и обеспечить проветривание. Обычно, если вовремя выполнить рекомендацию, то тяжелых последствий не наступает. Однако при длительном контакте возможны варианты, когда без обращения в медицинские учреждения не обойтись.
Как сделать аммиачную воду для использования на даче
За счет своей дешевизны этот состав нашел широкое применение у огородников. Подкормка вносится на глубину 10-15 сантиметров непосредственно перед посевом. Если не заглублять, то происходит быстрое выветривание и резко снижается эффективность удобрения. Садоводам необходимо знать, что длительное применение любых азотных смесей приводит к закислению почвы. Поэтому необходимо параллельное введение извести содержащих препаратов.
Растворы, продающиеся в магазинах, обычно готовы к работе. Но при желании можно довести концентрацию до более низкой, обеспечивающей безопасность и технологичность процесса.
Борьба с вредителями
Основной эффект заключается в отпугивании вредных насекомых, таких как тля, медведка, луковая муха. Вещество не является ядом, поэтому обработка овощных культур против нелетающих паразитов неэффективна.
При использовании необходимо помнить, что избыток азотсодержащих препаратов не менее вреден, чем их недостаток. Растения имеют свойства впитывать состав через листья.
Обработка должна производиться по правилам.
- В сухую и безветренную погоду.
- Полив молодых саженцев запрещен во избежание получения ожогов.
- Соблюдать дозировку.
- Применять раз в семь дней.
- Хранить в герметичном сосуде, чтобы не потерялись свойства.
Образование аммиачной воды и приготовление для подкормки

Большинство агрономов рекомендуют применять смесь низкой концентрации параллельно с поливом. Поэтому владельцы садовых участков обычно разводят нашатырный спирт в емкости и вносят в почву. В зависимости от возраста растения меняется и процентное содержание. При применении следует учитывать, что ряд агротехнических приемов также приводит к появлению азота в грунте. Например, внесение навоза нежелательно вместе с гидроокисью аммония.
Слишком крепкий состав может привести к ожогам растений и повреждению корневой системы.
Соли аммония

Эта группа химических продуктов получается при реакции с различными кислотами.
Область применения.
- Нитраты используются как удобрения и при производстве взрывчатых веществ.
- Сульфаты — подкормка для растений более дешевого класса.
- Гидрокарбонаты применяются в пищевой промышленности как разрыхлитель и консервант.
- Карбонаты являются частью технологической цепочки по получению красителей и пластиков.
- Хлориды задействуют в ветеринарии.
Все материи имеют яркие признаки классических солей, наиболее близкие по характеристикам к натриевым соединениям. Хорошо растворяются с диссоциацией на ионы. При нагревании разлагаются. Под воздействием щелочей выделяется аммиак.
Как хранить гидроокись аммония
Для того чтобы субстанция не изменила своей химической структуры, необходимо:
- использовать герметичные емкости;
- применять для тары материал, нейтральный к реагенту (стекло, полиэтилен, пластик, черные металлы);
- не допускать перегрева от обогревательных приборов или прямых солнечных лучей;
- соблюдать меры предосторожности и режим вентиляции складского помещения.
Плюсы вещества

Благодаря своим уникальным свойствам и достаточно простом способе изготовления, этот продукт используется со времен древнего Египта. Если раньше он находил применение исключительно в медицине и как чистящее средство, то с развитием науки и технологий его сфера потребления резко увеличилась.
Несложные процессы и относительная безопасность производства обеспечили задействованность препарата в сельском хозяйстве и химической индустрии.
Наиболее важным преимуществом является низкая себестоимость состава. Это позволяет применять его в самых разных сферах хозяйства. Простота и безопасность хранения существенно снижают расходы на эти процессы. При соблюдении технологии срок годности неограничен. Исключено слеживание — большая проблема для хозяйственников при использовании селитры.
Усвоение азота растениями проходит без дополнительной траты воды. Поэтому такая подкормка очень популярна в регионах, где имеется недостаток влаги.
Многие удобрения на основе N взрывоопасны. Раствор лишен такого качества и совершенно безвреден. Если при нештатной ситуации допустить аварийный разлив, то не произойдет катастрофического заражения площади. За счет испарения пространство очищается через короткий промежуток времени, что невозможно при попадании больших объемов гранулированных удобрений на почву. Например, при рассыпании селитры, грунт становится непригодным для выращивания растений на очень длительный срок. Благодаря нитрификации внесенный аммиак создает в земле устойчивые соединения, не подверженные разложению.
Вред

Из-за ошибок агрономов, когда удобрение вносится каждый год на протяжении нескольких лет в больших объемах, произошло уничтожение почвенных микроорганизмов в некоторых областях нашей страны. Поэтому владельцы земельных угодий стараются сократить применение аммиака. Стабильную урожайность принесет только «живая» земля, на которой происходит естественный биоценоз грунта и растительности.
Наличие аммиака и его превышение в сточной воде привело к гибели почвенного покрова в Соединенных Штатах Америки и Украине. На сегодняшний день экологичность выращенных продуктов оставляет желать лучшего. В погоне за кратковременной прибылью хозяйственники этих стран превратили плодородные земли просто в субстрат.
Кроме этого, попавший аммиак в водопроводную сеть, способен нанести непоправимый вред здоровью человека. Если употреблять неотфильтрованную жидкость, то могут возникнуть проблемы в желудочно-кишечном тракте. Чтобы защитить себя и своих близких от негативных последствий, необходимо воспользоваться насадкой на кран или поставить очистительную систему. Желательно, чтобы данную услугу предоставляли специалисты с высокой квалификацией, например, компания «Вода Отечество». По результатам проведенных исследований менеджеры помогут вам подобрать наиболее оптимальное оборудование для очистки.
Мы предоставляем вам наглядное пособие, по которому вы поймете, что такое аммиачная вода, как определить концентрацию аммиака в скважине и как помочь земле насытиться азотом.
Источник
