Какими свойствами обладает серная кислота

| Серная кислота | |||
|---|---|---|---|
| Систематическое наименование | серная кислота | ||
| Хим. формула | H2SO4 | ||
| Состояние | жидкость | ||
| Молярная масса | 98,078 ± 0,006 г/моль | ||
| Плотность | 1,8356 г/см³ | ||
| Динамическая вязкость | 21 мПа·с[1] | ||
| Температура | |||
| • плавления | 10,38 °C | ||
| • кипения | 337 °C | ||
| Удельная теплота плавления | 10,73 Дж/кг | ||
| Давление пара | 0,001 ± 0,001 мм рт.ст.[2] | ||
| Константа диссоциации кислоты | -3 | ||
| Растворимость | |||
| • в воде | смешивается | ||
| Показатель преломления | 1.397 | ||
| Дипольный момент | 2.72 Д | ||
| Рег. номер CAS | 7664-93-9 | ||
| PubChem | 1118 | ||
| Рег. номер EINECS | 231-639-5 | ||
| SMILES | OS(O)(=O)=O | ||
| InChI | 1S/H2O4S/c1-5(2,3)4/h(H2,1,2,3,4) QAOWNCQODCNURD-UHFFFAOYSA-N | ||
| Кодекс Алиментариус | E513 | ||
| RTECS | WS5600000 | ||
| ChEBI | 26836 | ||
| Номер ООН | 1830 | ||
| ChemSpider | 1086 | ||
| ЛД50 | 510 мг/кг | ||
| Пиктограммы СГС | |||
| NFPA 704 | 3 2 W | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с сильнокислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум). Смертельно ядовита.
Название[править | править код]
В XVIII—XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах. Серную кислоту в то время называли «купоросным маслом»[3][4], очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) — купоросы.
Получение серной кислоты[править | править код]
Промышленный (контактный) способ[править | править код]
В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания серы или серного колчедана) до триоксида (серного ангидрида) с последующим взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют контактной (концентрация 92-94 %).
Нитрозный (башенный) способ[править | править код]
Раньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли башенной (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды. Именно таким способом произошла реакция в воздухе Лондона во время Великого смога.
Физические и физико-химические свойства[править | править код]
Очень сильная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2О с температурой кипения 338,8оС). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, HSO4− — 0,18, H3SO4+ — 0,14, H3O+ — 0,09, H2S2O7, — 0,04, HS2O7⁻ — 0,05. Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H3О+, HSO3+, и 2НSO₄−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
Олеум[править | править код]
Основная статья: Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
Сульфит
Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H2SO4.
| Содержание % по массе | Плотность при 20 ℃, г/см³ | Температура плавления, ℃ | Температура кипения, ℃ | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | – | 1,0661 | −5,5 | 102,0 |
| 20 | – | 1,1394 | −19,0 | 104,4 |
| 40 | – | 1,3028 | −65,2 | 113,9 |
| 60 | – | 1,4983 | −25,8 | 141,8 |
| 80 | – | 1,7272 | −3,0 | 210,2 |
| 98 | – | 1,8365 | 0,1 | 332,4 |
| 100 | – | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
Уравнение температурной зависимости константы равновесия:
При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H2SO4·SO3, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO3 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H2SO4[источник не указан 3235 дней]. Для олеума минимальное ρ при концентрации 10 % SO3. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
Химические свойства[править | править код]
Серная кислота в концентрированном виде при нагревании — довольно сильный окислитель.
Окисляет HI и частично HBr до свободных галогенов.
Углерод до CO2, серу — до SO2.
Окисляет многие металлы (исключения: Au, Pt, Ir, Rh, Ta.). При этом концентрированная серная кислота восстанавливается до SO2, например[5]:
На холоде в концентрированной серной кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются и реакции не протекают.
Наиболее сильными восстановителями концентрированная серная кислота восстанавливается до S и H2S. Концентрированная серная кислота поглощает водяные пары, поэтому она применяется для сушки газов, жидкостей и твёрдых тел, например, в эксикаторах. Однако концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Отщепляя воду от органических соединений и оставляя при этом чёрный углерод (уголь), концентрированная серная кислота приводит к обугливанию древесины, сахара и других веществ[5].
Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением, например[5]:
Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:
На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
Концентрированная H2SO4 превращает некоторые органические вещества в другие соединения углерода:
Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария, при котором образуется белый осадок сульфата бария, нерастворимый в воде и кислотах, например[6]:
Применение[править | править код]
Серную кислоту применяют:
- в обработке руд, особенно при добыче редких элементов, в том числе урана, иридия, циркония, осмия и т. п.;
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.;
- для восстановления смол в фильтрах на производстве дистиллированной воды.
Мировое производство серной кислоты около 200 млн тонн в год[7]. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На P₂O₅ фосфорных удобрений расходуется в 2,2—3,4 раза больше по массе серной кислоты, а на (NH₄)₂SO₄ серной кислоты 75 % от массы расходуемого (NH₄)₂SO₄. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие[править | править код]
Серная кислота и олеум — очень едкие вещества. Они поражают все ткани организма. При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Попадание кислоты на глаза может привести как к конъюнктивиту, так и к полной потере зрения.[8] Предельно допустимая концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности II. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.
В РФ оборот серной кислоты концентрации 45 % и более — ограничен[9].
Исторические сведения[править | править код]
Серная кислота известна с древности, встречаясь в природе в свободном виде, например, в виде озёр вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
Схема получения серной кислоты из железного купороса — термическое разложение сульфата железа (II) с последующим охлаждением смеси[10]
В трудах алхимика Валентина (XIII в) описывается способ получения серной кислоты путём поглощения водой газа (серный ангидрид), выделяющегося при сжигании смеси порошков серы и селитры. Впоследствии этот способ лег в основу т. н. «камерного» способа, осуществляемого в небольших камерах, облицованных свинцом, который не растворяется в серной кислоте. В СССР такой способ просуществовал вплоть до 1955 г.
Алхимикам XV века в известен был также способ получения серной кислоты из пирита — серного колчедана, более дешёвого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах.
Впоследствии, в связи с развитием катализа этот метод вытеснил камерный способ синтеза серной кислоты. В настоящее время серную кислоту получают каталитическим окислением (на V2O5) оксида серы (IV) в оксид серы (VI), и последующим растворением оксида серы (VI) в 70 % серной кислоте с образованием олеума.
В России производство серной кислоты впервые было организовано в 1805 году под Москвой в Звенигородском уезде. В 1913 году Россия по производству серной кислоты занимала 13 место в мире.[11]
Дополнительные сведения[править | править код]
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (Полуостров Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[12]. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3⋅107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994[13].
Стандарты[править | править код]
- Кислота серная техническая ГОСТ 2184—77
- Кислота серная аккумуляторная. Технические условия ГОСТ 667—73
- Кислота серная особой чистоты. Технические условия ГОСТ 14262—78
- Реактивы. Кислота серная. Технические условия ГОСТ 4204—77
Примечания[править | править код]
- ↑ Kirk-Othmer Encyclopedia of Chemical Technology — ISBN 0-471-23896-1
- ↑ https://www.cdc.gov/niosh/npg/npgd0577.html
- ↑ Ушакова Н. Н., Фигурновский Н. А. Василий Михайлович Севергин: (1765—1826) / Ред. И. И. Шафрановский. М.: Наука, 1981. C. 59.
- ↑ См. также Каменное масло
- ↑ 1 2 3 Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 91. Химические свойства серной кислоты // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 209—211. — 240 с. — 1 630 000 экз.
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 92. Качественная реакция на серную кислоту и её соли // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 212. — 240 с. — 1 630 000 экз.
- ↑ Sulfuric acid (англ.) // «The Essential Chemical Industry — online»
- ↑ SULFURIC ACID | CAMEO Chemicals | NOAA. cameochemicals.noaa.gov. Дата обращения 22 мая 2020.
- ↑ Постановление Правительства Российской Федерации от 3 июня 2010 года № 398 (недоступная ссылка). Дата обращения 30 мая 2016. Архивировано 30 июня 2016 года.
- ↑ Эпштейн, 1979, с. 40.
- ↑ Эпштейн, 1979, с. 41.
- ↑ см. статью «Вулканы и климат» Архивная копия от 28 сентября 2007 на Wayback Machine (рус.)
- ↑ Русский архипелаг — Виновато ли человечество в глобальном изменении климата? Архивная копия от 1 декабря 2007 на Wayback Machine (рус.)
Литература[править | править код]
- Справочник сернокислотчика, под ред. К. М. Малина, 2 изд., М., 1971
- Эпштейн Д. А. Общая химическая технология. — М.: Химия, 1979. — 312 с.
Ссылки[править | править код]
- Статья «Серная кислота» (Химическая энциклопедия)
- Плотность и значение pH серной кислоты при t=20 °C
Источник
Серная кислота – одна из сильнейших кислот, представляющая собой маслянистую жидкость. Химические свойства серной кислоты позволяют широко применять её в промышленности.

Общее описание
Серная кислота (H2SO4) обладает характерными свойствами кислот и является сильным окислителем. Это наиболее активная неорганическая кислота с температурой плавления 10°C. Кислота закипает при 296°C с выделением воды и оксида серы SO3. Способна поглощать пары воды, поэтому её используют для осушения газов.

Рис. 1. Серная кислота.
Серную кислоту получают промышленным путём из диоксида серы (SO2), который образуется при горении серы или серного колчедана. Два основных способа образования кислоты:
- контактный (концентрация 94 %) – окисление диоксида серы до трёхокиси серы (SO3) с последующим гидролизом:
2SO2 + O2 → 2SO3; SO3 + H2O → H2SO4;
- нитрозный (концентрация 75 %) – окисление диоксидом азота диоксида серы при взаимодействии воды:
SO2 + NO2 + H2O → H2SO4 + NO.
Раствор SO3 в серной кислоте называется олеумом. Его также используют для получения серной кислоты.
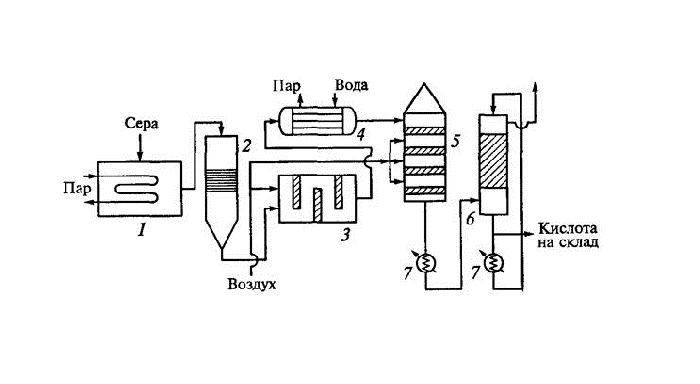
Рис. 2. Процесс получения серной кислоты.
Реакция с водой способствует выделению большого количества тепла. Поэтому к воде примешивают кислоту, а не наоборот. Вода легче кислоты, она остаётся на поверхности. Если добавить воду в кислоту, вода мгновенно закипит, что приведёт к разбрызгиванию кислоты.
Свойства
Серная кислота образует два вида солей:
- кислые – гидросульфаты (NaHSO4, KHSO4);
- средние – сульфаты (BaSO4, CaSO4).
Химические свойства концентрированной серной кислоты представлены в таблице.
Реакция | Что образуется | Пример |
С металлами | – Соль; – вода; – оксид серы; – сера; – сероводород | – С активными: 2H2SO4 + Mg → MgSO4 + SO2 + 2H2O – с металлами средней активности: 4H2SO4 + 2Cr → Cr2(SO4)3 + 4H2O + S; – с малоактивными: 2H2SO4 + Cu → CuSO4 + SO2 + 2Н2О |
С неметаллами | – Кислота; – вода; – оксид серы | 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O |
С оксидами | – Соль; – вода; – оксид серы | – Металлов: H2SO4 + CuO → CuSO4 + H2O; – неметаллов: H2SO4 + CO → CO2 + SO2 + H2O |
С основаниями | – Соль; – вода | H2SO4 + 2NaOH → Na2SO4 + 2H2O |
С солями | – Соль; – углекислый газ; – вода; – кислота | Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O Качественная реакция: H2SO4 + BaCl2 → BaSO4 (белый осадок) + 2HCl |
Окисление сложных веществ | – Свободные галогены; – оксид серы; – вода | H2SO4 + 2HBr → Br2 + SO2 + 2H2O; H2SO4 + 2HI → I2 + 2H2O + SO2 |
Обугливание сахаров (целлюлозы, крахмала, глюкозы) | – Оксид серы; – углекислый газ; – вода | C6H12O6 + 12H2SO4 → 18H2O + 12SO2↑ + 6CO2↑ |

Рис. 3. Реакция с сахаром.
Разбавленная кислота не окисляет малоактивные металлы, стоящие в электрохимическом ряду после водорода. При взаимодействии с активными металлами (литием, калием, натрием, магнием) выделяется водород и образуется соль. Концентрированная кислота проявляет окислительные свойства с тяжёлыми, щелочными и щелочноземельными металлами при нагревании. Отсутствует реакция с золотом и платиной.
Серная кислота (разведённая и концентрированная) на холоде не взаимодействует с железом, хромом, алюминием, титаном, никелем. Благодаря пассивации металлов (образования защитной оксидной плёнки) серную кислоту можно перевозить в металлических цистернах. Оксид железа разрушается при нагревании.
Что мы узнали?
Из урока 9 класса узнали о свойствах серной кислоты. Это мощный окислитель, вступающий в реакции с металлами, неметаллами, органическими соединениями, солями, основаниями, оксидами. При взаимодействии с водой выделяется тепло. Получают серную кислоту из оксида серы. Концентрированная кислота без нагревания не взаимодействует с некоторыми металлами, что позволяет перевозить кислоту в металлической таре.
Тест по теме
Оценка доклада
Средняя оценка: 4.1. Всего получено оценок: 279.
Источник
Серная кислота. Общая характеристика, получение, химические свойства

Серная кислота
Серная кислота, также известная как масло витриола, или купоросное масло представляет собой минеральную кислоту, состоящую из элементов серы, кислорода и водорода, с молекулярной формулой H2SO4.

Она является бесцветной, не имеющей запаха вязкой жидкостью, которая растворима в воде и синтезируется в реакциях, которые являются сильно экзотермическими.
Чистая серная кислота является вязкой прозрачной жидкостью, как масло, и это объясняет старое название кислоты (“масло витриола”).
Обладает следующими важными характеристиками:
- гигроскопичная – легко поглощает водяной пар из воздуха;
- коррозионная – сильный окислитель и дегидратирующий агент;
- вызывает ожоги – даже при малых концентрациях способна к образованию химических и вторичных термических ожогов.
Серная кислота в истории
Изучение витриола (купороса) – категории стекловидных минералов, из которых может быть получена кислота, началось в древности.
- Одни из самых ранних дискуссий о происхождении и свойствах витриола – в работах греческого врача Диоскорида (I век нашей эры) и римского натуралиста Плиния Старшего (23-79 годы нашей эры).
Средневековые алхимики исламской эпохи, Джабир ибн Хайян (721 – 815, также известный как Гебер), Рази (865 – 925) и Джамаль Дин аль – Ватват (1318), включили купорос в списки классификации минералов.
- Ибн Сина (Авиценна) сосредоточился на медицинских применениях и различных разновидностях витриола.
Мухаммад ибн Закарий аль-Рази (854-925) считается первым, кто произвел серную кислоту. Серная кислота была названа “маслом витриола” средневековыми европейскими алхимиками, потому что она была приготовлена обжаркой “зелёного купороса” (сульфата железа (II)) в железной реторте.
- В XVII веке германо – голландский химик Иоганн Глаубер приготовил серную кислоту, сжигая серу вместе с селитрой (нитрат калия, KNO3), в присутствии пара. По мере разложения солевого раствора он окислял серу до SO3, который объединялся с водой для получения серной кислоты.
В 1736 году лондонский фармацевт Джошуа Уорд использовал этот метод для начала первого крупномасштабного производства серной кислоты.
- В 1746 году в Бирмингеме Джон Робак применил этот способ для получения H2SO4 в камерах со свинцовой облицовкой, которые были более прочными, менее дорогими и более крупными, чем ранее использовавшиеся стеклянные контейнеры. Этот процесс позволил эффективно индустриализовать производство серной кислоты.
После нескольких уточнений этот способ, называемый процессом в свинцовой камере или “камерный процесс”, оставался стандартом для производства серной кислоты в течение почти двух столетий.
В 1831 году британский торговец уксусом Перегрин Филлипс запатентовал “контактный процесс”, который был гораздо более экономичным процессом производства серного ангидрида и концентрированной серной кислоты.
Получение серной кислоты
Существует несколько способов получения серной кислоты, в частности
- процесс влажной серной кислоты (метод WSA), мокрый катализ;
- метод “свинцовой камеры” – первый индустриальный способ получения серной кислоты;
- “контактный метод” – современный способ получения больших объемов H2SO4.
Серная кислота и Вода
Концентрированная серная кислота обладает очень мощным
дегидратирующим свойством, удаляя воду (H2O) из других химических
соединений, включая сахар и другие углеводы, и получая углерод, тепло и
пар.
Приготовление разбавленной кислоты может быть опасным из-за тепла, выделяющегося в процессе разбавления.
Вода обладает более высокой теплоемкостью, чем кислота, и поэтому
сосуд из холодной воды будет поглощать тепло по мере добавления
кислоты.
Поскольку реакция гидратации серной кислоты является
очень экзотермической, разбавление всегда должно осуществляться
добавлением кислоты к воде, а не воды к кислоте.
Реакция находится в равновесии, которое способствует
быстрому протонированию воды, добавление кислоты к воде гарантирует, что
кислота является ограничительным реагентом.
Эту реакцию лучше всего рассматривать как образование ионов гидроксония:
H2SO4 + H2O → H3O+ + HSO4-
HSO4- + H2O → H3O+ + SO2 2-
Серная кислота и Ожоги
Серная кислота способна вызывать сильные ожоги, особенно когда она находится в высоких концентрациях.
- Она легко разлагает белки и липиды посредством гидролиза амида и сложного эфира при контакте с живыми тканями, такими как кожа и мышцы;
- проявляет сильное дегидратирующее свойство на углеводах, высвобождая дополнительное тепло и вызывая вторичные термические ожоги;
- быстро атакует роговицу и может вызвать постоянную слепоту, если плеснуть на глаза;
- в случае проглатывания она необратимо повреждает внутренние органы и может даже привести к летальному исходу;
- сильные окислительные свойства делают ее сильно коррозионной по отношению ко многим металлам и могут привести к его разрушению на других материалах.
По этим причинам ущерб, наносимый серной кислотой, потенциально является более серьезным, чем ущерб, наносимый другими сравнительно сильными кислотами, такими как соляная кислота и азотная кислота.
Серная кислота и ее Опасность
- H2SO4 – негорючая кислота.
Основными
профессиональными рисками, создаваемыми этой кислотой, являются контакт
с кожей, приводящий к ожогам и вдыхание паров.
- Воздействие паров в высоких концентрациях приводит к немедленному и сильному
раздражению глаз, дыхательных путей и слизистых оболочек: это быстро
прекращается после воздействия, хотя существует риск последующего отека
легких, если повреждение тканей было более сильным.
При
более низких концентрациях наиболее часто сообщаемым симптомом
хронического воздействия сернокислотных аэрозолей является эрозия зубов,
обнаруженная практически во всех исследованиях.
- Повторное воздействие сернокислых туманов может повысить вероятность развития рака легких до 64 процентов.
В
США допустимый предел воздействия на серную кислоту установлен на
уровне 1 мг/м3: пределы в других странах аналогичны. Были сообщения о
приеме серной кислоты в пищу, приводящем к дефициту витамина B12 с комбинированной дегенерацией.
- В
таких случаях чаще всего поражается спинной мозг, но зрительные нервы
могут демонстрировать демиелинизацию, потерю аксонов и глиозы.
Серная кислота и ее Применение
Производство H2SO4 в стране является хорошим показателем ее промышленной прочности.
Мировое производство в 2004 году составило около 180 миллионов тонн при следующем географическом распределении:
- Азия – 35%,
- Северная Америка (включая Мексику) – 24%,
- Африка 11%, Западная Европа – 10%,
- Восточная Европа и Россия – 10%,
- Австралия и Океания – 7%,
- Южная Америка – 7%.
Большая часть этого количества (≈60%) потребляется на удобрения, в частности на суперфосфаты, фосфат аммония и сульфаты аммония.
Около 20% используется в химической промышленности для производства моющих средств, синтетических смол, красителей, фармацевтических препаратов, нефтяных катализаторов, инсектицидов и антифризов, а также в различных процессах, таких как кислотизация нефтяных скважин, восстановление алюминия, проклеивание бумаги, обработка воды.
Около 6% применений относятся к пигментам и включают краски, эмали, печатные краски, мелованные ткани и бумагу.
Остальное количество (≈14%) применяется в таких отраслях, как производство взрывчатых веществ, целлофана,
ацетата и вискозного текстиля, смазочных материалов, цветных металлов и
батарей.
Серная кислота и Водоросли
H2SO4 используется в качестве защиты некоторыми морскими видами, например, фаэофит Desmarestia munda (порядок Desmarestiales) концентрирует серную кислоту в клеточных вакуолях.
- Под воздействием воздуха они выделяют кислоту, тем самым разрушая себя и близлежащие морские водоросли в процессе.
Серная кислота и Венера
Серная кислота образуется в верхних слоях атмосферы Венеры при фотохимическом воздействии Солнца на диоксид углерода, диоксид серы и водяной пар.
- Ультрафиолетовые фотоны с длинами волн менее 169 нм могут фотодиссоциировать диоксид углерода на монооксид углерода и атомный кислород.
В верхних, более холодных частях атмосферы Венеры серная кислота существует в виде жидкости, а густые облака серной кислоты полностью затмевают поверхность планеты, если смотреть сверху.
- Постоянные венерины облака производят концентрированный кислотный дождь, так как облака в атмосфере Земли производят водный дождь.
Серная кислота и Европа
Инфракрасные спектры, полученные космическим аппаратом NASA Galileo, показывают различные поглощения на спутнике Юпитера Европе, которые приписываются одному или нескольким гидратам серной кислоты.
- H2SO4 в растворе с водой вызывает значительное снижение температуры плавления воды до 210 К (− 63 С), и это делает более вероятным существование жидких растворов под ледяной коркой Европы.
Трактовка спектров несколько спорна. Некоторые планетологи предпочитают присваивать спектральные особенности сульфатному иону, возможно, как части одного или нескольких минералов на поверхности Европы.
Серная кислота на Земле
Чистая серная кислота не встречается естественным образом на Земле в безводной форме из-за ее большого сродства к воде.
- Разбавленная серная кислота является составной частью кислотного дождя, который образуется атмосферным окислением диоксида серы в присутствии воды, то есть окислением сернистой кислоты.
Диоксид серы является основным побочным продуктом, получаемым при сжигании серосодержащих видов топлива, таких как уголь или нефть.
- Серная кислота образуется путем окисления сульфидных минералов, таких как сульфид железа.
- В стратосфере, втором слое атмосферы, который обычно находится между 10 и 50 км над поверхностью Земли, серная кислота образуется в результате окисления вулканического диоксида серы гидроксильным радикалом.
Поскольку серная кислота достигает перенасыщения в стратосфере, она может образовать частицы аэрозоля и обеспечить поверхность для роста аэрозоля путем конденсации и коагуляции с другими аэрозолями вода-серная кислота, что приводит к образованию стратосферного аэрозольного слоя.
Таблица 1: Химические свойства серной кислоты
Реагенты | Разбавленная H2SO4 | Концентрированная H2SO4 |
Металлы активные (Ca, Na, Ba, Zn, Mg) | H2SO4 (p.) + Zn = ZnSO4 + H2↑ H2SO4 (p.) + Ca = CaSO4 + H2↑ | 4H2SO4 (k.) + 3Mg = 3MgSO4 + S↓ + 4H2O 2H2SO4 (k.) + Mg = MgSO4 + SO2 + 2H2O 5H2SO4 (k.) + 4Mg = 4MgSO4 + H2S + 4H2O |
Металлы средней активности (Fe, Sn, Cr, Co, Ni, Pb) | H2SO4 (p.) + Fe = FeSO4 + H2↑ H2SO4 (p.) + Pb ≠ | 2H2SO4 (k.) + Fe = FeSO4 + SO2↑+ 2H2O (t) |
Малоактивные металлы (Hg, Ag, Cu, Bi) | H2SO4 (p.) + Cu ≠ H2SO4 (p.) + Hg ≠ | 2H2SO4 (k.) + Cu = CuSO4 + SO2 + 2H2O (t) H2SO4 (k.) + Au, Pt ≠ ни при каких условиях |
Неметаллы | – | 2H2SO4 (k.) + S = 3SO2 + 2H2O 2H2SO4 (k.) + C = 2SO2 + CO2 + 2H2O 5H2SO4 (k.) + 2P = 2H3PO4 + 5SO2 + 2H2O H2SO4 (k.) + F2 = 2HF + SO4 (0 C) H2SO4 (k.) + Cl2, Br2, I2 ≠ |
Основания | H2SO4 (p.) + 2NaOH = Na2SO4 + 2H2O H2SO4 (p.) + 2NH4OH = (NH4)2SO4 + 2H2O 3H2SO4 (p.) + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O | H2SO4 (k.) + NaOH = NaHSO4 + H2O H2SO4 (k.) + NH4OH = NH4HSO4 + H2O |
Основные оксиды | H2SO4 (p.) + CaO = CaSO4 + H2O | H2SO4 (k.) + CuO = CuSO4 + H2O |
Амфотерные оксиды | H2SO4 (p.) + ZnO = ZnSO4 + H2O | 3H2SO4 (k.) + Al2O3 = Al2(SO4)3 + 3H2O |
Кислотные оксиды | – | H2SO4 (k.) + CO = CO2 + SO2 + H2O H2SO4 (k.) + CO2 ≠ H2SO4 (k.) + SO2 ≠ |
Соли | H2SO4 (p.) + Na2CO3 = Na2SO4 + CO2↑ + H2O H2SO4 (p.) + CaCO3 = CaSO4 + CO2↑ + H2O 3H2SO4 (p.) + Cr2S3 = Cr2(SO4)3 + 3H2S↑ | H2SO4 (k.) + NaCl = NaHSO4 + HCl (30 – 50 C) H2SO4 (k.) + Na2SO4 = 2NaHSO4 (40 C) 3H2SO4 (k.) + 2KBr = SO2 + Br2 + 2H2O + 2KHSO4 (40 – 60 C) 5H2SO4 (k.) + 8KI = H2S + 4I2 + 4H2O + 4K2SO4 |
Кислоты | – | H2SO4 (k.) + H2S = S↓ + SO2 + 2H2O H2SO4 (k.) + 8HI = 4I2 + H2S + 4H2O H2SO4 (k.) + HCl ≠ H2SO4 (k.) + 2HBr = SO2 + Br2↓ + 2H2O |
H2 | – | 2H2SO4 (k.) + 4H2 = S + SO2 + 6H2O |
H2O2 | – | H2SO4 (k.) + H2O2 = H2SO3(O2) + H2O |
Источник
