Какими свойствами обладает сера а каким железо

Голосование за лучший ответ
Магистр
Мастер
(2034)
11 лет назад
Физические свойства
Природный сросток кристаллов самородной серы
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов серы. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество желтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета. Формулу пластической серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. Химические свойства
Горение серы
При комнатной температуре сера реагирует со фтором и хлором, проявляя восстановительные свойства:
S + 3F2 = SF6
S + Cl2 = SCl2
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании, окисляясь:
S + 6HNO3(конц. ) = H2SO4 + 6NO2 ↑ + 2H2O
S + 2H2SO4(конц. ) = 3SO2 ↑ + 2H2O
На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом:
S + O2 = SO2
С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO.[2]
При взаимодействии с металлами образует сульфиды. 2Na + S = Na2S При нагревании сера реагирует с углеродом, кремнием, фосфором, водородом:
C + 2S = CS2 (сероуглерод)
Сера при нагревании растворяется в щелочах — реакция диспропорционирования
3S + 6KOH = K2SO3 + 2K2S + 3H2O
Физические свойства
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Для железа характерен полиморфизм, он имеет четыре кристаллические модификации:
до 769 °C существует α-Fe (феррит) с объёмноцентрированной кубической решёткой
в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами кристаллической решётки и магнитными свойствами
в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой
выше 1394 °C устойчив δ-Fe с объёмоцентрированной кубической решёткой
Железо тугоплавко, относится к металлам средней активности. Температура плавления железа 1539 °C, температура кипения — около 3200 °C.
Химические свойства
Основные степени окисления железа — +2 и +3.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной пленкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2О3·хН2О.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe3О4, при сгорании в чистом кислороде — оксид Fe2О3. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeO. При нагревании порошка серы и железа образуется сульфид, приближённую формулу которого можно записать как FeS.
Источник
Сера,
её физические и химические свойства. Биологическое значение серы, её применение
(демеркуризация).СЕРА S
Cера в природе
Самородная сера
Сульфиды
PbS – свинцовый блеск
Cu2S – медный блеск
ZnS – цинковая обманка
FeS2 – пирит, серный колчедан, кошачье золото
H2S – сероводород (в минеральных источниках и природном газе)
Белки
Сульфаты
CaSO4 * 2H2O – гипс
MgSO4 * 7H2O – горькая соль (английская)
Na2SO4 *10H2O – глауберова соль (мирабилит)
Физические свойства
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С.
Одно из особенных физических свойств серы – флотация, способность мелкого порошка серы всплывать, тогда, как ее крупные кристаллы тонут в воде. Дело в том, что сера не смачивается водой, и ее частички держатся на поверхности воды за счет прилипших к ним мелких пузырьков воздуха. Это свойство используют при отделении самородной серы от примесей. Руду размалывают, заливают водой, а снизу продувают воздухом, сера всплывает, а примеси остаются на дне.
Аллотропия
Для серы характерны несколько аллотропных модификаций, но наиболее известные видоизменения: ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая.
Ромбическая (a – сера) – S8
t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
Моноклинная (b – сера) – S8
темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
Пластическая Sn
коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую.
ПОЛУЧЕНИЕ ПЛАСТИЧЕСКОЙ СЕРЫ
Взаимопревращение аллотропных модификаций серы
Строение атома серы
Размещение электронов по уровням и подуровням
Основное состояние
1s22s22p63s23p4
Размещение электронов по
орбиталям (последний слой)Степень
окисленияВалентность
-2
В основном состоянии
II
+4
Первое возбуждённое состояние
IV
+6
Второе возбуждённое состояние
VI
Получение серы
1. Промышленный метод – выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2 = 2S + 2H2O
3. Реакция Вакенродера
2H2S + SO2 = 3S + 2H2O
Химические свойства серы
Сера – окислитель S0 + 2ē→ S-2 | Сера – восстановитель: S – 4ē → S+4; S – 6ē →S+6 |
1. Взаимодействие серы со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром без нагревания: 2Na + S → Na2S ОПЫТ S + Hg = HgS Ртуть обладает высокой летучестью. Её пары ядовиты. Эта реакция лежит в основе удаления и обезвреживания ртути, например из разбитого медицинского термометра. Места, из которых нельзя извлечь капельки ртути, засыпают порошком серы. Сера и ртуть вступают в реакцию при соприкосновении. В результате образуется химически инертное и безвредное вещество. Этот процесс называется демеркуризацией 2. Взаимодействие серы c остальными металлами (кроме Au,Pt) при повышенной t°: 2Al + 3S t→ Al2S3 Zn + S t°→ ZnS ОПЫТ Cu + S t→ CuS ОПЫТ 3.Взаимодействие серы с некоторыми неметаллами с образованием бинарных соединений: H2 + S → H2S 2P + 3S→ P2S3 C + 2S → CS2 | 1. Взаимодействие серы c кислородом: S + O2 t°→ S+4O2 2S + 3O2 t°;pt→ 2S+6O3 2. Взаимодействие серы c галогенами (кроме йода): S + Cl2 → S+2Cl2 **Взаимодействие серы с кислотами – окислителями: S + 2H2SO4(конц) → 3S+4O2 + 2H2O S + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O **Реакции диспропорционирования: 4. 3S0 + 6KOH→ K2S+4O3 + 2K2S-2 + 3H2O |
Тренажёр №1 – Характеристика серы по её положению в периодической системе Д. И. Менделеева
Тренажёр №2 – Химические свойства серы
Тренажёр №3 – Взаимодействие серы с металлами
Применение
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д.
Применение серы и её соединений
Домашнее задание параграф 21; упражнения 1, 3, 4 стр. 99-100.
Дополнительные зхадания
Закончите уравнения реакций, расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
- S + O2
- S + Na
- S + H2
№2. Осуществите превращения по схеме:
Это интересно…
- Содержание серы в организме человека массой 70 кг – 140 г.
- В сутки человеку необходимо 1 г серы.
- Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
- Сера входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
Следите за своим здоровьем!
Знаете ли вы..
- Соединения серы могут служить лекарственными препаратами;
- Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na2S2O3 используется для борьбы с нею.
- Многие соли серной кислоты содержат кристаллизационную воду: ZnSO4×7H2O и CuSO4×5H2O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
- Железный купорос FeSO4×7H2O используют при анемии.
- BaSO4 применяют при рентгенографическом исследовании желудка и кишечника.
- Алюмокалиевые квасцы KAI(SO4)2×12H2O – кровоостанавливающее средство при порезах.
- Минерал Na2SO4×10H2O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И.Р.Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na2SO4×10H2O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчато- бумажных тканей. Соль также находит применение в производстве стекла.
- Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями.
- Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Источник
Сера – довольно распространенный в природе химический элемент (шестнадцатый по содержанию в земной коре и шестой – в природных водах). Встречаются как самородная сера (свободное состояние элемента) так и ее соединения.

Сера в природе
В числе важнейших природных минералов серы можно назвать железный колчедан, сфалерит, галенит, киноварь, антимонит. В Мировом океане содержится в основном в виде сульфатов кальция, магния и натрия, обуславливающих жесткость природных вод.
Как получают серу?
Добыча серных руд производится разными методами. Основным способом получения серы является ее выплавка непосредственно в местах залегания.
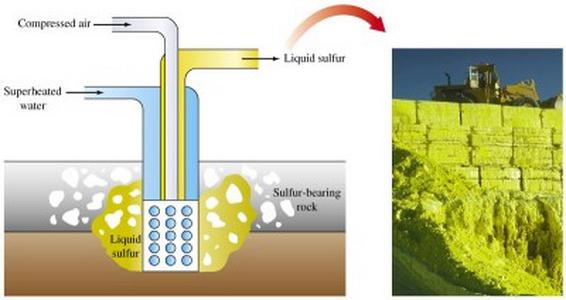
Открытый способ добычи предусматривает использование экскаваторов, снимающих породные пласты, которые покрывают серную руду. После дробления пластов руды взрывами их направляют на сероплавильный завод.
В промышленности серу получают как побочный продукт процессов в печах для плавки, при нефтепереработке. В больших количествах она присутствует в природном газе (в виде сернистого ангидрида или сероводорода), при добыче которого откладывается на стенках применяемого оборудования. Уловленную из газа мелкодисперсную серу используют в химической промышленности в качестве сырья для производства различной продукции.
Данное вещество можно получать и из природного сернистого газа. Для этого используется метод Клауса. Он заключается в применении «серных ям», в которых происходит дегазация серы. Результатом является модифицированная сера, широко использующаяся в производстве асфальта.
Основные аллотропические модификации серы
Сере присуща аллотропия. Известно большое количество аллотропических модификаций. Наиболее известными являются ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая сера. Первые две модификации являются устойчивыми, третья при затвердевании превращается в ромбическую.

Физические свойства, характеризующие серу
Молекулы ромбической (α-S) и моноклинной (β-S) модификаций содержат по 8 атомов серы, которые соединены в замкнутый цикл одинарными ковалентными связями.
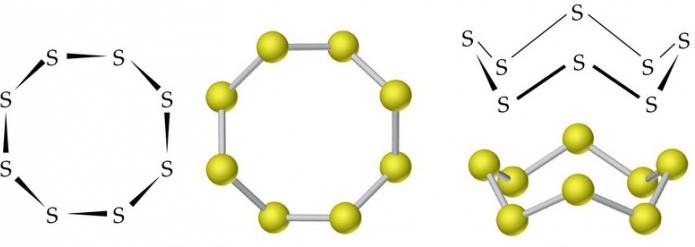
В обычных условиях сера имеет ромбическую модификацию. Представляет собой желтое твердое кристаллическое вещество с плотностью 2,07 г/см3. Плавится при 113 °C. Плотность моноклинной серы составляет 1,96 г/см3, температура ее плавления равна 119,3 °C.
При плавлении сера увеличивается в объеме и становится желтой жидкостью, которая буреет при температуре 160 °C и превращается в вязкую темно-коричневую массу при достижении около 190 °C. При температурах, превышающих это значение, вязкость серы уменьшается. При около 300 °C она снова переходит в жидкое текучее состояние. Это объясняется тем, что в процессе нагревания сера полимеризуется, с повышением температуры увеличивая длину цепочки. А при достижении температурного значения свыше 190 °C наблюдается разрушение полимерных звеньев.

При охлаждении расплава серы естественным путем в цилиндрических тиглях образуется так называемая комовая сера – ромбические кристаллы крупных размеров, имеющие искаженную форму в виде октаэдров с частично «срезанными» гранями или углами.
Если расплавленное вещество подвергнуть резкому охлаждению (к примеру, при помощи холодной воды), то можно получить пластическую серу, представляющую собой упругую каучукоподобную массу коричневатого или темно-красного цвета с плотностью 2,046 г/см3. Данная модификация, в отличие от ромбической и моноклинной, является неустойчивой. Постепенно (в течение нескольких часов) она меняет окраску на желтую, становится хрупкой и превращается в ромбическую.
При замораживании паров серы (сильно нагретых) жидким азотом образуется ее пурпурная модификация, которая является устойчивой при температурах ниже минус 80 °C.
В водной среде сера практически не растворяется. Однако характеризуется хорошей растворимостью в органических растворителях. Плохо проводит электричество и тепло.
Температура кипения серы равна 444,6 °C. Процесс кипения сопровождается выделением оранжево-желтых паров, состоящих преимущественно из молекул S8, которые при последующем нагревании диссоциируют, в результате чего образуются равновесные формы S6, S4 и S2. Далее при нагревании происходит распад крупных молекул, и при температуре выше 900 градусов пары состоят практически только из молекул S2, диссоциирующих на атомы при 1500 °С.
Какими химическими свойствами обладает сера?
Сера является типичным неметаллом. Химически активна. Окислительно–восстановительные свойства серы проявляются по отношению к множеству элементов. При нагревании легко соединяется практически со всеми элементами, что объясняет ее обязательное присутствие в металлических рудах. Исключение составляют Pt, Au, I2, N2 и инертные газы. Степени окисления, которые проявляет сера в соединениях, -2, +4, +6.
Свойства серы и кислорода обуславливают горение ее на воздухе. Результатом такого взаимодействия является образование сернистого (SO2) и серного (SO3) ангидридов, использующихся для получения сернистой и серной кислот.
При комнатной температуре восстановительные свойства серы проявляются только в отношении фтора, в реакции с которым образуется гексафторид серы:
- S + 3F2= SF6.
При нагревании (в виде расплава) взаимодействует с хлором, фосфором, кремнием, углеродом. В результате реакций с водородом кроме сернистого водорода образует сульфаны, объединенные общей формулой H2SХ.
Окислительные свойства серы наблюдаются при взаимодействии с металлами. В некоторых случаях можно наблюдать довольно бурные реакции. В результате взаимодействия с металлами образуются сульфиды (сернистые соединения) и полисульфиды (многосернистые металлы).
При длительном нагревании вступает в реакции с концентрированными кислотами-окислителями, окисляясь при этом.
Далее рассмотрим основные свойства соединений серы.
Диоксид серы
Оксид серы (IV), называемый также диоксидом серы и ангидридом сернистым, представляет собой газ (бесцветный) с резким удушающим запахом. Имеет свойство сжижаться под давлением при комнатной температуре. SO2 является кислотным оксидом. Характеризуется хорошей растворимостью в воде. При этом образуется слабая, неустойчивая сернистая кислота, существующая только в водном растворе. В результате взаимодействия сернистого ангидрида со щелочами образуются сульфиты.
Отличается довольно высокой химической активностью. Наиболее ярко выраженными являются восстановительные химические свойства оксида серы (IV). Такие реакции сопровождаются повышением степени окисления серы.
Окислительные химические свойства оксида серы проявляются в присутствии сильных восстановителей (например, оксида углерода).
Триоксид серы
Триоксид серы (ангидрид серный) – высший оксид серы (VI). В обычных условиях представляет собой бесцветную легколетучую жидкость, характеризующуюся удушающим запахом. Имеет свойство застывать при температурных значениях ниже 16,9 градуса. При этом образуется смесь разных кристаллических модификаций твердого триоксида серы. Высокие гигроскопические свойства оксида серы обуславливают его “дымление” в условиях влажного воздуха. В результате образуются капельки серной кислоты.
Сероводород
Сероводород является бинарным химическим соединением водорода и серы. H2S – это ядовитый бесцветный газ, характерными особенностями которого являются сладковатый вкус и запах протухших яиц. Плавится при температуре минус 86 °С, кипит при минус 60 °С. Неустойчив термически. При температурных значениях выше 400 °С происходит разложение сернистого водорода на S и H2. Характеризуется хорошей растворимостью в этаноле. В воде растворяется плохо. В результате растворения в воде образуется слабая сероводородная кислота. Сероводород является сильным восстановителем.

Огнеопасен. При его горении в воздухе можно наблюдать синее пламя. В больших концентрациях способен вступать в реакции со многими металлами.
Серная кислота
Серная кислота (H2SO4) может быть разной концентрации и чистоты. В безводном состоянии является бесцветной маслянистой жидкостью, не имеющей запаха.
Значение температуры, при котором вещество плавится, составляет 10 °С. Температура кипения равна 296 °С. В воде растворяется хорошо. При растворении серной кислоты образуются гидраты, при этом выделяется большое количество теплоты. Температура кипения всех водных растворов при давлении 760 мм рт. ст. превышает 100 °С. Повышение точки кипения происходит с увеличением концентрации кислоты.
Кислотные свойства вещества проявляются при взаимодействии с основными оксидами и основаниями. H2SO4 является двухосновной кислотой, за счет чего может образовывать как сульфаты (средние соли), так и гидросульфаты (кислые соли), большинство из которых растворимы в воде.
Наиболее ярко свойства серной кислоты проявляются в окислительно-восстановительных реакциях. Это объясняется тем, что в составе H2SO4 у серы высшая степень окисления (+6). В качестве примера проявления окислительных свойств серной кислоты можно привести реакцию с медью:
- Cu + 2H2SO4 = CuSO4 + 2H2O + SO2.
Сера: полезные свойства
Сера является микроэлементом, необходимым для живых организмов. Является составной частью аминокислот (метионина и цистеина), ферментов и витаминов. Данный элемент принимает участие в образовании третичной структуры белка. Количество химически связанной серы, содержащейся в белках, составляет по массе от 0,8 до 2,4%. Содержание элемента в организме человека составляет около 2 граммов на 1 кг веса (то есть примерно 0,2% составляет сера).
Полезные свойства микроэлемента трудно переоценить. Защищая протоплазму крови, сера является активным помощником организма в борьбе с вредными бактериями. От ее количества зависит свертываемость крови, то есть элемент помогает поддерживать ее достаточный уровень. Также сера играет не последнюю роль в поддержании нормальных значений концентрации желчи, вырабатываемой организмом.
Часто ее называют «минералом красоты», поскольку она просто необходима для сохранения здоровья кожи, ногтей и волос. Сере присуща способность предохранять организм от различных видов негативного воздействия окружающей среды. Это способствует замедлению процессов старения. Сера очищает организм от токсинов и защищает от радиации, что особенно актуально в настоящее время, учитывая современную экологическую обстановку.
Недостаточное количество микроэлемента в организме может привести к плохому выведению шлаков, снижению иммунитета и жизненного тонуса.
Сера – участница бактериального фотосинтеза. Она является составляющей бактериохлорофилла, а сернистый водород – источником водорода.
Сера: свойства и применение в промышленности
Наиболее широко сера используется для производства серной кислоты. Также свойства данного вещества позволяют применять его для вулканизации каучука, в качестве фунгицида в сельском хозяйстве и даже лекарственного препарата (коллоидная сера). Кроме того, серу используют для производства спичек и пиротехнических составов, она входит в состав серобитумных композиций для изготовления сероасфальта.
Источник
