Какими свойствами обладает раствор серной кислоты

Молекула серной кислоты имеет крестовидную форму:
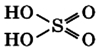
Физические свойства серной кислоты:
- плотная маслянистая жидкость без цвета и запаха;
- плотность 1,83 г/см3;
- температура плавления 10,3°C;
- температура кипения 296,2°C;
- очень гигроскопична, смешивается с водой в любых отношениях;
- при растворении концентрированной серной кислоты в воде происходит выделение большого кол-ва тепла (ВАЖНО! Приливают кислоту в воду! Воду в кислоту приливать нельзя!!!)
Серная кислота бывает двух видов:
- разбавленная H2SO4(разб) – водный раствор кислоты, в котором процентное содержание H2SO4 не превышает 70%;
- концентрированная H2SO4(конц) – водный раствор кислоты, в котором процентное содержание H2SO4 превышает 70%;
Химические свойства H2SO4
Серная кислота полностью диссоциирует в водных растворах в две ступени:
H2SO4 ↔ H++HSO4-
HSO4- ↔ H++SO4-
Разбавленная серная кислота проявляет все характерные свойства сильных кислот, вступая в реакции:
- с основными оксидами:
MgO+H2SO4 = MgSO4+H2O
- с основаниями:
H2SO4+2NaOH = Na2SO4+2H2O
- с солями:
H2SO4+BaCl2 = BaSO4↓+2HCl
качественная реакция на сульфат-ион:
SO42-+Ba2+ = BaSO4↓
В окислительно-восстановительных реакциях серная кислота выступает в роли окислителя, при этом, в разбавленной H2SO4 роль окислителей играют катионы водорода (H+), а в концентрированной – сульфат-ионы (SO42-) (более сильные окислители, чем катионы водорода).
- разбавленная серная кислота:
H2+1S+6O4-2
окислитель H+: 2H++2e- → H20↑ - концентрированная серная кислота:
H2+1S+6O4-2
окислитель S+6:- S+6+2e- → S+4 (SO2)
- S+6+6e- → S0 (S)
- S+6+8e- → S-2 (H2S)
Разбавленная серная кислота реагирует с металлами, стоящими в электрохимическом ряду напряжений левее водорода (реакция проходит с образованием сульфатов и выделением водорода):
H2SO4(разб)+Fe = FeSO4+H2↑

С металлами, стоящими правее водорода (медь, серебро, ртуть, золото), разбавленная серная кислота не реагирует.
Концентрированная серная кислота является более сильным окислителем, особенно это проявляется при нагревании. Концентрированная серная кислота не реагирует только с золотом, с остальными металлами, стоящими правее водорода, кислота взаимодействует с образованием сульфатов и сернистого газа. Более активными металлами (цинк, алюминий, магний) концентрированная серная кислота восстанавливается до свободной серы или сероводорода.
С остальными металлами серная кислота взаимодействует с образованием сернистого газа, серы или сероводорода (конкретный продукт восстановления серной кислоты зависит от ее концентрации):
2H2SO4(конц)+Cu = CuSO4+SO2↑+2H2O
5H2SO4(конц)+4Mg = 4MgSO4+H2S↑+4H2O
4H2SO4(конц)+3Zn = 3ZnSO4+S↓+4H2O
Концентрированная серная кислота окисляет некоторые неметаллы, восстанавливаясь до сернистого газа:
2H2S+6O4(конц)+S0 = 3SO2↑+2H2O
2H2S+6O4(конц)+C = C+4O2↑+2S+4O2↑+2H2O
При низких температурах концентрированная серная кислота пассивирует некоторые металлы (железо, алюминий, никель, хром, титан), что дает возможность ее промышленной перевозки в железных цистернах.
Подробнее см. Уравнения окислительно-восстановительных реакций серной кислоты…
Получение и применение серной кислоты
Серную кислоту в промышленности получают двумя способами: контактным и нитрозным.
Контактный способ получения H2SO4:
- На первом этапе получают сернистый газ путем обжига серного колчедана:
4FeS2+11O2 = 2Fe2O3+8SO2↑
- На втором этапе, сернистый газ окисляют кислородом воздуха до серного ангидрида, реакция идет в присутствии оксида ванадия, играющего роль катализатора:
2SO2+O2 = 2SO3
- На третьем, последнем этапе, получают олеум, для этого серный ангидрид растворяют в концентрированной серной кислоте:
H2SO4+nSO3 ↔ H2SO4·nSO3
- В дальнейшем олеум транспортируется в железных цистернах, а серная кислота получается из олеума разбавлением водой:
H2SO4·nSO3+H2O → H2SO4
Нитрозный способ получения H2SO4:
- На первом этапе очищенный от пыли сернистый газ обрабатывается серной кислотой, в которой растворена нитроза (оксид азота):
SO2+H2O+N2O3 = H2SO4+2NO↑
- Выделившийся оксид азота окисляется кислородом и снова поглощается серной кислотой:
2NO+O2 = 2NO2
NO2+NO = N2O3
Применение серной кислоты:
- для осушки газов;
- в производстве других кислот, солей, щелочей и проч.;
- для получения удобрений, красителей, моющих средств;
- в органическом синтезе;
- в производстве органических веществ.
Соли серной кислоты
Поскольку серная кислота является двухосновной кислотой, она дает два вида солей: средние соли (сульфаты) и кислые соли (гидросульфаты).
Сульфаты хорошо растворяются в воде, исключение составляют CaSO4, PbSO4, BaSO4 – первые два плохо растворяются, а сульфат бария практически нерастворим. Сульфаты, в состав которых входит вода, называются купоросами (медный купорос – CuSO4·5H2O).
Отличительной особенностью солей серной кислоты является их отношение к нагреванию, например, сульфаты натрия, калия, бария устойчивы к нагреванию, не разлагаясь даже при 1000°C, в то же время, сульфаты меди, алюминия, железа разлагаются даже при незначительном нагревании с образованием оксида металла и серного ангидрида: CuSO4 = CuO+SO3.
Горькая (MgSO4·7H2O) и глауберова (Na2SO4·10H2O) соль используются в качестве слабительного средства. Сульфат кальция (CaSO4·2H2O) – при изготовлении гипсовых повязок.
Источник
10 октября 2013
Автор КакПросто!
Серная кислота имеет химическую формулу H2SO4. Это тяжелая маслянистая жидкость, бесцветная или с желтоватым оттенком, который ей придают примеси ионов металлов, например, железа.
Серная кислота очень гигроскопична, легко поглощает водяные пары. Хорошо смешивается с водой, образуя растворы любой концентрации. Серная кислота – одно из важнейших химических соединений, находящее самое широкое применение в разных отраслях производства.
Серная кислота – «кровь химии»
Эта кислота известна со времен Средневековья. По имеющимся сведениям, впервые ее получил арабский алхимик Ар-Рази в IX веке, который прокаливал смесь железного и медного купороса.
С XIX века получили широкое распространение два основных способа получения серной кислоты: камерный и контактный. Объемы производства этого вещества непрерывно росли. Серная кислота широко используется при получении различных синтетических материалов, минеральных удобрений, красителей, лекарственных средств, взрывчатых веществ. Без нее невозможно представить современное текстильное, кожевенное, металлообрабатывающее производство. Поэтому серную кислоту по праву называют «кровью химии».
Свойства раствора серной кислоты
Концентрированная серная кислота практически не содержащая воды, имеет плотность около 2 грамм/см3. Она может смешиваться с водой в любых соотношениях. Легко понять, что чем менее концентрированный раствор, тем ближе будет его плотность к плотности воды, то есть к 1 грамму/см3.
При смешивании кислоты с водой необходимо лить кислоту в воду тонкой струйкой, постоянно перемешивая. Ни в коем случае нельзя лить воду в кислоту!
Раствор серной кислоты реагирует с металлами, находящимися в электрохимическом ряду напряжений слева от водорода. При этом образуется соль (сульфат) и выделяется водород. Например: 2К + H2SO4 = K2SO4 + H2.
При взаимодействии раствора серной кислоты с раствором щелочи происходит реакция нейтрализации, с образованием соли (сульфата) и воды. Например: Ca(OH)2 + H2SO4 = CaSO4 + 2H2O.
Раствор серной кислоты реагирует с солями, образованными более слабыми кислотами. Например, если воздействовать серной кислотой на кусочки мела или известняка, тут же пойдет реакция с бурным образованием мелких пузырьков. Она протекает по такой формуле: H2SO4 + CaCO3 = H2CO3 + CaSO4.
Образовавшаяся угольная кислота очень нестойкая и практически мгновенно разлагается на воду и углекислый газ. Выделение углекислого газа и приводит к образованию пузырьков.
Раствор серной кислоты также широко используется в свинцовых аккумуляторах. Раствор также применяют при лечении рака. Эффективна кислота и против геморроя. Однако лечение следует проводить только после консультации со специалистом. Серную кислоту можно найти в продаже.
Статьи медицинского характера на Сайте предоставляются исключительно в качестве справочных материалов и не считаются достаточной консультацией, диагностикой или назначенным врачом методом лечения. Контент Сайта не заменяет профессиональную медицинскую консультацию, осмотр врача, диагностику или лечение. Информация на Сайте не предназначена для самостоятельной постановки диагноза, назначения медикаментозного или иного лечения. При любых обстоятельствах Администрация или авторы указанных материалов не несут ответственности за любые убытки, возникшие у Пользователей в результате использования таких материалов.
Источник
- Характеристика
- Классификация
- Технологии получения
- Контактный метод
- Нитрозный метод
- В каких отраслях находит применение
- Соли серной кислоты и область их применения
- История изучения
- Производство в России
- Особенности транспортировки
- Вред для человеческого здоровья
- Признаки отравления
- Первая помощь и лечение
- Интересные факты о серной кислоте
Серная кислота – смертельный и токсичный реагент, без которого в то же время не существовало бы большое количество лечебных препаратов, удобрений, химической продукции и средств очищения нефтепродуктов. Он представляет собой вязкую субстанцию, у которой отсутствуют запах и цвет, однако вкус описывается как «медный». Легко взаимодействует с водой независимо от пропорций. Из-за широкой направленности применения во многих областях именуется «кровью химии».
Характеристика

Обладает сильными свойствами и считается мощным окислителем. Поскольку на один моль SO3 приходится один моль Н2О, её принято относить к моногидратам. Она образовывает кислые (бисульфаты) и средние (сульфаты) соли. Для усиления действия и преобразования кислоты в двухосновную, в результате чего она получит два атома водорода, потребуется взаимодействие с водным раствором. А при реакции с простой водой в больших объёмах начнёт выделяться тепло.
Основное свойство H2SO4 – гигроскопичность, поэтому её часто используют для поглощения влаги из воздуха. В течение этого процесса также происходит выделение тепла. Температура кипения зависит от степени насыщенности. При 98%-ой концентрации, достигается максимум, который составляет 330 °C, при этом возникает распад на H2O и SO3. Температура плавления – 10,38 °C, плотность – 1,84 г/см3.
Состояние жидкости влияет на то, как она изменяет другие элементы при взаимодействии с ними. Все металлы, стоящие в электрохимическом ряду активности, включая серебро, поддаются окислению при 100%-ой концентрации. Разбавленная H2SO4 окисляет все металлы, находящиеся в электрохимическом ряду активности левее водорода, однако платина и золото не состоят в этом списке.
Наблюдаются изменения при взаимодействии с органическими соединениями и неметаллами, итогом которого становится преобразование некоторых из них в уголь. H2SO4 способна растворять SO3, образуя олеум.
Классификация
H2SO4 выше 40% называется концентрированной. Она известна как сильный окислитель и при контакте с серебром или палладием растворяет их. Во время нагревания демонстрирует окислительно-восстановительные качества. Концентрация разбавленных растворов не превышает 40%. Они отличаются меньшей активностью и способны взаимодействовать с медью и латунью.
Чтобы преобразовать концентрированную смесь в разбавленную, более тяжёлую жидкость нужно смешать с H2O. Важно добавлять именно кислоту в воду, соблюдая осторожность. Если сделать наоборот, образуется кипение и токсикологические брызги.
Технологии получения

Когда люди только начали самостоятельно обрабатывать купоросное масло, масштаб его потребления не превышал десятки литров. В настоящее время промышленные предприятия каждый год выпускают и потребляют несколько миллионов тонн этого продукта. Мировыми лидерами в современном мире являются Китай (60 млн т) и США (30 млн т).
Традиционными методами, используемыми в промышленности, выступают контактный и нитрозный.
Контактный метод
Широко применяется во многих государствах. Его популярность обеспечивают следующие преимущества:
- Соответствие всем заявленным характеристикам, за счёт чего удовлетворяются требования потребителей.
- Почти не наносит ущерба окружающей среде.
Основу представляет такое сырьё, как:
- Пирит (колчедан).
- Сера.
- Оксид ванадия (катализатор).
- Сероводород.
- Сульфиды различных металлов.
Прежде чем приступить к работе, сырьё подвергают обработке. Пирит измельчается через устройства для дробления. За счёт измельчения рабочие добиваются увеличения скорости реакции, поскольку площадь соприкосновения частиц становится больше.
На следующей стадии колчедан очищают, погружая в чаны с водой и перемешивая. Пустая порода, земля и ненужные примеси поднимаются на поверхность, и их становится легче удалить. Работа проходит через несколько фаз:
- Колчедан отправляется в печь и обжигается при 800 °C не более. В этот момент сырьё пребывает в подвешенном состоянии, поэтому снизу в камеру поступает воздух. На этом этапе выделяются водяные пары, О2 и SO2, лишние отходы уничтожаются.
- Ванадиевый катализатор способствует выделению тепла. Процесс сопровождается давлением на компоненты. На этом шаге температура равняется 420°C – 550°C. Происходит каталитическое окисление, и диоксид серы преобразуется в ангидрид серной кислоты.
- В поглотительной башне ангидрит поглощается, затем появляется олеум H2SO4, которую разливают в особые ёмкости.
В течение всей работы выделяется много тепла, которое принято использовать в качестве вспомогательного источника энергии. Стоит отметить, что эта технология подразумевает производство, не оставляющее отходов.
Нитрозный метод
Нитрозная технология бывает двух видов: камерная и башенная. Преимущества данного подхода состоят в том, что он не требует больших денежных затрат или сложного технологичного оборудования, а также гарантирует переработку диоксида серы.
Но имеются и минусы. В конечном итоге производитель получает 75%-ую концентрацию, которая заметно уступает по качеству тому, что выходит при контактном способе. В составе наблюдается содержание оксида азота, железа и иных примесей. Возврат оксидов азота осуществляется не полностью. Нитрозный способ вреден для экологии, поскольку допускает значительные выбросы токсинов в атмосферу. Тем не менее, этот подход всё равно остаётся довольно-таки популярным.
Исходный материал – сернистый газ. Его преобразование в H2SО4 осуществляется в процессе окислительной реакции с двуокисью серы и присоединения воды. Нитрозная техника не обходится без добавления окислов азота, поскольку двуокись серы не вступает в прямой контакт с кислородом. В течение данного процесса высшие окислы азота превращаются в окись азота NO. Позднее окись азота NO снов окисляется кислородом, преобразуясь в высшие окислы.
В каких отраслях находит применение
Ежегодно человечество потребляет около 200 миллионов тонн, в большинстве случаев для выпуска продукции химического происхождения и в сельском хозяйстве. Сегодня H2SO4 применяют для получения:
- Минеральных удобрений, для этого она берётся в чистом 100%-ом виде.
- Дымообразующих и взрывчатых веществ.
- Медикаментозных средств.
- Органических и неорганических соединений.
- Красок.
- Ненатуральных изделий.
Помимо этого она помогает эффективно удалять окалину и ржавчину. Восстанавливает алюминий при изготовлении цветных металлов. Её наносят на металлические поверхности перед покрытием медью или хромом, удаляют нежелательные частицы и примеси из нефтепродуктов и обрабатывают скважины. Компонент приносит пользу, если возникает необходимость повысить детонационную стойкость бензина и моторных масел.
Это далеко не все области применения. Вещество выполняет функции эмульгатора при приготовлении пищевой продукции, помогает эффективно устранять отходы в воде. Считается действительно необходимым компонентом в индустрии, замену которой трудно найти. Говоря об этом продукте, Дмитрий Менделеев отмечал, как часто к его помощи прибегают в техническом производстве, и что без него невозможно и невыгодно заниматься приготовлением других веществ.
Соли серной кислоты и область их применения
Существует семь типов соединений, играющих ключевую роль в индустрии:
- 10-ти водный сульфат натрия – элемент, содержащийся в соде, слабительных порошках, также он распространён в медицине и ветеринарии.
- В фирмах по изготовлению резины, белой минеральной краски или бумаги пользуются сульфатом бария. Он также добавляется «бариеву кашу», которая применяется в медицинской практике для рентгеновского просвечивания желудка.
- В медицине необходим и сульфат кальция, который в природных условиях встречается в форме гипса и ангидрита. В частности в травматологических отделениях накладывают фиксирующие повязки из алебастра. Также сульфат кальция входит в состав строительных материалов.
- Железный купорос используется в создании чернил, пропитки дерева или изготовлении средств для борьбы с вредителями, что важно для ведения сельского хозяйства.
- Другая необходимая для сельского хозяйства соль – медный купорос. Он оперативно борется с паразитами и лечит заболевания растений. Помимо этого он ценится при получении минеральных пигментов или при удалении плесневых грибов со стен.
- Сульфат алюминия – один из компонентов, содержащихся в бумаге, картоне, целлюлозе и т.д.
- Для создания красок и при обработке кожи животных применяются квасцы.
В ряде случаев субстанция выполняет функции электролита в свинцово-кислотных аккумуляторах для проведения электрического тока. Для этого в аккумулятор заливают раствор в дистилляте. Чаще спросом пользуется олеум, обладающий высокой интенсивностью. Его особенность заключается в отсутствие реакции при соприкосновении со сталью, кроме того, его легко перевозить.
История изучения
Начало исследований было заложено ещё в Древней Греции, когда учёные заинтересовались происхождением медного купороса и его особенностями. Купорос находил применение как в медицинской практике, так и в металлургии. Первые достижения датируются XIII веком. Согласно записям алхимиков того периода для этого прибегли к нагреванию алюмокалиевых квасцов. Изучив природу квасцов, в XV веке учёные смогли приступить к следующей стадии опытов. Чуть позже, во времена Средневековья в Европе, вещество было известно как «купоросное масло», однако название было изменено на привычную современным людям “кислоту”.
На территории Руси масло появилось в 1600-х годах, чаще всего его ввозили торговцы из-за рубежа. В тот же временной период Иоганном Глаубером был изобретён совершенно иной подход к работе с материалами. Добиться желаемого Глауберу удалось в результате горения нитрата калия и самородной серы в присутствии водных паров. Аналогичный метод был также использован в первой половине 1700-х годов лондонским аптекарем Уордом Джошуа, который решил производить масло в больших масштабах. В то время в H2SО4 нуждались алхимики, фармацевты и специалисты по отделке редких металлов. В небольших объёмах её использовали для изготовления специальных спичек с содержанием хлората калия. .
Следом за Джошуа к производству приступил Джон Робак из Англии, несколько адаптировав технику. Вместо стеклянных резервуаров он взял освинцованные камеры крупного размера, поскольку они были дешевле. Нововведения Робака позволяли получить 65%-ный раствор. Приёмы англичанина сохраняли популярность в течение двухсот лет. 78%-ая концентрация появилась благодаря химикам из Англии и Франции Гловеру и Гей-Люссаку. В отличие от прошлого варианта этот оказался неподходящим для создания красителей.
Новые техники были разработаны в начале XIX века. На первых порах для этого брали азот, такой способ вскоре стал именоваться «нитрозным». Также для быстрого протекания реакции обращались к платине. Только в тридцатые годы XIX века Перегрином Филипсом был запатентован экономичный путь обработки оксида серы (VI) и концентрированного раствора. А в 1864 году был запущен выпуск природных фосфорных удобрений.
К концу 1800-х годов европейские страны наладили выпуск продукции в количестве до одного миллиона тонн, а лидирующие позиции в поставке заняли Англия и Германия. На их долю приходился 71% от общего объёма. В России корпорации подобного рода открылись после 1805 года в Москве.
Производство в России

Каждый год российские промышленные комбинаты вырабатывают около 10 миллионов тонн. Заводы, работающие в этом направлении, как правило, сами же и выступают в роли постоянных потребителей. К ним относятся компании, главным изделием которых выступают природные удобрения. Преимущественно на отечественном рынке занимаются выработкой следующих видов серной кислоты:
- аккумуляторная;
- отработанная;
- техническая;
- продукт особой чистоты;
- олеум.
Среди крупнейших отечественных поставщиков можно выделить ОХК Щекиноазот, Славия, Святогор, Компонент-Реактив, ЗСС, Карабашмедь и другие. Особую роль играют горные предприятия, обрабатывающие твёрдые полезные ископаемые, поскольку они поставляют на рынок пирит. В России сырьё предоставляют Норильская и Талнахская обогатительные комбинаты.
Особенности транспортировки
При транзите следует соблюдать осторожность из-за резких ядовитых свойств продукта. Он взрывоопасен и относится к восьмому классу опасности, который включает ядовитые и коррозионные грузы. Допущение перевозчиком грубых ошибок при транспортировке, ставит под угрозу не только людей, но и экологию.
Перевозка происходит при соблюдении правил, гарантирующих безопасность населения. Требуется подобрать устойчивую ёмкость для транзита. Цистерны должны быть изготовлены из сплавов, которые не разрушатся под воздействием ядов. Для перевозки опасных токсинов подойдут сернокислотные химические резервуары. При необходимости поддерживать температуру, как с дымящейся жидкостью, подбираются цистерны-термосы. Для обычного груза подойдёт сернокислотная канистра.
Транспортировка допускается лишь на автомобилях со специальной маркировкой, предупреждающей об опасном грузе. Перевозить цистерны имеют право водители, получившие свидетельство АДР, подтверждающее их компетентность. Они не ограничены во времени при перевозке, поскольку обязаны соблюдать скоростной режим для исключения возможности попадания в аварию. Чтобы избежать ситуаций, создающих угрозу жизни населения, водитель должен ехать по специально-разработанному маршруту, исключающему места большого скопления людей и производственные объекты.
Вред для человеческого здоровья
Токсичная жидкость угрожает здоровью человека не только из-за риска попадания капель на кожные ткани, она может нанести вред внутренним органам поскольку в её состав входит не менее едкий сернистый газ. Ей характерна чрезвычайная агрессивность, а входящий в состав мышьяк усиливает признаки отравления. Безвредной дозой содержания H2SО4 в воздухе считается 0,3 мг на 1 кв. м.
При неосторожном обращении могут пострадать кожа, дыхательная система и слизистые оболочки. Нередко появляются бронхит, ларингит и трахеит. Полученные ожоги имеют ярко-выраженную симптоматику и долго заживают. Если своевременно не обратиться к врачу, поражение тканей может привести к смерти пострадавшего. Опасная доза, угрожающая жизни – 0,18 см на 1 лит, при попадании внутрь – 5 миллиграммов.
Признаки отравления
Попадание внутрь нескольких капель или ядовитых паров в дыхательные пути может привести к ужасным последствиям. Вовремя распознав проявление отравления организма, человек спасёт себе жизнь. На интоксикацию указывают следующие симптомы:
- тошнота и рвота;
- болезненные ощущения в органах пищеварения;
- расстройства кишечника;
- проблемы со стулом;
- изменение цвета мочи на красный;
- появление бурых пятен на дёснах;
- чрезмерное слюноотделение;
- ожог слизистой глаз;
- повреждение дыхательных путей;
- кровотечение из носа;
- отёк горла и гортани, охриплость;
- посинение кожных покровов.
Отёк горла и гортани опасный симптом, указывающий на значительное ухудшение самочувствия пострадавшего. Он сопровождается удушьем, которое приводит к летальному исходу.
Первая помощь и лечение
При контакте с серной кислотой важно в первую очередь вызвать скорую помощь. До того как приедут врачи, пострадавший может самостоятельно облегчить своё состояние. Если химический продукт попал внутрь, нужно промыть желудок тёплой водой, а затем выпить 100 г оливкового или подсолнечного масла маленькими глотками. Для большей пользы можно проглотить немного льда или выпить молока. Это поможет снизить содержание H2SО4.
Если жидкость попала на слизистую оболочку глаз, необходимо промыть их проточной водой. До прибытия скорой помощи в глаза следует закапать раствор новокаина и дикаина. При отравлении парами постращавшему требуется срочно выйти на свежий воздух и промыть слизистые оболочки водой. Чтобы уменьшить площадь повреждения тканей, обожжённый участок кожи нужно промыть проточной водой и приложить повязку с содой.
Желательно проходить лечение в стационарных условиях, оставаясь под наблюдением врачей. Время на восстановление организма зависит от того, насколько сильно поражены кожные кожные покровы или органы. Как правило, лечение осуществляется с помощью антибиотиков, а в качестве обезболивающего назначается новокаин. .
Если у больного наблюдается желудочное кровотечение, ему необходимо переливание крови и также введение плазмы. В ряде случаев при кровотечении может понадобиться хирургическое вмешательство.
Интересные факты о серной кислоте
Хотя сегодня принято изготавливать серную кислоту на специальных предприятиях, она всё же встречается в природе, причём в 100%-ом виде. Например, в Италии на острове Сицилия можно увидеть, как со дна Мёртвого моря просачивается H2SО4. Это место принято называть Озером смерти, живые существа стараются не подходить слишком близко к нему. Выделение серной кислоты со дна происходит из-за содержания в земной коре пирита.
Серная кислота может выделяться и при сильных извержениях вулкана. Такие явления достаточно опасны для людей и окружающей среды. Одними из последствий попадания H2SО4 в атмосферу могут стать климатические изменения. Серная кислота считается главной причиной, по которой выпадают кислотные дожди, а выделяется она из-за попадания в воздух диоксида серы.
Как уже было ранее замечено, серная кислота эффективно поглощает воду из воздуха. Это качество позволяет использовать её для осушения газов. Раньше было принято наливать жидкость в небольшие ёмкости и оставлять между стёклами. Это помогало предотвратить запотевание окон в комнате.
Источник
