Какими свойствами обладает ph3
Фосфин — это ядовитый газ, который в чистом виде не имеет цвета и запаха. С химической точки зрения, является летучим водородным соединениям фосфора. В химии формула фосфина имеет вид — PH3. По своим свойствам имеет некоторые схожести с аммиаком. Вещество очень опасно, так как имеет высокую токсичность и склонность к самовоспламенению.
Получение
Самый хорошо изученный способ получения фосфина — это реакция взаимодействия белого фосфора с раствором сильной щелочи при нагревании. В данном случае фосфор диспропорционирует на метафосфат и фосфин. Побочными продуктами этой реакции является дифосфин (P2H4) и водород, поэтому выход данной реакции небольшой и составляет не более 40 %.
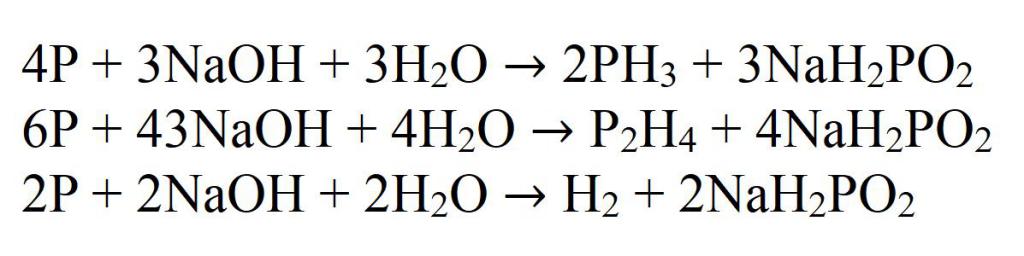
Образующийся дифосфин в реакционной среде вступает во взаимодействие со щелочью, в результате чего образуется фосфин и водород.
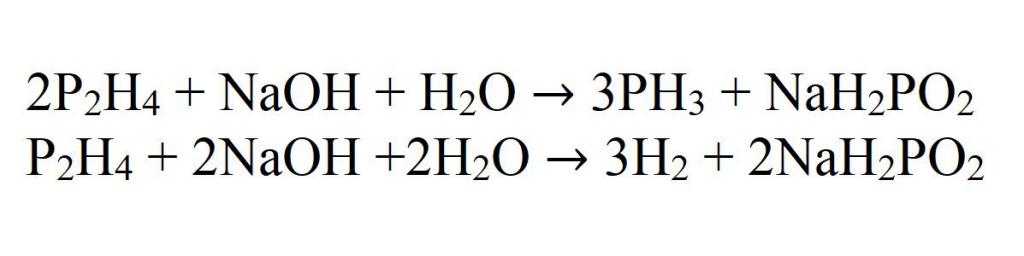
А полученный в этих реакциях гипофосфит, при взаимодействии со щелочью, переходит в фосфат с выделением водорода.
NaH2PO2 + 2NaOH = 2H2 + Na3PO4
После завершения всех реакций, в результате взаимодействия щелочи на фосфор образуется фосфин, водород и фосфат. Данный способ получения можно также провести со щелочными оксидами вместо щелочей. Этот опыт является очень красивым, так как образующийся дифосфин сразу же воспламеняется и сгорает в виде искр, образуя нечто похожее на фейерверк.
При воздействии воды или кислоты на фосфиды металлов также получается фосфин.
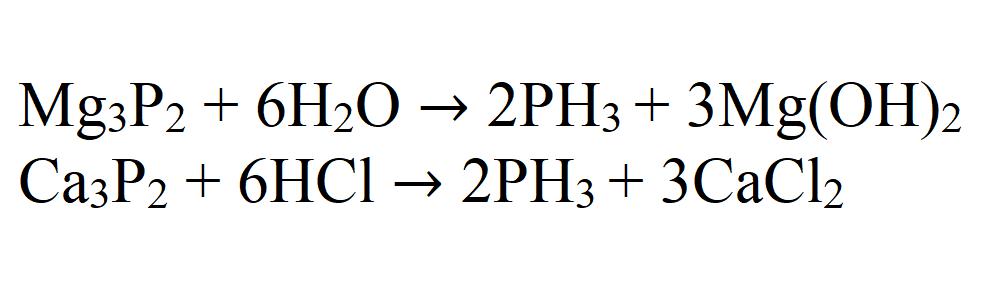
При термическом разложении фосфористой кислоты или ее восстановлении водородом в момент выделения также образуется фосфин.
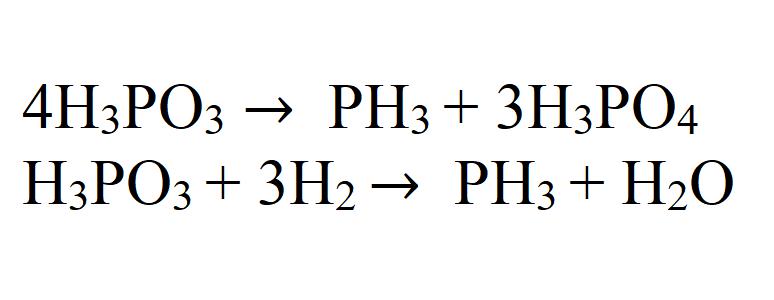
Соли фосфония при разложении или в реакции с некоторыми веществами дают фосфин.
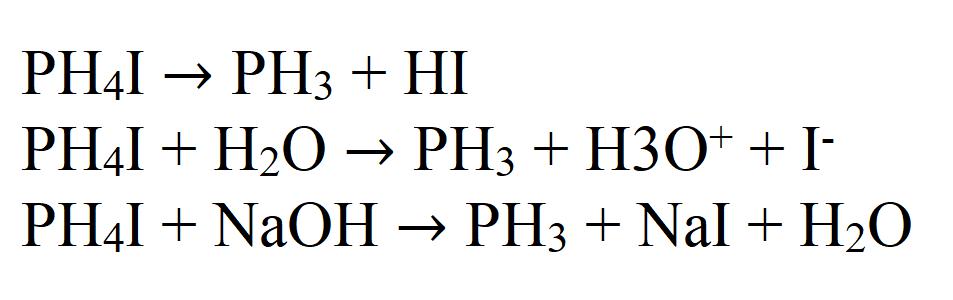
Физические свойства
Фосфин представляет собой бесцветный газ без запаха. Но технический фосфин (с некоторыми примесями) может иметь характерный неприятный запах, который описывают по-разному. Немного тяжелее воздуха, при температуре -87,42 °C сжижается, а при -133,8 °C становится твердым веществом. Такие низкие температуры кипения и плавления обусловлены довольно слабыми водородными связями. Вещество практически нерастворимо в воде, но при определенных условиях образует с водой неустойчивые гидраты. Хорошо растворим в этаноле и диэтиловом эфире. Плотность фосфина при нормальных условиях составляет 0,00153 г/см3.
Химические свойства
Как уже было сказано, химическая формула фосфина – PH3. Хоть фосфин и похож на аммиак, он имеет ряд отличий во взаимодействиях с другими веществами. Эти особенности обусловлены тем, что химические связи в фосфине (по формуле это становится ясно) ковалентные слабополярные. Они менее полярные, чем в аммиаке, и поэтому более прочные.
При сильном нагревании (примерно 450 °C) без доступа кислорода фосфин разлагается на простые вещества.
2PH3 → 2P + 3H2
При температуре свыше 100 °C PH3 самовоспламеняется, вступая в реакцию с кислородом воздуха. Температурный порог можно снизить ультрафиолетовым светом. По этой причине, выделяющийся на болотах фосфин, часто самовоспламеняется, вызывая появление так называемых «блуждающих огней».
PH3 + 2O2 → H3PO4
Но может происходить и простое горение. Тогда образуется фосфорный ангидрид и вода.
2PH3 + 4O2 → P2O5 + 3H2O
Как и аммиак, фосфин может образовывать соли, взаимодействуя с галогеноводородами.
PH3 + HI→ PH4I
PH3 + HCl→ PH4Cl
Исходя из формулы фосфина, можно сказать, что фосфор в нем имеет низшую степень окисления. По этой причине он является хорошим восстановителем.
PH3 + 2I2+ 2H2O → H3PO2 + 4HI
PH3 + 8HNO3→ H3PO4 + 8NO2 + 4H2O
Применение
Ввиду своей высокой токсичности, фосфин нашел применение в фумигации, т. е. уничтожении различного рода вредителей (насекомых, грызунов) при помощи газа. Для этих процедур существуют специальные устройства — машины-фумигаторы, с использованием которых распыляют газ в помещениях. Обычно фосфином или препаратами на его основе обрабатывают склады зерновых культур, готовых пищевых продуктов, мебели, а также библиотеки, заводские помещения, вагоны поездов и другой транспорт. Преимущество такой обработки в том, что фосфин даже в небольших концентрациях легко проникает в труднодоступные места и никак не взаимодействует с металлами, древесиной и тканью.
Помещение обрабатывают фосфином, в герметичном состоянии его держат в течение 5-7 суток. После этого не менее двух суток нужно осуществлять проветривание, иначе находится человеку в нем опасно. После этого фосфин не оставляет никаких следов даже на продуктах, зерне и других товарах.
Еще фосфин используется в синтезе некоторых веществ, особенно органических. Также из него может получаться химически чистый фосфор, с использованием фосфина производят легирование полупроводников.
Токсикология
Фосфин крайне токсичное соединение. Он быстро проходит через дыхательные пути и взаимодействует со слизистыми оболочками организма. Это может вызвать нарушения работы нервной системы, а также обмена веществ в целом. Признаками отравления могут служить головокружение, тошнота, рвота, головная боль, усталость, иногда даже конвульсии. В тяжелых случаях отправления человек может потерять сознание или произойти остановка дыхания и сердцебиения. Предельно допустимая концентрация фосфина в воздухе — 0.1 мг/м3. Концентрация 10 мг/м3 сразу приводит к летальному исходу.
Первое, что необходимо сделать с пострадавшим от отравления фосфина, — вынести на свежий воздух и освободить от загрязненной одежды. Также рекомендуется окатить пострадавшего водой, чтобы быстрее убрать остатки токсичного газа. Стационарное лечение подразумевает использование кислородной маски, контроль сердечного ритма и состояния печени, лечение отека легких. За больным необходимо следить минимум 2-3 суток, даже если видимых признаков отравления уже нет. Некоторые симптомы могут проявляться лишь через несколько суток после контакта с фосфином.
Источник
Фосфор
Следующий за азотом элемент пятой группы, фосфор, был открыт на несколько столетий раньше своего предшественника по подгруппе. По иронии судьбы фосфор открывали несколько раз, причём всякий раз получали его из мочи. Есть упоминания о том, что арабский алхимик Альхильд Бехиль открыл фосфор при перегонке мочи в смеси с глиной, известью и углём. Однако достоверное открытие и описание свойств этого вещества принадлежит немецкому алхимику-любителю Хеннигу Бранду. В 1669 г. Бранд был занят поиском магической жидкости, с помощью которой можно превращать неблагородные металлы в золото. В одном из экспериментов он пытался получить ее из большого количества мочи, предварительно собранной в солдатских казармах. При её нагревании Бранду удалось выделить тяжелое красное масло, которое перегонялось с образованием твёрдого остатка. Нагревая последний без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившегося в темноте. Бранд и назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».
 Красный фосфор
Красный фосфор
Несколько лет «рецепт приготовления» фосфора хранился в строжайшей тайне и был известен лишь нескольким алхимикам. В 1680 г. это вещество независимо от Бранда выделил Р.Бойль.
В несколько модифицированном виде старинный метод получения фосфора использовали и в XVIII столетии: нагреванию подвергались смесь мочи с оксидом свинца, поваренной солью, поташом и углем. Лишь в 1774 г. К. В. Шееле разработал способ получения фосфора из рога и костей животных.
В наши дни фосфор производят в электрических печах, восстанавливая апатит углём в присутствии кремнезёма:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO↑ + P2↑
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р4.
При конденсации паров образуется белый (желтый) фосфор, который состоит из молекул Р4, имеющих форму тетраэдра. Это очень реакционноспособное мягкое воскообразное вещество бледно-желтого цвета, растворимое в сероуглероде и бензоле. На воздухе фосфор воспламеняется при 34 оС. Он обладает уникальной способностью светиться в темноте за счет медленного окисления до низших оксидов. Именно белый фосфор и был в своё время выделен Брандом.
Если белый фосфор нагревать без доступа воздуха, он переходит в красный (впервые его получили лишь в 1847 г.). Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске: она колеблется от оранжевой до тёмно-красной и даже фиолетовой. Все разновидности красного фосфора нерастворимы в органических растворителях, по сравнению с белым фосфором они менее реакционноспособны (воспламеняются на воздухе при t>200 оС) и имеют полимерное строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи. Несколько отличен от них «фиолетовый фосфор», который состоит из группировок Р8 и Р9, уложенных в длинные трубчатые структуры с пятиугольным сечением.
При повышенном давлении белый фосфор переходит в чёрный фосфор, построенный из объёмных шестиугольников с атомами фосфора в вершинах, связанных друг с другом в слои. Впервые это превращение осуществил в 1934 г. американский физик Перси Уильямс Бриджмен. Структура чёрного фосфора напоминает графит, с той лишь разницей, что слои, образованные атомами фосфора, не плоские, а «гофрированные». Черный фосфор – это наименее активная модификация фосфора. При нагревании без доступа воздуха он, как и красный, переходит в пар, из которого конденсируется белый фосфор.
Белый фосфор очень ядовит: смертельная доза около 0,1 г. Из-за опасности самовоспламенения на воздухе его хранят под слоем воды. Красный и чёрный фосфор менее ядовиты, так как нелетучи и практически нерастворимы в воде.
 Аллотропные модификации фосфора
Аллотропные модификации фосфора
Химические свойства
Наиболее химически активным является белый фосфор (в уравнениях реакций с участием белого фосфора для простоты записывают как Р, а не Р4, тем более, что аналогичные реакции возможны и с участием красного фосфора, молекулярный состав которого неопределен). Фосфор непосредственно соединяется со многими простыми и сложными веществами. В химических реакциях фосфор, как и азот, может быть и окислителем, и восстановителем.
Как окислитель фосфор взаимодействует со многими металлами с образованием фосфидов, например:
2P + 3Ca = Ca3P2
P + 3Na = Na3P
Обратите внимание, что непосредственно с водородом фосфор практически не соединяется.
Как восстановитель фосфор взаимодействует с кислородом, галогенами, серой (т.е. с более электроотрицательными неметаллами). При этом в зависимости от условий проведения реакций могут образовываться как соединения фосфора (III), так и соединения фосфора (V).
а) при медленном окислении или при недостатке кислорода фосфор окисляется до оксида фосфора (III), или фосфористого ангидрида Р2О3:
4Р + 3О2 = 2Р2О3
При сгорании фосфора в избытке кислорода (или воздуха) образуется оксид фосфора (V), или фосфорный ангидрид Р2О5:
4Р + 5О2 = 2Р2О5
б) в зависимости от соотношения реагентов при взаимодействии фосфора с галогенами и серой образуются соответственно галогениды и сульфиды трех- и пятивалентного фосфора; например:
2Р + 5Cl2(изб.) = 2PCl5
2P + 3Cl2(недост.) = 2PCl3
2P + 5S(изб.) = P2S5
2P + 3S(недост.) = P2S3
Следует отметить, что с йодом фосфор образует только соединение PI3.
Роль восстановителя фосфор играет в реакциях с кислотами-окислителями:
— с разбавленной азотной кислотой:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑
— с концентрированной азотной кислотой:
P + 5HNO3 = H3PO4 + 5NO2↑ + H2O
— с концентрированной серной кислотой:
2P + 5H2SO4 = 2H3PO4 + 5SO2↑ + 2H2O
С другими кислотами фосфор не взаимодействует.
При нагревании с водными растворами щелочей фосфор подвергается диспропорционированию, например:
4P + 3KOH + 3H2O = PH3↑ + 3KH2PO2
8P + 3Ba(OH)2 + 6H2O = 2PH3↑ + 3Ba(H2PO2)2
Кроме фосфина РН3 в результате этих реакций образуются соли фосфорноватистой кислоты Н3РО2 – гипофосфиты, в которых фосфор имеет характерную степень окисления +1.
Применение фосфора
Основная часть производимого в мире фосфора расходуется на производство фосфорной кислоты, из которой получают удобрения и другие продукты. Красный фосфор используется при изготовлении спичек, он содержится в массе, которая наносится на спичечную коробку.
Фосфин
Наиболее известным водородным соединением фосфора является фосфин РН3. Фосфин – бесцветный газ с чесночным запахом, очень ядовит. Хорошо растворимый в органических растворителях. В отличие от аммиака малорастворим в воде. Практического значения фосфин не имеет.
Получение
Выше был рассмотрен способ получения фосфина при взаимодействии фосфора с водными растворами щелочей. Другой способ – действие соляной кислоты на фосфиды металлов, например:
Zn3P2 + 6HCl = 2PH3↑ + 3ZnCl2
Химические свойства
- Кислотно – основные свойства
Будучи малорастворим в воде, фосфин образует с ней неустойчивый гидрат, который проявляет очень слабые основные свойства:
PH3 + H2O ⇄ PH3∙H2O ⇄ PH4+ + OH—
Соли фосфония образуются только с сильными кислотами:
PH3 + HCl = PH4Cl
PH3 + HClO4 = PH4ClO4
- Окислительно – восстановительные свойства
Как и азот в аммиаке, фосфор в молекуле фосфина имеет низшую степень окисления – 3. Однако для фосфора эта степень окисления менее устойчива, чем для азота, поэтому фосфин проявляет более ярко выраженные восстановительные свойства, чем аммиак. Так, фосфин при температуре около 150 оС самовоспламеняется на воздухе:
2PH3 + 4O2 = P2O5 + 3H2O
Фосфин восстанавливает соли некоторых малоактивных металлов до свободных металлов, например:
PH3 + 8AgNO3 + 4H2O = H3PO4 + 8Ag + 8HNO3
Скачать:
Скачать бесплатно реферат на тему: «Фосфор»
Фосфор.doc (72 Загрузки)
а также на тему: «Фосфор и его соединения»
Фосфор-и-его-соединения.doc (79 Загрузок)
Весь список рефератов можно посмотреть здесь
*на изображении записи фотография белого фосфора
Источник
Физические свойства
Бесцветный газ. Плохо растворяется в воде, не реагирует с ней. При низких температурах образует твердый клатрат 8РН3·46Н2О. Растворим в бензоле, диэтиловом эфире, сероуглероде. При −133,8 °C образует кристаллы с гранецентрированной кубической решёткой.
Молекула фосфина имеет форму тригональной пирамиды c молекулярной симметрией C3v (dPH = 0.142 нм, HPH = 93.5o). Дипольный момент составляет 0,58 D, существенно ниже, чем у аммиака. Водородная связь между молекулами PH3 практически не проявляется и поэтому фосфин имеет более низкие температуры плавления и кипения.
Получение
Фосфин получают при взаимодействии белого фосфора с горячей щёлочью, например:

Также его можно получить воздействием воды или кислот на фосфиды:


Возможен синтез непосредственно из элементов:[источник не указан 273 дня]

Хлористый водород при нагревании взаимодействует с белым фосфором:

Разложение йодида фосфония:



Разложение фосфоновой кистоты:

или её восстановление:

Химические свойства
Фосфин сильно отличается от его аналога аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H-P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:

на воздухе самопроизвольно воспламеняется (в присутствии паров дифосфина или при температуре свыше 100 °C):

Проявляет сильные восстановительные свойства:



При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.


Соли фосфина, как и сам фосфин, являются сильными восстановителями.
Токсичность
Фосфин сильно ядовит, действует на нервную систему, нарушает обмен веществ. ПДК = 0,1 мг/м³. Запах ощущается при концентрации 2-4 мг/м³, длительное вдыхание при концентрации 10 мг/м³ приводит к летальному исходу. В крови человека содержание фосфина не более 0,001 мг/м³.
Самовозгорание
Фосфин способен к самовозгоранию при контакте с кислородом воздуха. Может вызывать появление «блуждающих огней»[1][2].
Примечания
- ↑ Благодатный огонь — взгляд скептика
- ↑ Осторожно — фосфин!
Литература
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0
Категории:
- Соединения фосфора
- Гидриды
Wikimedia Foundation.
2010.
Синонимы:
Смотреть что такое “Фосфин” в других словарях:
ФОСФИН — (фосфористый водород гидрид фосфора), РН3, бесцветный газ с неприятным запахом, tкип 87,42 .С. Сильный восстановитель. Известен жидкий фосфин, называемый дифосфином Р2Н4, tкип 56 .С. Самопроизвольно воспламеняется на воздухе. Токсичен … Большой Энциклопедический словарь
ФОСФИН — ФОСФИН, фосфористый водород (РН3). Бесцветный высокотоксичный ГАЗ, получаемый в процессе реакции между фосфидом кальция и водой или разбавленной кислотой. Небольшие примеси дифосфина заставляют газ самопроизвольно воспламеняться. Чистый фосфин… … Научно-технический энциклопедический словарь
фосфин — сущ., кол во синонимов: 1 • газ (55) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
фосфин — а. м. phosphine f. Желтая анилиновая краска. 1889. Андреев Сл. тов … Исторический словарь галлицизмов русского языка
ФОСФИН — соединение (см.) с водородом (РН3), а также некоторые фосфороорганические соединения. Ф. бесцветный токсичный газ с неприятным запахом, сильный восстановитель. Известен жидкий Ф., называемый дифосфином(Р2Н4); tкип =56°С. Самопроизвольно… … Большая политехническая энциклопедия
фосфин — (фосфористый водород), РН3, бесцветный газ с неприятным запахом, tкип 87,42°C. Сильный восстановитель. Известен жидкий фосфин, называемый дифосфином Р2Н4, tкип 56°C. Самопроизвольно воспламеняется на воздухе. Токсичен. * * * ФОСФИН ФОСФИН… … Энциклопедический словарь
Фосфин — [phosphines] фосфористый водород (гидрид фосфора) РН3, бесцветный газ. γ = 1,55 г/л, tпл = 133,8 °С, tкип = 87,8 °С. На воздухе воспламеняется при 100 °С; образуется при получении фосфора восстановлением фосфоритов углеродом в производстве… … Энциклопедический словарь по металлургии
фосфин — fosfanas statusas T sritis chemija formulė PH₃ atitikmenys: angl. phosphane; phosphine rus. фосфан; фосфин … Chemijos terminų aiškinamasis žodynas
Фосфин — фосфористый водород, гидрид фосфора, PH3. Ф. – бесцветный газ с запахом гнилой рыбы; плотность 1,55 г/л, tпл – 133,8 °С, tкип – 87,8 °С, при 25 °С и 0,1 Мн/м2 (1 кгс/см2) 1 объём воды растворяет около 0,25 объёма PH3. При нагревании… … Большая советская энциклопедия
Фосфин — (хризанилин, анилиноранж, филадельфийская желтая и проч.) желтый искусственный пигмент, по составу представляющий смесь азотнокислых солей диамидофенилакридина и других аналогичных оснований. Ф. приготовляется из маточных растворов, остающихся… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Источник
Продолжение. Cм. в № 22/2005;
1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19, 21/2008;
1, 3, 10, 11/2009
ЗАНЯТИЕ 30
10-й класс (первый год обучения)
Фосфор и его соединения
П л а н
 1.
1.
Положение в таблице Д.И.Менделеева, строение
атома.
2. Краткая история открытия и происхождение
названия.
3. Физические свойства.
4. Химические свойства.
5. Нахождение в природе.
6. Основные методы получения
7. Важнейшие соединения фосфора.
Фосфор находится в главной подгруппе V группы
периодической системы Д.И.Менделеева. Его
электронная формула 1s22s2p63s2p3,
это р-элемент. Характерные степени окисления
фосфора в соединениях –3, +3, +5; наиболее
устойчивой является степень окисления +5. В
соединениях фосфор может входить как в состав
катионов, так и в состав анионов, например:

Фосфор получил свое название благодаря
свойству белого фосфора светиться в темноте.
Греческое слово ![]() переводится как «несущий свет». Этим
переводится как «несущий свет». Этим
названием фосфор обязан своему первооткрывателю
– алхимику Бранду, который, завороженный
свечением белого фосфора, пришел к выводу, что
получил философский камень.
Фосфор может существовать в виде нескольких
аллотропных модификаций, наиболее устойчивыми
из которых являются белый, красный и черный
фосфор.
Молекула белого фосфора (наиболее
активного аллотропа) имеет молекулярную
кристаллическую решетку, в узлах которой
находятся четырехатомные молекулы Р4
тетраэдрического строения.
Белый фосфор мягкий, как воск, плавится и кипит
без разложения, обладает чесночным запахом. На
воздухе белый фосфор быстро окисляется (светится
зеленоватым цветом), возможно самовоспламенение
мелкодисперсного белого фосфора. В воде
нерастворим (хранят под слоем воды), но хорошо
растворяется в органических растворителях.
Ядовит (даже в малых дозах, ПДК = 0,03 мг/м3).
Обладает очень высокой химической активностью.
При нагревании без доступа воздуха до 250–300 °С
превращается в красный фосфор.
Красный фосфор – это неорганический
полимер; макромолекулы Рn могут иметь
как циклическое, так и ациклическое строение. По
свойствам резко отличается от белого фосфора: не
ядовит, не светится в темноте, не растворяется в
сероуглероде и других органических
растворителях, не обладает высокой химической
активностью. При комнатной температуре медленно
переходит в белый фосфор; при нагревании до
200 °С под давлением превращается в черный
фосфор.
Черный фосфор по виду похож на графит.
По структуре – это неорганический полимер,
молекулы которого имеют слоистую структуру.
Полупроводник. Не ядовит. Химическая активность
значительно ниже, чем у белого фосфора. На
воздухе устойчив. При нагревании переходит в
красный фосфор.
Х и м и ч е с к и е с в о й с т в а
Наиболее активным в химическом отношении
является белый фосфор (но на практике
предпочитают работать с красным фосфором). Он
может проявлять в реакциях свойства как
окислителя, так и восстановителя, например:
Н2 (+):
![]()
О2 (+):
4Р + 3О2 2Р2О3,
4Р + 5О2 2Р2О5.
Металлы (+/–)*:
3Ca + 2P Ca3P2,
3Na + P Na3P,
Cu + P реакция не
идет.
Неметаллы (+):
![]()
но
2Р + 3I 2PI3,
6P + 5N2 2P2N5.
Н2О (+):

Основные оксиды (–).
Кислотные оксиды (–).
Щелочи (+):
![]()
Кислоты (не окислители) (–).
Кислоты-окислители (+):
3P (кр.) + 5HNO3 (разб.) + 2H2O = 3H3PO4
+ 5NO,
P (кр.) + 5HNO3 (конц.) H3PO4 + 5NO2 + H2O,
2P (кр.) + H2SO4 (конц.) 2H3PO4 + 5SO2 + 2H2O.
Соли (–)**.
В п р и р о д е фосфор встречается в виде
соединений (солей), важнейшими из которых
являются фосфорит (Ca3(PO4)2),
хлорапатит (Ca3(PO4)2•CaCl2) и
фторапатит (Ca3(PO4)2•CaF2).
Фосфат кальция содержится в костях всех
позвоночных животных, обусловливая их прочность.
Фосфор п о л у ч а ю т в электропечах, сплавляя
без доступа воздуха фосфат кальция, песок и
уголь:
Сa3(PO4)2 + 3SiO2 + 5C ![]() 2P + 5CO + 3CaSiO3.
2P + 5CO + 3CaSiO3.
К важнейшим соединениям фосфора относятся:
фосфин, оксид фосфора(III), оксид фосфора(V),
фосфорные кислоты.
Ф о с ф и н
Это водородное соединение фосфора, бесцветный
газ с чесночно-рыбным запахом, очень ядовит.
Плохо растворим в воде, но хорошо растворим в
органических растворителях. Гораздо менее
устойчив, чем аммиак, но является более сильным
восстановителем. Практического значения не
имеет.
Для п о л у ч е н и я фосфина обычно не используют
реакцию прямого синтеза из простых веществ;
наиболее распространенный способ получения
фосфина – гидролиз фосфидов:
Сa3P2 + 6HOH = 3Ca(OH)2 + 2PH3.
Кроме того, фосфин можно получить реакцией
диспропорционирования между фосфором и
растворами щелочей:
4P + 3KOH + 3H2O
PH3 + KPO2H2,
или из солей фосфония:
PH4I PH3 + HI,
PH4I + NaOH PH3 + NaI + H2O.
Химические свойства фосфина целесообразно
рассматривать с двух сторон.
Кислотно-основные свойства. Фосфин
образует с водой неустойчивый гидрат,
проявляющий очень слабые основные свойства:
PH3 + H2O PH3•H2O (PH4OH),
PH3 + HCl PH4Cl,
2PH3 +H2SO4 (PН4)2SO4.
Окислительно-восстановительные свойства.
Фосфин – сильный восстановитель:
2PH3 + 4O2 P2O5 + 3H2O,
PH3 + 8AgNO3 + 4H2O = H3PO4
+ 8Ag + 8HNO3.
О к с и д ф о с ф о р а(III)
Оксид Р2О3 (истинная формула – Р4О6)
– белое кристаллическое вещество, типичный
кислотный оксид. При взаимодействии с водой на
холоде образует фосфористую кислоту (средней
силы):
P2O3 + 3H2O = 2H3PO3

Поскольку фосфористая кислота является
двухосновной, при взаимодействии триоксида
фосфора со щелочами образуется два типа
солей – гидрофосфиты и дигидрофосфиты.
Например:
P2O3 + 4NaOH = 2Na2HPO3 + H2O,
P2O3 + 2NaOH + H2O = 2NaH2PO3.
Диоксид фосфора Р2О3 окисляется
кислородом воздуха до пентаоксида:
P2O3 + O2 P2O5.
Триоксид фосфора и фосфористая кислота
являются достаточно сильными восстановителями.
Получают оксид фосфора(III) медленным окислением
фосфора в недостатке кислорода:
4P + 3O2 2P2O3.
О к с и д ф о с ф о р а(V) и ф о с ф о р
н ы е к и с л о т ы
Пентаоксид фосфора Р2О5
(истинная формула – Р4О10) – белое
гигроскопичное кристаллическое вещество. В
твердом и газообразном состояниях молекула
существует в виде димера, при высоких
температурах мономеризуется. Типичный кислотный
оксид. Очень хорошо растворяется в воде, образуя
ряд фосфорных кислот:
метафосфорную:
P2O5 + H2O= 2HPO3

пирофосфорную (дифосфорную):
P2O5 + 2H2O= H4P2O7

ортофосфорную (фосфорную):
P2O5 + 3H2O= 2H3PO4

Пентаоксид фосфора проявляет все свойства,
характерные для кислотных оксидов, например:
P2O5 + 3H2O= 2H3PO4,
P2O5 + 3CaO![]() 2Ca3(PO4)2;
2Ca3(PO4)2;
может образовывать три типа солей:

Окислительные свойства для него не характерны,
т.к. степень окисления +5 является для фосфора
очень устойчивой. Получают пентаоксид фосфора
при горении фосфора в достаточном количестве
кислорода:
4P + 5O2 2P2O5.
Ортофосфорная кислота Н3РО4 –
бесцветное кристаллическое вещество, очень
хорошо растворимое в воде, гигроскопична. Это
трехосновная кислота средней силы; не обладает
выраженными окислительными свойствами.
Проявляет все химические свойства, характерные
для кислот, образует три типа солей (фосфаты,
гидрофосфаты и дигидрофосфаты):
2H3PO4 + 3Ca = Ca3(PO4)2
+ 3H2,
H3PO4 + Cu ,
2H3PO4 + 3CaO = Ca3(PO4)2
+ 3H2O,

2H3PO4 + K2CO3 = 2KH2PO4
+ CO2 + H2O.
В промышленности фосфорную кислоту п о л у ч а ю
т экстракционным:
Ca3(PO4)2 + 3H2SO4
= 2H3PO4 + 3CaSO4,
а также термическим методом:
Ca3(PO4)2 + 3SiO2 + 5C ![]() 3СaSiO3 + 2P + 5CO,
3СaSiO3 + 2P + 5CO,
4P + 5O2 2P2O5,
P2O5 + 3H2O = 2H3PO4.
К лабораторным методам получения
ортофосфорной кислоты относят действие
разбавленной азотной кислоты на фосфор:
3Р (кр.) + 5HNO3 (разб.) + 2Н2О = 3H3PO4
+ 5NO,
взаимодействие метафосфорной кислоты с водой
при нагревании:
HPO3 + H2O H3PO4.
В организме человека ортофосфорная кислота
образуется при гидролизе аденозинотрифосфорной
кислоты (АТФ):
АТФ АДФ + H3PO4.
Качественной реакцией на фосфат-ион
является реакция с катионом серебра; образуется
осадок желтого цвета, не растворимый в
слабокислых средах:
3Ag+ + = Ag3PO4,
3AgNO3 + K3PO4 = Ag3PO4 + 3KNO3.
Кроме вышеперечисленных фосфорных кислот
(содержащих фосфор в степени окисления +5), для
фосфора известно много других
кислородсодержащих кислот. Приведем некоторые
из важнейших представителей.
Фосфорноватистая (НРО2Н2) –
одноосновная кислота средней силы. Второе ее
название – фосфиновая:

Соли этой кислоты называют гипофосфитами, или
фосфитами, например KРО2Н2.
Фосфористая (Н3РО3) –
двухосновная кислота средней силы, немного
слабее фосфорноватистой. Также имеет второе
название – фосфоновая:

Ее соли называются фосфиты, или фосфонаты,
например K2РО3Н.
Дифосфорная (пирофосфорная) (Н4Р2О7)
– четырехосновная кислота средней силы, чуть
сильнее ортофосфорной:

Соли – дифосфаты, например K4P2O7.
Тест по теме «Фосфор и его
соединения»
 1.
1.
Исключите «лишний» элемент из перечисленных по
принципу возможности образования аллотропных
модификаций:
а) кислород; б) азот;
в) фосфор; г) сера.
2. При взаимодействии 42,6 г фосфорного
ангидрида и 400 г 15%-го раствора гидроксида натрия
образуется:
а) фосфат натрия;
б) гидрофосфат натрия;
в) смесь фосфата и гидрофосфата натрия;
г) смесь гидро- и дигидрофосфата натрия.
3. Сумма коэффициентов в уравнении
электролитической диссоциации фосфата калия
равна:
а) 5; б) 3; в) 4; г) 8.
4. Число электронов на внешнем уровне атома
фосфора:
а) 2; б) 3; в) 5; г) 15.
5. Фосфор, полученный из 33 г технического
фосфата кальция, сожгли в кислороде.
Образовавшийся оксид фосфора(V) прореагировал с
200 мл 10%-го раствора гидроксида натрия
(плотность – 1,2 г/мл) с образованием средней
соли. Масса примесей в техническом образце
фосфата кальция (в г) составляет:
а) 3,5; б) 1,5; в) 2; г) 4,8.
6. Число -связей
в молекуле пирофосфорной кислоты:
а) 2; б) 12; в) 14; г) 10.
7. Число атомов водорода, содержащихся в
4,48 л (н.у.) фосфина равно:
а) 1,2•1023; б) 0,6•1023;
в) 6,02•1023; г) 3,6•1023.
8. При температуре 30 °С некая реакция
протекает за 15 с, а при 0 °С – за 2 мин.
Коэффициент Вант-Гоффа для данной реакции:
а) 2,4; б) 2; в) 1,8; г) 3.
9. Ортофосфорная кислота может реагировать
со следующими веществами:
а) оксид меди(II); б)гидроксид калия;
в) азотная кислота; г) цинк.
10. Сумма коэффициентов в реакции между
фосфором и бертолетовой солью равна:
а) 9; б) 6; в) 19; г) такая реакция невозможна.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| б | в | а | в | в | б | г | б | а, б ,г | в |
Задачи и упражнения на фосфор и его
соединения
 Ц е п
Ц е п
о ч к и п р е в р а щ е н и й:
1. Фосфор —> пентаоксид фосфора —>
ортофосфорная кислота —> фосфат кальция ®
фосфорная кислота.
2. Фосфат кальция —> фосфор —> фосфид
кальция —> фосфин —> пентаоксид фосфора —>
фосфорная кислота —> дигидрофосфат кальция.
3. Фосфат кальция —> А —> В —> С —> Д
—> Е —> фосфат кальция. Все вещества содержат
фосфор, в схеме три ОВР подряд.
4. Фосфор —> пентаоксид фосфора —> фосфат
кальция —> фосфор —> фосфин —> фосфорная
кислота —> дигидрофосфат кальция.
5. Фосфид кальция (+ р-р соляной кислоты) —>
А (+ кислород) —> В (+ гидроксид натрия,
недостаток) —> С (+ гидроксид натрия, избыток)
—> Д (+ гидроксид кальция) —> Е.
1. При полном сгорании 6,8 г вещества
получили 14,2 г пентаоксида фосфора и 5,4 г воды.
К полученным продуктам реакции добавили 37 мл
32%-го раствора едкого натра (плотность 1,35 г/мл).
Установите формулу исходного вещества и
определите концентрацию полученного раствора.
Решение
Уравнение реакции:
![]()
(P2O5) =
0,1 моль, (H2O) =
0,3 моль.
(P) = 0,2 моль, (H) = 0,6 моль.
m(P) = 6,2 г, m(H) = 0,6 г.
![]() m = 6,8 г.
m = 6,8 г.
(P) : (?
