Какими свойствами обладает оксид серы
Оксиды серы. Общая характеристика, химические свойства

Большинство школьников знают два оксида серы – SO2 и SO3.
Однако, это не все соединения, которые сера образует с кислородом.
Рассмотрим их все.
Монооксид серы – SO

- Встречается только в виде разбавленной газовой фазы;
- после концентрирования превращается в S2O2 (диоксид дисульфита);
- SO имеет триплетное основное состояние, схожее с таковым у O2, то есть каждая молекула имеет по два неспаренных электрона;
- молекула SO используется в реакциях органического синтеза (встраивается в молекулы алкенов, алкинов, диенов для получения молекул с трехчленными кольцами, содержащими серу);
- монооксид серы обнаружен на Ио – спутнике Юпитера, а также в атмосфере Венеры, в комете Хейла – Боппа (или “Большая комета 1997 года”);
- редко встречается в атмосфере Земли, поэтому токсичность в полной мере не выявлена;
- обладает высокой воспламеняемостью, горит до образования ядовитого сернистого газа SO2.
Дисульфид серы – SO2

- Токсичный газ, ответственен за запах сгоревших спичек;
- в природе образуется в результате вулканической активности;
- вне Земли встречается в атмосфере Венеры, где образует облака в результате конденсации, способствуя при этом глобальному потеплению на планете; а также на Ио, спутнике Юпитера (90% атмосферы)
- промышленное значение сернистого газа в основном заключается в производстве серной кислоты;
- SO2 может связываться с ионами металлов в качестве лиганда с образованием комплексов диоксида серы с металлом, обычно там, где переходный металл находится в степени окисления 0 или +1;
- обладает антимикробными свойствами, используется в качестве консерванта для кураги, инжира (E220);
- диоксид серы издавна применяется в производстве вина – служит антибиотиком и антиоксидантом, защищая вино от порчи и потемнения (окисления);
- сернистый газа является сильным восстановителем, при этом обладает отбеливающим эффектом;
- эндогенный диоксид серы играет важную физиологическую роль в регуляции работы сердца и кровеносных сосудов, а нарушение его метаболизма может привести к артериальной гипертензии, атеросклерозу, стенокардии.
Триоксид серы, серный ангидрид – SO3

- Является значительным загрязнителем, основной компонент кислотных дождей;
- имеет большое значение в промышленности, так как является прекурсором серной кислоты;
- в сухой атмосфере обильно дымит, без запаха, но едкий;
- на воздухе образуется прямым окислением сернистого газа;
- в лаборатории триоксид серы можно получить путем двухстадийного пиролиза бисульфата натрия:
- 2NaHSO4 → Na2S2O7 + H2O
Na2S2O7 → Na2SO4 + SO3
- серный ангидрид агрессивно гигроскопичен – теплота гидратации достаточна, чтобы смесь этого газа и древесины (или хлопка) могла воспламениться;
- при вдыхании вызывает ожоги, обладает высокой коррозионной активностью.
Тетроксид серы – SO4
- Этот оксид серы представляет собой группу химических соединений с формулой SO3 + Х, где Х лежит между 0 и 1;
- здесь содержатся пероксогруппы (О-О), а степень окисления серы как в триоксиде серы, +6;
- может быть выделен при низких температурах (78 К), после реакции SO3 с атомарным кислородом или фотолиза смесей SO3 – озон.

Монооксид дисеры, субоксид серы – S2O
- Представляет собой бесцветный газ, который при конденсации образует твердое вещество бледного цвета, нестабильное при комнатной температуре;
- Грамотрицательные бактерии Desulfovibrio desulfuricans способны производить S2O;
- был обнаружен Питером Шенком в 1933 году.
Пoсле краткого обзора оксидов серы прилагаю таблицу двух важнейших оксидов серы – сернистого газа и серного ангидрида, так как именно они по большей части встречаются в заданиях ЕГЭ и ОГЭ по Химии.
Реагент | Оксид серы IV – SO2 – Диоксид серы; – газ с резким запахом; – кислотный оксид; – гибридизация серы – sp2; – валентный угол – 120 | Оксид серы VI – SO3 – Триоксид серы; – бесцветная летучая жидкость; – кислотный оксид; – гибридизация серы – sp3; – валентный угол 120 |
Получение | 1) В промышленности: S + O2 = SO2 (360 C) 4FeS + 7O2 = 2Fe2O3 + 4SO2 (t) 2) В лаборатории: Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O (t) Me + 2H2SO4 (k) = MeSO4 + SO2 + 2H2O (Me = Cu, Hg, Bi, Ag) 2HBr + 2H2SO4 (k) = Br2 + SO2 + 2H2O | 1) В промышленности: 2SO2 + O2 = 2SO3 (500 C, V2O5) SO2 + O3 = SO3 + O2 2) В лаборатории: 2CaSO4 = 2CaO + 2SO3 (450 C) 2CuSO4 = 2CuO + 2SO3 Na2S2O7 = Na2SO4 + 2SO3 |
+ O2 | 2SO2 + O2 = 2SO3 + Q | ≠ |
+ H2O | SO2 + H2O = H2SO3 | SO3 + H2O = H2SO4 |
+ H2O2 | SO2 + H2O2 = H2SO4 | ≠ |
+ Основные оксиды | SO2 + CaO = CaSO3 SO2 + Na2O = Na2SO3 | SO3 + Na2O = Na2SO4 SO3 + CaO = CaSO4 |
+ Кислотные оксиды | SO2 + CO = S + 2CO2 (Al2O3, 500 C) SO2 + NO2 = SO3 + NO (нитрозный способ получения серной кислоты) | ≠ |
+ Амфотерные оксиды | SO2 + Al2O3, BeO, ZnO ≠ | SO3 + Fe2O3 = Fe2(SO4)3 |
+ Основания | SO2 + 2NaOH = Na2SO3 + H2O SO2 + Me(OH)x ≠ (Me = Fe, Cr, Al, Sn) SO2 + 2KOH (расплав) = 3K2SO4 + K2S + 4H2O (t) | SO3 + 2NaOH (разб.) = Na2SO4 + H2O SO3 + Ca(OH)2 = CaSO4 + H2O |
+ Кислоты | SO2 + 4HI = S↓ + 2I2 + 2H2O SO2 + 2H2S = 3S + 2H2O SO2 + 2HNO3 (k) = H2SO4 + 2NO2 SO2 + 2HNO2 (p) = H2SO4 + 2NO | SO3 + HF = HSO3F (45 C) SO3 + HCl = HSO3Cl (20 C, в олеуме) SO3 + H2SO4 + CaF2 = 2HSO3F + CaSO4 SO3 + H2SO4 (безводн.) = H2S2O7 3SO3 + H2S = 4SO2 + H2O |
+ Соли | SO2 + Na2CO3 = Na2SO3 + CO2 (20 С) SO2 + Na2SO3 = Na2S2O5 (в этаноле) SO2 + PCl5 = PClO3 + SCl2O (50 – 60 C) | SO3 + MeF = MeSO3F (Me = Li, K, NH4) SO3 + 2KI = K2SO3 + I2 SO3 + Na2S = Na2SO4 |
+ Комплексные соли | 3SO2 + Na3[Al(OH)6] (P) = Al(OH)3 + 3NaHSO3 | ≠ |
+ Неметалл | SO2 + O3 = SO3 + O2 SO2 + 2C = S↓ + 2CO2 (600 С) SO2 + Cl2 = SO2Cl2 (солнечный свет) SO2 + F2 = SO2F2 (20 С, Pt) SO2 + 3F2 = SF6 + O2 (650 C) SO2 + 2H2 = S↓ + 2H2O SO2 + 3S = 2S2O (вакуум, эл. разряд) | 2SO3 + C = 2SO2 + CO2 10SO3 + P4 = P4O10 + 10SO2 |
+ Металл | SO2 + Me + H2O = MeSO3 + H2 (активные Ме) SO2 + Me = MeS2O4 (Me = Zn, Co; в смеси этанола иводы) | SO3 + Mg = MgO + SO2 |
ОВР | SO2 + Cl2 + 2H2O = 2HCl + H2SO4 SO2 + I2 + 2H2O = 2HI + H2SO4 5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4 5SO2 + 2K2Cr2O7 + H2SO4 = K2SO4 + Cr2(SO4)3 + H2O SO2 + 2FeCl3+ 2H2O = 2FeCl2 + H2SO4 + 2HCl SO2 + 2CuCl2 + 2H2O = 2CuCl + 2HCl + H2SO4 | SO3 + 2HCl = SO2 + Cl2 + H2O (t) SO3 + 2HBr = SO2 + Br2 + H2O (0 C) SO3 + 8HI = H2S + 4I2 + 3H2O (0 C) |
pangenes.ru © 2020
Источник
Оксид серы((VI))
Oксид серы(VI) образуется при каталитическом окислении сернистого газа:
2SO2+O2⇄t,k2SO3.
При обычных условиях это жидкость, которая реагирует с водой с образованием серной кислоты:
SO3+H2O=H2SO4.
Эта реакция протекает даже с парами воды. Поэтому оксид серы((VI)) дымит на воздухе.
Особенностью оксида серы((VI)) является его способность растворяться в концентрированной серной кислоте с образованием олеума.
Оксид серы((VI)) — типичный кислотный оксид. Он реагирует с основаниями и основными оксидами c образованием солей:
SO3+2NaOH=Na2SO4+H2O,
SO3+CaO=CaSO4.
Степень окисления серы в этом оксиде — (+6). Это максимальное значение для серы, поэтому в окислительно-восстановительных реакциях он может быть только окислителем.
Серная кислота H2SO4 — важнейшее соединение серы. Чистая серная кислота представляет собой бесцветную вязкую маслянистую жидкость, котoрая почти в два раза тяжелее воды.
Серная кислота неограниченно смешивается с водой. Растворение серной кислоты сопровождается сильным разогреванием раствора, и может происходить его разбрызгивание. Поэтому серную кислоту растворяют осторожно: тонкой струйкой кислоту вливают в воду при постоянном перемешивании.
Серная кислота очень гигроскопична и используется для осушки разных веществ.
Химические свойства серной кислоты зависят от её концентрации.
Серная кислота любой концентрации реагирует:
- с основными и амфотерными оксидами и гидроксидами с образованием соли и воды:
H2SO4+CuO=CuSO4+H2O,
H2SO4+Zn(OH)2=ZnSO4+2H2O;
- с солями, если образуется газ или нерастворимое вещество:
H2SO4+CaCO3=CaSO4+H2O+CO2↑,
H2SO4+BaCl2=BaSO4↓+2HCl.
Разбавленная кислота реагирует только с металлами, расположенными в ряду активности до водорода. В реакции образуются сульфаты и выделяется водород. Окислительные свойства в этом случае проявляют атомы водорода:
H2+1SO4+Zn0=Zn+2SO4+H2↑0.
Концентрированная кислота реагирует:
- со всеми металлами, кроме золота и платины, за счёт сильных окислительных свойств атома серы:
2H2S+6O4+Cu0=Cu+2SO4+S+4O2+2H2O.
В реакциях с активными металлами продуктами реакции могут быть сернистый газ, сероводород или сера.
Обрати внимание!
При низкой температуре пассивирует железо и алюминий и с ними не реагирует.
- С твёрдыми солями других кислот:
H2SO4(к)+2NaNO3(тв)=Na2SO4+2HNO3.
- Со многими органическими веществами (происходит обугливание сахара, бумаги, древесины и т. д., так как отнимается вода):
Серная кислота образует два ряда солей. Средние соли называются сульфатами (Na2SO4,CaSO4), а кислые — гидросульфатами (NaHSO4,Ca(HSO4)2).
Качественной реакцией на серную кислоту и её соли является реакция с растворимыми солями бария — выпадает белый осадок сульфата бария:
Na2SO4+BaCl2=BaSO4↓+2NaCl,SO42−+Ba2+=BaSO4↓.
Серная кислота — одно из важнейших химических веществ. Она используется:
- для получения других кислот;
- для производства минеральных удобрений;
- для очистки нефтепродуктов;
- в свинцовых аккумуляторах;
- в производстве моющих средств, красителей, лекарств.
Соли серной кислоты также находят применение. Медный купорос CuSO4⋅5H2O используется для борьбы с заболеваниями растений, гипс CaSO4⋅2H2O применяется в строительстве, сульфат бария BaSO4 — в медицине.
Источник
Оксид серы (VI) – SO3
(серный ангидрид)
Физические свойства
Бесцветная летучая маслянистая жидкость, t°пл. = 17°C; t°кип. = 66°С; на воздухе
“дымит”, сильно поглощает влагу (хранят в запаянных сосудах).
SO3
+ H2O → H2SO4
SO3
хорошо растворяется в 100%-ной серной кислоте, этот раствор называется
олеумом.
Получение
1) 2SO2
+ O2 → 2SO3
(катализатор – V2O5,
при 450˚С)
2)
Fe2(SO4)3 → Fe2O3
+ 3SO3
(разложение при нагревании)
Химические свойства
1)
Серный ангидрид – кислотный оксид.
Взаимодействие
с водой
При растворении в воде дает сильную двухосновную
серную кислоту:
SO3
+ H2O → H2SO4
Диссоциация протекает ступенчато:
H2SO4→
H+
+
HSO4-
(первая ступень, образуется гидросульфат – ион)
HSO4-
→ H+
+
SO42- (вторая ступень, образуется сульфат – ион)
H2SO4
образует два ряда солей – средние (сульфаты) и кислые (гидросульфаты)
Взаимодействие
со щелочами
2NaOH
+ SO3
→ Na2SO4
+ H2O
NaOH
+ SO3
(избыток) → NaHSO4
Взаимодействие
с основными оксидами
Na2O
+ SO3 → Na2SO4
2) SO3 – сильныйокислитель.
СЕРНАЯ КИСЛОТА – H2SO4
Физические свойства
Тяжелая маслянистая жидкость (“купоросное
масло”); r=
1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным
нагревом; t°пл.
= 10,3°C,
t°кип.
= 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание
бумаги, дерева, сахара).
Помните!
Кислоту вливать малыми порциями в воду, а не наоборот!
Производство серной кислоты
1-я стадия.
Печь для обжига колчедана
4FeS2
+ 11O2
→ 2Fe2O3
+ 8SO2
+ Q
Процесс гетерогенный:
1) измельчение железного
колчедана (пирита)
2) метод “кипящего
слоя”
3) 800°С; отвод лишнего
тепла
4) увеличение концентрации
кислорода в воздухе
2-я стадия.
Контактный аппарат
После очистки, осушки и теплообмена сернистый газ поступает в контактный
аппарат, где окисляется в серный ангидрид (450°С – 500°С; катализатор V2O5):
2SO2
+ O2
→ 2SO3
3-я стадия.
Поглотительная башня
nSO3
+ H2SO4(конц) → (H2SO4 • nSO3) (олеум)
Воду использовать нельзя из-за образования тумана. Применяют
керамические насадки и принцип противотока.
Химические свойства разбавленной серной кислоты
H2SO4
– сильная двухосновная кислота, водный раствор изменяет окраску индикаторов
(лакмус и универсальный индикатор краснеют)
1)
Диссоциация протекает ступенчато:
H2SO4→
H+
+
HSO4-
(первая ступень, образуется гидросульфат – ион)
HSO4-
→ H+
+
SO42- (вторая ступень, образуется сульфат – ион)
H2SO4
образует два ряда солей – средние (сульфаты) и кислые (гидросульфаты)
2)
Взаимодействие с металлами:
Разбавленная серная кислота растворяет только
металлы, стоящие в ряду напряжений левее водорода:
Zn0 +
H2+1SO4(разб) → Zn+2SO4
+ H20↑
Zn0
+ 2H+
→ Zn2+
+ H20↑
3)
Взаимодействие с основными и амфотерными оксидами:
CuO + H2SO4
→ CuSO4 + H2O
CuO + 2H+ →
Cu2+ + H2O
4) Взаимодействие
с основаниями:
·
H2SO4
+ 2NaOH
→
Na2SO4
+ 2H2O (реакция нейтрализации)
H+ +
OH-
→
H2O
Если
кислота в избытке, то образуется кислая соль:
H2SO4 + NaOH → NaНSO4 + H2O
·
H2SO4
+ Cu(OH)2 → CuSO4 + 2H2O
2H+ +
Cu(OH)2 → Cu2+ +
2H2O
5)
Обменные реакции с солями:
образование
осадка
BaCl2
+ H2SO4 → BaSO4↓ + 2HCl
Ba2+
+
SO42-
→ BaSO4↓
Качественная реакция
на сульфат-ион:
Образование белого
осадка BaSO4 (нерастворимого в
кислотах) используется для идентификации серной кислоты и растворимых
сульфатов.
образование
газа – как
сильная нелетучая кислота серная вытесняет из солей другие менее сильные
кислоты, например, угольную
MgCO3
+ H2SO4 → MgSO4 + H2O + CO2↑
MgCO3
+ 2H+ → Mg2+ + H2O + CO2↑
Серную кислоту применяют
- в
производстве минеральных удобрений; - как
электролит в свинцовых аккумуляторах; - для
получения различных минеральных кислот и солей; - в
производстве химических волокон, красителей, дымообразующих веществ и
взрывчатых веществ; - в
нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях
промышленности; - в
пищевой промышленности — зарегистрирована в качестве пищевой добавки E513(эмульгатор); - в
промышленном органическом синтезе в реакциях: - дегидратации
(получение диэтилового эфира, сложных эфиров); - гидратации
(получение этанола); - сульфирования
(получение СМС и промежуточные продукты в производстве красителей); - и
др.
Самый крупный потребитель серной кислоты —
производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений
расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной
кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами
по производству минеральных удобрений.
Применение солей серной кислоты
Железный купорос FеSО4•7Н2O применяли раньше
для лечения чесотки, гельминтоза и опухолей желез, в настоящее время используют
для борьбы с сельскохозяйственными вредителями.

Медный купорос CuSO4•5Н2O широко используют
в сельском хозяйстве для борьбы с вредителями растений.

«Глауберова соль» (мирабилит) Nа2SO4•10Н2O
была получена немецким химиком И. Р. Глаубером
при действии серной кислоты на хлорид натрия, в медицине ее используют как
слабительное средство.

«Бариевая каша» BaSO4обладает способностью задерживать
рентгеновские лучи в значительно большей степени, чем ткани организма. Это
позволяет рентгенологам при заполнении «бариевой кашей» полых органов
определить в них наличие анатомических изменений.
Гипс СаSO4•2Н2O находит широкое применение в
строительном деле, в медицинской практике для накладывания гипсовых повязок,
для изготовления гипсовых скульптур.

Тренажёр №1 – Сероводород. Оксиды серы
Тренажёр №2 – Свойства разбавленной серной кислоты
Это интересно:
ГЛАУБЕР, ИОГАНН РУДОЛЬФ
ГЛАУБЕРОВА СОЛЬ
Задания для закрепления
№1. Осуществите превращения по схеме:
1) Zn →ZnSO4→Zn(OH)2 →ZnSO4 → BaSO4
2)
S →SO2 →SO3→H2SO4 →K2SO4
№2. Закончите уравнения практически осуществимых
реакций в полном и кратком ионном виде:
Na2CO3
+ H2SO4→
Cu
+ H2SO4 (раствор) →
Al(OH)3
+ H2SO4 →
MgCl2
+ H2SO4 →
№3. Запишите уравнения реакций взаимодействия
разбавленной серной кислоты с магнием, гидроксидом железа (III), оксидом
алюминия, нитратом бария и сульфитом калия в молекулярном, полном и кратком
ионном виде.
Источник
В этой статье вы найдете информацию о том, что такое оксид серы. Будут рассмотрены его основные свойства химического и физического характера, существующие формы, способы их получения и отличия между собой. А также будут упомянуты области применения и биологическая роль данного оксида в его разнообразных формах.
Что представляет собой вещество
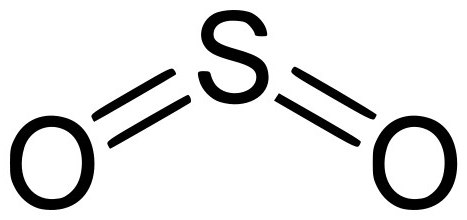
Оксид серы – это соединение простых веществ, серы и кислорода. Существует три формы оксидов серы, отличающиеся между собой степенью проявленной валентности S, а именно: SO (монооксид, моноокись серы), SO2 (серный диоксид или сернистый газ) и SO3 (триоксид или ангидрид серы). Все перечисленные вариации оксидов серы имеют схожие как химические, так и физические характеристики.

Общие данные о моноокисиде серы
Двухвалентный серный монооксид, или иначе серная моноокись – это неорганическое вещество, состоящее из двух простых элементов – серы и кислорода. Формула – SO. В условиях нормальной обстановки является газом без цвета, но с резким и специфическим запахом. Вступает в реакции с водным раствором. Довольно редкое соединение в земной атмосфере. К воздействию температур неустойчив, существует в димерной форме – S2O2. Иногда способен, взаимодействуя с кислородом, в результате реакции образовывать диоксид серы. Солей не образует.
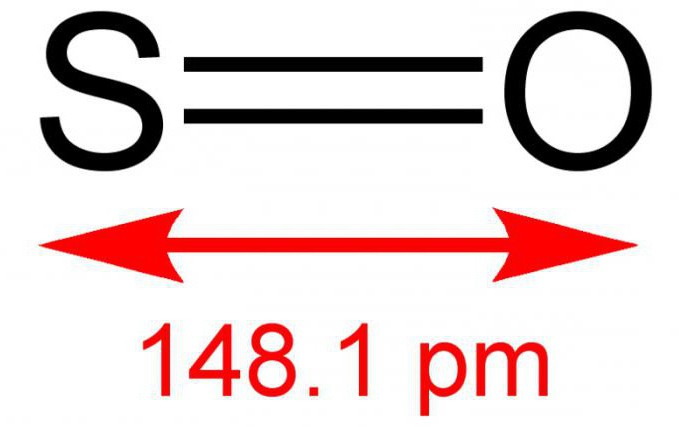
Получают оксид серы (2) обычно при помощи сжигания серы или разложении ее ангидрида:
- 2S2+O2 =2SO;
- 2SO2 = 2SO+O2.
В воде вещество растворяется. В результате оксид серы образует тиосерную кислоту:
- S2O2+H2O = H2S2O3.
Общие данные о сернистом газе
Оксид серы – очередная форма оксидов серы с химической формулой SO2. Имеет неприятный специфический запах и не имеет цвета. Подвергаясь давлению, может зажигаться при комнатной температуре. При растворении в воде образует нестойкую сернистую кислоту. Может растворяться в растворах этанола и серной кислоты. Является компонентом вулканического газа.

В промышленности получают сжиганием серы или обжигом ее сульфидов:
- 2FeS2+5O2 = 2FeO+4SO2.
В лабораториях, как правило, SO2 получают при помощи сульфитов и гидросульфитов, подвергая их воздействию сильной кислоты, а также воздействию на металлы с маленькой степенью активности концентрированной H2SO4.
Как и другие серные оксиды, SO2 является кислотным оксидом. Взаимодействуя со щелочами, образуя различные сульфиты, вступает в реакции с водой, создавая серную кислоту.
SO2 чрезвычайно активен, и это ярко выражается в его восстановительных свойствах, где окислительная степень оксида серы возрастает. Может проявлять свойства окислителя, если на него воздействует сильный восстановитель. Последнюю характерную особенность используют для производства фосфорноватистой кислоты, или для отделения S от газов металлургической области деятельности.
Оксид серы (4) широко используется человеком для получения сернистой кислоты или ее солей – это его основная область применения. А также он участвует в процессах виноделия и выступает там в роли консерванта (E220), иногда им протравливают овощехранилища и склады, так как он уничтожает микроорганизмы. Материалы, которые нельзя подвергать отбеливанию хлором, обрабатывают оксидом серы.

SO2 – довольно токсичное соединение. Характерные симптомы, указывающие на отравление им, – это откашливание, появление проблем с дыханием, как правило, в виде насморка, охриплости, появление необычного привкуса и першение в горле. Вдыхание такого газа может вызвать удушье, нарушение речевой способности индивида, рвоту, затруднение процесса глотания, а также легочный отек в острой форме. Максимально допустимой концентрацией этого вещества в рабочем помещении является 10мг/м3. Однако у различных людей организм может проявлять и разную чувствительность к сернистому газу.
Общие данные о серном ангидриде
Серный газ, или, как его называют, серный ангидрид, – это высший оксид серы с химической формулой SO3. Жидкость с удушливым запахом, легколетучая при стандартных условиях. Способна застывать, образовывая смеси кристаллического типа из его твердых модификаций, при температуре от 16.9 °C и ниже.
Детальный разбор высшего оксида
При окислении SO2 воздухом под воздействием высоких температур, необходимым условием является наличие катализатора, например V2O5, Fe2O3, NaVO3 или Pt.
Термическое разложение сульфатов либо взаимодействие озона и SO2:
- Fe2(SO4)3 = Fe2O3+3SO3;
- SO2+O3 = SO3+O2.
Окисление SO2 при помощи NO2:
- SO2+NO2 = SO3+NO.
К физическим качественным характеристикам относятся: наличие в состоянии газа плоского строения, тригонального типа и D3h симметрии, во время перехода от газа к кристаллу или жидкости образует тример циклического характера и зигзагообразную цепь, имеет ковалентную полярную связь.
В твердой форме SO3 встречается в альфа, бета, гамма и сигма формах, при этом он имеет, соответственно, разную температуру плавления, степень проявления полимеризации и разнообразную кристаллическую форму. Существование такого количества видов SO3 обусловлено образованием связей донорно-акцепторного типа.
К свойствам ангидрида серы можно отнести множество его качеств, основными из них являются:
Способность взаимодействовать с основаниями и оксидами:
- 2KHO+SO3 = K2SO4+H2O;
- CaO+SO3 = CaSO4.
Высший серный оксид SO3 имеет достаточно большую активность и создает серную кислоту, взаимодействуя с водой:
- SO3+H2O = H2SO4.
Вступает в реакции взаимодействия с хлороводородом и образует хлоросульфатную кислоту:
- SO3+HCl = HSO3Cl.
Для оксида серы характерным является проявление сильных окислительных свойств.
Применение серный ангидрид находит в создании серной кислоты. Небольшое его количество выделяется в окружающую среду во время использования серных шашек. SO3, образуя серную кислоту после взаимодействия с влажной поверхностью, уничтожает разнообразные опасные организмы, например грибки.
Подводя итоги
Оксид серы может находиться в разных агрегатных состояниях, начиная с жидкости и заканчивая твердой формой. В природе встречается редко, а способов его получения в промышленности довольно много, как и сфер, где его можно использовать. Сам оксид имеет три формы, в которых он проявляет различную степень валентности. Может быть очень токсичным и вызывать серьезные проблемы со здоровьем.
Источник
