Какими свойствами обладает оксид хрома

Хромовый ангидрид, хранящийся в герметичном сосуде
Окси́д хро́ма(VI) (триоксид хрома, трёхокись хрома, хромовый ангидрид), CrO3 — соединение хрома с кислородом, тёмно-красные кристаллы, хорошо растворимые в воде. Ангидрид хромовой и дихромовой кислот.
Свойства[править | править код]
Физические свойства[править | править код]
Чёрно-красные с фиолетовым оттенком кристаллы — пластины или иголки. Гигроскопичен, расплывается на воздухе.
tпл=196 °C, при атмосферном давлении разлагается ниже температуры кипения.
Плотность 2,8 г/см³; Растворимость в воде — 166 г/100 г (15 °C), 199 г/100 г (100 °C).
Химические свойства[править | править код]
CrO3 — кислотный оксид. При его растворении в воде образуется хромовая кислота (при недостатке CrO3):
или дихромовая кислота (при избытке CrO3):
При взаимодействии CrO3 со щелочами образуются хроматы:
При нагревании выше 250 °C разлагается с образованием оксида хрома(III) и кислорода:
Как и все соединения Cr(VI), CrO3 является сильным окислителем (восстанавливается до Cr2O3). Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с предварительно измельченным до состояния порошка оксидом хрома VI (хотя некоторые справочники указывают «растворим в спирте и эфире»). Без тщательного измельчения кристаллов хромового ангидрида добиться воспламенения спиртов и кетонов при контакте с ним невозможно. Окисляет иод, серу, фосфор, уголь, например:
Комплекс триоксида хрома с пиридином используется для окисления спиртов в соответствующие карбонильные соединения (реакция Саретта).
Получение[править | править код]
Получают действием H2SO4 на дихромат натрия Na2Cr2O7 (реже дихромат калия K2Cr2O7).
Применение[править | править код]
Используется для получения хрома электролизом, электролитического хромирования; хроматирования оцинкованных деталей, в качестве сильного окислителя, изредка в пиросоставах.
Применяют также, как окислитель в органической химии (в производстве изатина, индиго и т. д.).
В смеси с кизельгуром применяется для очистки ацетилена под названием «эпурит».
Растворы хромового ангидрида (или, чаще, дихромата калия) в серной кислоте широко используются в лабораторной практике для очистки посуды от органических загрязнений (хромовая смесь).
Токсичность[править | править код]
Оксид хрома(VI) очень ядовит и канцерогенен, как и многие другие соединения шестивалентного хрома. Летальная доза для человека при попадании внутрь 0,08 г/кг.
Хромовый ангидрид — весьма химически активное вещество, способен вызвать при соприкосновении с органическими веществами возгорания и взрывы. Сам негорюч, но воспламеняет бензин при комнатной температуре и используется в качестве воспламенителя топлива в ракетной технике. При попадании на кожу вызывает сильные раздражения, экземы и дерматиты, а также может спровоцировать развитие рака кожи. Даже при своевременном удалении с кожных покровов оставляет пятна коричневого цвета. Весьма опасно вдыхание паров хромового ангидрида, хотя он и малолетуч.
Для хранения его применяется стеклянная или фарфоровая герметичная посуда, необходимо исключение контакта с органическими веществами. Работа с ним требует применения спецодежды и средств индивидуальной защиты.
Источник

Элемент хром расположен в четвертом периоде и побочной подгруппе VI группы Периодической системы. Атом хрома имеет электронную конфигурацию $1s^22s^22p^63s^23p^63d^54s^1$. Обратите внимание на провал электрона: подобно другим элементам шестой группы в соединениях хром проявляет максимальную степень окисления +6, однако наиболее устойчив в более низкой степени окисления +3.
Элемент хром был обнаружен в природном минерале в конце XVIII века. Тогда же были получены его соли, яркая и разнообразная окраска которых и объясняет данное элементу название – оно происходит от греческого слова “chroma” – цвет, краска.
Нахождение в природе и получение
В природе встречается преимущественно в виде двойного оксида – хромистого железняка $FeCr_2O_4$, переработкой которого и получают металл. Восстановление хромистого железняка углем в электрических дуговых печах приводит к феррохрому – сплаву железа и хрома:
$FeCr_2O_4 + 4C xrightarrow[]{t, ^circ C} Fe + 2Cr + 4CO$
Содержание хрома в нем может достигать 70%. Феррохром используют для производства хромированной стали. Металл не содержащий железа получают восстановлением оксида алюминием:
$Cr_2O_3 + 2Al xrightarrow[]{t, ^circ C} Al_2O_3 + 2Cr$
Метод алюмотермии был разработан в конце XIX века как раз для производства хрома. Наиболее чистый хром получают электролизом растворов.
Физические свойства
В свободном виде хром – довольно тяжелый серебристо-белый тугоплавкий (т. пл. $1875^0C$, т. кип. $2680^0C$) металл, обладающий высокой твердостью – он царапает стекло. Чистый хром пластичен, однако даже незначительные примеси кислорода, азота и углерода делают его хрупким. Такой металл при ударе молотком легко раскалывается. Значительное влияние даже ничтожного количества примесей на физические свойства характерно и для большинства других переходных металлов.
Химические свойства хрома
При комнатной температуре хром малоактивен. В отличие от железа он не окисляется и не тускнеет даже при хранении на влажном воздухе и в воде. С этим качеством хрома связано его использование в борьбе с коррозией железа. Металлический хром используют в виде хромированного покрытия или добавляют при производстве нержавеющей стали. Лишь раскаленный до высокой температуры хром сгорает в кислороде с образованием темно-зеленого порошка оксида хрома(III):
$4Cr + 3O_2 = 2Cr_2O_3$
. Выше 600°C хром реагирует с хлором и бромом, также давая соединения хрома(III).
Хотя в ряду напряжений хром расположен левее водорода, он не окисляется даже на влажном воздухе благодаря образованию на поверхности тонкой прозрачной пленки оксида. В разбавленных кислотах хром растворяется, образуя красивые ярко-синие растворы солей хрома(II), устойчивые лишь в отсутствие кислорода воздуха:
$Cr + 2HCl = CrCl_2 + H_2$
В присутствии кислорода воздуха образуются соли хрома (III):
$4Cr + 12HCl + 3O_2 = 4CrCl_3 + 6H_2O$
При комнатной температуре хром не реагирует с концентрированными растворами кислот-окислителей – серной и азотной. При нагревании с этими кислотами образуются соли хрома(III):
$2Cr + 6H2SO_{4textrm{(конц.)}} xrightarrow[]{t, ^circ C} Cr_2(SO_4)_3 + underline{3SO_2uparrow} + 6H_2O$
$Cr + 6HNO_{3textrm{(конц.)}} xrightarrow[]{t, ^circ C} Cr(NO_3)_3 + underline{3NO_2uparrow} + 3H_2O$
Подобно многим другим переходным металлам хром образует несколько рядов соединений, отвечающих различным степеням окисления.
СОЕДИНЕНИЯ ХРОМА(II)
Ярко-синие растворы солей хрома(II), образующиеся при растворении металла с разбавленных кислотах в атмосфере азота, на воздухе мгновенно окисляются до хрома(III), что сопровождается изменением окраски на серо-фиолетовую или зеленую:
$4CrCl_2 + O_2 + 4HCl = 4CrCl_3 + 2H_2O$
Cr2+ – e– -> Cr3+ |1 4| окисление, $CrCl_2$– восстановитель за счет Cr2+
O20 + 4e– -> 2O2– |4 1| восстановление, O20 – окислитель
$4Cr^{2+} + O_2^0 = 4Cr^{3+} + 2O^{2–}$
Это свидетельствует о том, что хром в степени окисления +2 является сильным восстановителем.
При действии на соли хрома(II) растворами щелочей выпадает желтый осадок гидроксида, не реагирующий с избытком щелочи, то есть проявляющий основные свойства:
$CrCl_2 + 2NaOH = Cr(OH)_2downarrow+ 2NaCl$
Соответствующий ему оксид CrO также является основным.
Соединения хрома(III)
Одно из важнейших соединений хрома(III) – оксид $Cr_2O_3$ – представляет собой темно-зеленый порошок, нерастворимый в воде. В природе он встречается в виде минерала хромовой охры. На основе этого вещества изготавливают полировальные пасты.
Оксид и гидроксид хрома(III) реагируют как с кислотами, так и с щелочами, что доказывает их амфотерность. При растворении гидроксида хрома в кислотах образуются соли хрома(III) окрашенные в темно-зеленый или в фиолетовый цвет:
$2Cr(OH)_3 + 3H_2SO_4 = Cr_2(SO_4)_3 + 6H_2O$
Из фиолетового раствора, полученного добавлением к раствору сульфата хрома(III) сульфата калия на холоду кристаллизуются темно-фиолетовые октаэдрические кристаллы хромокалиевых квасцов $KCr(SO_4)_2cdot12H_2O$ – двойного сульфата хрома-калия. Раньше их использовали для выделки кож. При действии на раствор хромокалиевых квасцов ортофосфата аммония выпадает зеленый осадок фосфата хрома(III) $CrPO_4$. Соли хрома(III) и слабых кислот – сероводородной, угольной, сернистой, кремниевой – не удается осадить из водных растворов вследствие полного необратимого гидролиза. Если к зеленому раствору хлорида хрома(III) прибавить раствор сульфида натрия наблюдается выделение сероводорода и выпадение серо-зеленого осадка гидроксида:
$2CrCl_3 + 3Na_2S + 6H_2O = 2Cr(OH)_3downarrow + 6NaCl + 3H_2Suparrow$
При растворении гидроксида хрома(III) в щелочах образуются изумрудно-зеленые растворы хромитов:
$Cr(OH)_3 + 3KOH _{textrm{(водн.)}} = K_3[Cr(OH)_6]$
Сплавлением оксида хрома(III) с щелочами или карбонатами щелочных металлов получают хромиты другого состава, например, $NaCrO_2$:
$Cr_2O_3 + 2NaOH xrightarrow[]{t, ^circ C} 2NaCrO_2 + H_2O$
$Cr_2O_3 + Na_2CO_3 xrightarrow[]{t, ^circ C} 2NaCrO_2 + CO_2$
При действии кислот хромиты разрушаются:
при недостатке кислоты превращаясь в гидроксид хрома(III) $NaCrO_2 + HCl + H_2O = Cr(OH)_3downarrow + NaCl$
в избытке кислоты образуя соли $NaCrO_2 + 4HCl = CrCl_3 + NaCl + 2H_2O$
Степень окисления +3 для хрома наиболее устойчива, поэтому соединения хрома(III) могут быть восстановлены до хрома(II) лишь под действием сильных восстановителей:
$2CrCl_3 + Zn = 2CrCl_2 + ZnCl2$
Сильные окислители, например, пероксид водорода или бром в щелочной среде переводят соединения хрома(III) в соединения хрома(VI):
$2Cr(OH)_3 + 3Br_2 + 10NaOH = 2Na_2CrO_4 + 6NaBr + 8H_2O$
О протекании реакции свидетельствует появление желтого окрашивания раствора. Хроматы – это соли хромовой кислоты $H_2CrO_4$, известной лишь в разбавленных водных растворах.
СОЕДИНЕНИЯ ХРОМА(VI)
Хромат-ионы $CrO_4^{2-}$ устойчивы лишь в щелочной среде, а при подкислении переходят в оранжевые бихроматы, соли двухромовой кислоты $H_2Cr_2O_7$:
$2CrO_4^{2-}+ 2H^+ leftrightarrow Cr_2O_7^{2–} + H_2O$
Реакция обратима, поэтому при добавлении щелочи желтая окраска хромата восстанавливается:
$Cr_2O_7^{2–} + 2OH^- leftrightarrow 2CrO_4^{2-}+ H_2O$
$textrm{оранжевый} Leftrightarrow textrm{желтый}$
$Cr_2O_7^{2–} xrightarrow [OH^-]{H^+}CrO_4^{2-}$
$textrm{дихромат} Leftrightarrow textrm{хромат}$
Добавление к раствору бихромата калия $K_2Cr_2O_7$ концентрированной серной кислоты приводит к выделению ярко-красного осадка хромового ангидрида $CrO_3$:
$Na_2Cr_2O_7 + 2H_2SO_{4textrm{(конц.)}}= 2NaHSO_4 + 2CrO_3 + H_2O$
Оксид хрома(VI) является кислотным оксидом: с водой образует соответствующие кислоты:
$CrO_3 + H_2O = H_2CrO_4$
$2CrO_3 + H_2O = H_2Cr_2O_7$
Как типичный кислотный оксид $CrO_3$ реагирует с щелочами и основными оксидами с образованием хроматов:
$CrO_3 + BaO = BaCrO_4$
$CrO_3 + 2NaOH = Na_2CrO_4 + H_2O$
Соединения хрома(VI) – сильные окислители. Хромовый ангидрид воспламеняет этиловый спирт, легко окисляет многие органические вещества. Раствор бихромата калия в крепкой серной кислоте называют хромовой смесью. Ее часто применяют в химических лабораториях для мытья посуды. Благодаря входящему в ее состав бихромату хромовая смесь проявляет сильные окислительные свойства. Убедимся в этом на опыте. Пропустим через хромовую смесь сероводород. Оранжевая окраска раствора быстро сменяется на темно-зеленую, наблюдается выпадение осадка серы:
$3H_2S + K_2Cr_2O_7 + 4H2SO4 = 3S + Cr_2(SO_4)_3 + K_2SO_4 + 7H_2O$
Бихроматы проявляют окислительные свойства не только в растворах, но и в твердом виде. Так, при спекании с серой или углем они восстанавливаются:
$Na_2Cr_2O_7 + S xrightarrow[]{t, ^circ C}Na_2SO_4 + Cr_2O_3$
Эти реакции используют для получения оксида хрома(III).
Хроматы и бихроматы некоторых металлов используют в качестве желтых, красных и оранжевых пигментов.
Генетический ряд хрома
Изучение химии соединений хрома в различных степенях окисления позволяет проследить закономерности изменения кислотно-основных и окислительно-восстановительных свойств в ряду Cr(II) – Cr(III) – Cr(VI).
Запомнить! Оксид и гидроксид хрома(II) обладают основными свойствами, соединения хрома (III) амфотерны, а хрома(VI) – кислотные.
Соединения хрома(II) – типичные восстановители, а соединения хрома в высшей степени окисления – типичные окислители. Для соединений хрома(III) характерны и окислительные, и восстановительные свойства.
| Cr(II) | Cr(III) | Cr(VI) |
|---|---|---|
| CrO | $Cr_2O_3$ | $CrO_3$ |
| $ Cr(OH)_2$ | $Cr(OH)_3$ | $ H_2CrO_4, H_2Cr_2O_7$ |
Соли – с кислотами $Cr^{2+}$ | Соли – с кислотами $Cr^{3+}$ Гидроксокомплексы: $[Cr(OH)_6]^{3-}$ | Хроматы $Na_2CrO_4$ Дихроматы $K_2Cr_2O_7$ |
| основный характер | амфотерный характер | кислотный характер |
| типичные восстановители | могут проявлять и окислительные и восстановительные свойства | типичные окислители |
$xrightarrow[]{textrm{кислотные свойства возрастают}}$ | ||
$xleftarrow[]{textrm{ восстановительные свойства возрастают}}$ | ||
Восстановительные свойства хрома(II) ярче всего проявляются в кислой среде, а окислительные свойства хрома(VI) – в щелочной.
Все соединения хрома, особенно в высшей степени окисления, ядовиты!
Источник
Среди многообразия химических элементов и их соединений сложно выделить наиболее полезное для человечества вещество. Каждое уникально по своим свойствам и возможностям применения. Технический прогресс значительно облегчает исследовательский процесс, но и ставит перед ним новые задачи. Химические элементы, открытые несколько сотен лет назад и изученные во всех проявлениях, получают в современном мире более технологичные направления использования. Данная тенденция распространяется на соединения, существующие в природе и созданные людьми.
Оксид
В земной коре и на просторах Вселенной существует множество химических соединений, которые отличаются по классам, типам, характеристикам. Одним из самых распространенных видов соединений является оксид (окись, окисел). К нему относят песок, воду, углекислый газ, т. е. основополагающие вещества для существования человечества и всей биосферы Земли. Оксидами называют вещества, которые имеют в составе атомы кислорода со степенью окисления -2, при этом связь между элементами является бинарной. Их образование происходит в результате химической реакции, условия которой разнятся в зависимости от состава оксида.
Характерными признаками данного вещества являются три позиции: вещество сложное, состоит из двух атомов, один из них – кислород. Большое количество существующих оксидов объясняется тем, что многие химические элементы образуют несколько веществ. Они идентичны по составу, но атом, вступающий в реакцию с кислородом, проявляет несколько степеней валентности. Например, оксид хрома (2, 3, 4, 6), азота (1, 2, 3, 4 ,5) и т. д. При этом их свойства зависят от степени валентности элемента, вступающего в окислительную реакцию.
По принятой классификации оксиды бывают основными и кислотными. Также выделяется амфотерный вид, который проявляет свойства основного окисла. Кислотные оксиды – это соединения неметаллов или элементов с высокой валентностью, их гидратами являются кислоты. К основным окислам относят все вещества, имеющие связь кислород + металл, их гидратами являются основания.

Хром
В 18 веке химик И. Г. Леман обнаружил неизвестный минерал, который был назван красным сибирским свинцом. Профессор Парижской минералогической школы Вокелен провел ряд химических реакций с полученным образцом, в результате которых был выделен неизвестный металл. Основными свойствами, обозначенными ученым, стали его устойчивость к кислотным средам и тугоплавкость (жаропрочность). Название “хром” (Chromium) возникло из-за широкой цветовой гаммы, которая характеризуется соединениям элемента. Металл достаточно инертен, в чистом виде не встречается в природных условиях.
Основными минералами, содержащими хром, являются: хромит (FeCr2O4), меланохроит, вокеленит, дитцеит, тарапакаит. Химический элемент Cr располагается в 6 группе периодической системы Д. И. Менделеева, имеет атомный номер 24. Электронная конфигурация атома хрома позволяет элементу иметь валентность +2, +3, +6, при этом наиболее устойчивыми являются соединения трехвалентного металла. Возможны реакции, при которых степень окисления равна +1, +5, +4. Хром химически не активен, поверхность металла покрывается пленкой (эффект пассивирования), предотвращающей реакции с кислородом и водой при нормальных условиях. Оксид хрома, образующийся на поверхности, предохраняет металл от взаимодействия с кислотами и галогенами при отсутствии катализаторов. Соединения с простыми веществами (не металлами) возможны при температуре от 300 оС (хлор, бром, сера).
При взаимодействии со сложными веществами требуются дополнительные условия, например, с раствором щелочи реакция не происходит, с ее расплавами процесс происходит очень медленно. С кислотами хром вступает в реакцию при наличии в качестве катализатора высокой температуры. Оксид хрома можно получить из различных минералов путем воздействия температуры. В зависимости от будущей степени окисления элемента применяются концентрированные кислоты. При этом валентность хрома в соединении варьируется от +2 до +6 (высший оксид хрома).

Применение
За счет уникальных антикоррозийных свойств и жаропрочности большое практическое значение имеют сплавы на основе хрома. При этом в процентном соотношении его доля не должна превышать половины общего объема. Большим недостатком хрома является его хрупкость, что уменьшает возможности обработки сплавов. Наиболее распространенным способом применения металла является изготовление покрытий (хромирование). Защитная пленка может составлять слой в 0,005 мм, но она будет надежно предохранять металлическое изделие от коррозии и внешних воздействий. Соединения хрома используются для изготовления жаропрочных конструкций в металлургической промышленности (плавильные печи). Антикоррозийные покрытия декоративного направления (металлокерамика), специальная легированная сталь, электроды для сварочных аппаратов, сплавы на основе кремния, алюминия являются востребованными на мировых рынках. Оксид хрома за счет низкой возможности окисления и высокой жаропрочности служит катализатором многих химических реакций, протекающих при высоких температурах (1000 оС).

Двухвалентные соединения
Оксид хрома (2) CrO (закись) является порошком ярко-красного или черного цвета. В воде нерастворим, при нормальных условиях не окисляется, проявляет ярко выраженные основные свойства. Вещество твердое, тугоплавкое (1550 оС), не является токсичным. В процессе нагревания до 100 оС окисляется до Cr2O3. В слабых растворах азотной и серной кислот не растворяется, реакция происходит с хлороводородной кислотой.

Получение, применение
Данное вещество считается низшим оксидом. Имеет достаточно узкую сферу применения. В химической промышленности оксид хрома 2 используется для очистки углеводородов от кислорода, который он притягивает в процессе окисления при температуре свыше 100 оС. Получить закись двухвалентного хрома можно тремя способами:
- Разложением карбонила Cr(CO)6 при наличии в качестве катализатора высокой температуры.
- Восстанавливая при помощи фосфорной кислоты оксид хрома 3.
- Амальгама хрома окисляется кислородом или азотной кислотой.
Трехвалентные соединения

Для оксидов хрома степень окисления +3 является самой устойчивой формой вещества. Cr2O3 (хромовая зелень, сесквиоксид, эсколаид) в химическом отношении инертен, нерастворим в воде, имеет высокую температуру плавления (более 2000 оС). Оксид хрома 3 – зеленый тугоплавкий порошок, очень твердый, имеет амфотерные свойства. Вещество растворимо в концентрированных кислотах, реакция со щелочами происходит в результате сплавления. Может восстанавливаться до чистого металла при взаимодействии с сильным восстановителем.
Получение и применение
За счет высокой твердости (сопоставимой с корундом) наиболее распространено использование вещества в абразивных и полирующих материалах. Оксид хрома (формула Cr2O3) имеет зеленый цвет, поэтому его применяют в качестве пигмента при изготовлении стекол, красок, керамики. Для химической промышленности данное вещество используется как катализатор для протекания реакций с органическими соединениями (синтез аммиака). Трехвалентный оксид хрома применяется для создания искусственных драгоценных камней и шпинелей. Для получения используется несколько видов химических реакций:
- Окисление закиси хрома.
- Нагревание (прокаливанием) бихромата или хромата аммония.
- Разложение гидроксида трехвалентного хрома или шестивалентного оксида.
- Прокаливание хромата или бихромата ртути.
Шестивалентные соединения
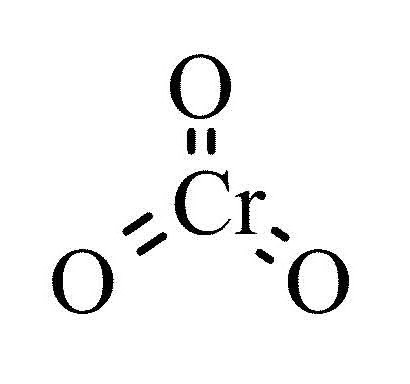
Формула высшего оксида хрома – CrO3. Вещество фиолетового или темно-красного цвета, может существовать в виде кристаллов, игл, пластин. Химически активен, токсичен, при взаимодействии с органическими соединениями существует опасность самовозгорания и взрыва. Оксид хрома 6 – хромовый ангидрид, трёхокись хрома – хорошо растворим в воде, при нормальных условиях взаимодействует с воздухом (расплывается), температура плавления – 196 оС. Вещество имеет ярко выраженные кислотные характеристики. При химической реакции с водой образуется дихромовая или хромовая кислота, без дополнительных катализаторов взаимодействует со щелочами (хроматы желтого цвета). Для галогенов (йод, сера, фосфор) является сильным окислителем. В результате нагревания свыше 250 оС образуется свободный кислород и трехвалентный оксид хрома.

Как получают и где применяют
Оксид хрома 6 получают обработкой хроматов (бихроматов) натрия или калия концентрированной серной кислотой либо при реакции хромата серебра с хлороводородной кислотой. Высокая химическая активность вещества обуславливает основные направления его применения:
- Получение чистого металла – хрома.
- В процессе хромирования поверхностей, в том числе электролитическим способом.
- Окисление спиртов (органических соединений) в химической промышленности.
- В ракетной технике используется в качестве воспламенителя топлива.
- В химических лабораториях очищает посуду от органических соединений.
- Используется в пиротехнической отрасли.
Источник
