Какими свойствами обладает гелий

Гелий – инертный газ 18-й группы периодической таблицы. Это второй самый легкий элемент после водорода. Гелий – газ без цвета, запаха и вкуса, который становится жидким при температуре -268.9 °C. Точки кипения и замерзания его ниже, чем у любого другого известного вещества. Это единственный элемент, который не затвердевает при охлаждении при нормальном атмосферном давлении. Чтобы гелий перешел в твердое состояние, необходимо 25 атмосфер при температуре 1 К.
История открытия
Гелий был найден в газовой атмосфере, окружающей Солнце, французским астрономом Пьером Жансеном, который в 1868 году во время затмения обнаружил яркую желтую линию в спектре солнечной хромосферы. Первоначально предполагалось, что эта линия представляла элемент натрий. В том же году английский астроном Джозеф Норман Локьер наблюдал желтую линию в солнечном спектре, которая не соответствовала известным линиям натрия D1 и D2, и поэтому он назвал ее линией D3. Локьер пришел к выводу, что она была вызвана веществом на Солнце, неизвестном на Земле. Он и химик Эдуард Франкленд в названии элемента использовали греческое название Солнца «гелиос».
В 1895 году британский химик сэр Уильям Рамзай доказал существование гелия на Земле. Он получил образец ураноносного минерала клевеита, и после исследования газов, образовавшихся при его нагреве, он обнаружил, что ярко-желтая линия в спектре совпадает с линией D3, наблюдаемой в спектре Солнца. Таким образом, новый элемент был окончательно установлен. В 1903 году Рамзи и Фредерик Содду определили, что гелий является продуктом спонтанного распада радиоактивных веществ.

Распространение в природе
Масса гелия составляет около 23% всей массы Вселенной, и элемент является вторым по распространенности в космосе. Он сосредоточен в звездах, где образуется из водорода в результате термоядерного синтеза. Хотя в земной атмосфере гелий находится в концентрации 1 часть на 200 тыс. (5 промилле) и в небольших количествах содержится в радиоактивных минералах, метеоритном железе, а также в минеральных источниках, большие объемы элемента встречаются в Соединенных Штатах (особенно в Техасе, Нью-Мексико, Канзасе, Оклахоме, Аризоне и Юте) в качестве компонента (до 7,6%) природного газа. Небольшие его запасы были обнаружены в Австралии, Алжире, Польше, Катаре и России. В земной коре концентрация гелия равна лишь около 8 частей на миллиард.
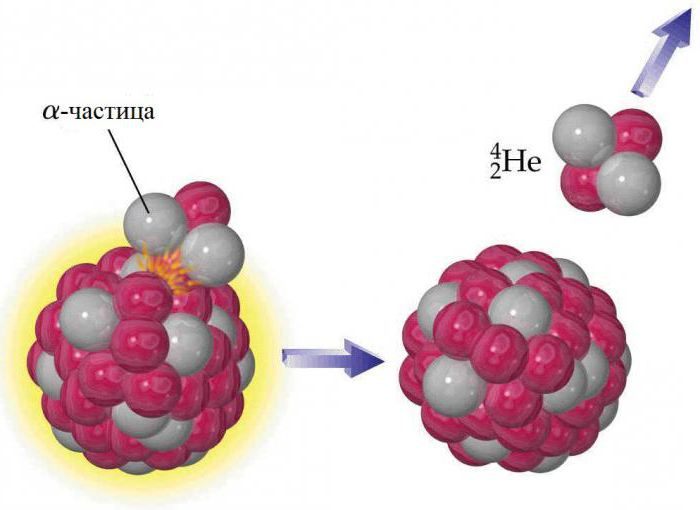
Изотопы
Ядро каждого атома гелия содержит два протона, но, как и у других элементов, у него есть изотопы. Они содержат от одного до шести нейтронов, поэтому их массовые числа находятся в диапазоне от трех до восьми. Стабильными из них являются элементы, у которых масса гелия определяется атомными числами 3 (3He) и 4 (4He). Все остальные радиоактивны и очень быстро распадаются на другие вещества. Земной гелий не является изначальной составляющей планеты, он образовался в результате радиоактивного распада. Альфа-частицы, испускаемые ядрами тяжелых радиоактивных веществ, представляют собой ядра изотопа 4He. Гелий не накапливается в больших количествах в атмосфере, потому что гравитации Земли недостаточно, чтобы предотвратить его постепенную утечку в космос. Следы 3He на Земле объясняются отрицательным бета-распадом редкого элемента водорода-3 (трития). 4He является наиболее распространенным из стабильных изотопов: соотношение числа атомов 4He к 3He составляет около 700 тыс. к 1 в атмосфере и около 7 млн к 1 в некоторых гелийсодержащих минералах.
Физические свойства гелия
Температура кипения и плавления у этого элемента самые низкие. По этой причине гелий существует в виде газа, за исключением экстремальных условий. Газообразный He в воде растворяется меньше, чем какой-либо другой газ, а скорость диффузии через твердые тела в три раза больше, чем у воздуха. Его показатель преломления ближе всего приближается к 1.
Теплопроводность гелия уступает лишь теплопроводности водорода, а его удельная теплоемкость необычайно высокая. При обычных температурах при расширении он нагревается, а ниже 40 K – охлаждается. Поэтому при Т<40 K гелий можно превратить в жидкость путем расширения.
Элемент является диэлектриком, если не находится в ионизированном состоянии. Как и у других благородных газов, у гелия есть метастабильные энергетические уровни, которые позволяют ему оставаться ионизированным в электрическом разряде, когда напряжение остается ниже потенциала ионизации.
Гелий-4 уникален тем, что обладает двумя жидкими формами. Обычная называется гелий I и существует при температурах от точки кипения 4,21 К (-268,9 °C) до около 2,18 К (-271 °C). Ниже 2,18 K теплопроводность 4He становится в 1000 раз больше, чем у меди. Эта форма называется гелий II, чтобы отличить ее от обычной. Она обладает сверхтекучестью: вязкость настолько низкая, что не может быть измерена. Гелий II растекается в тонкую пленку на поверхности любого вещества, которого касается, и эта пленка течет без трения даже против силы тяжести.
Менее обильный гелий-3 образует три различные жидкие фазы, две из которых сверхтекучи. Сверхтекучесть в 4He была обнаружена советским физиком Петром Леонидовичем Капицей в середине 1930-х годов, и такое же явление в 3He было впервые замечено Дугласом Д. Ошеровым, Дэвидом М. Ли, и Робертом С. Ричардсоном из США в 1972 году.
Жидкая смесь двух изотопов гелия-3 и -4 при температурах ниже 0,8 К (-272.4 °C) разделяется на два слоя – практически чистого 3He и смеси 4He с 6% гелия-3. Растворение 3He в 4He сопровождается охлаждающим эффектом, который используется в конструкции криостатов, в которых температура гелия опускается ниже 0,01 К (-273,14 °C) и поддерживается такой в течение нескольких дней.

Соединения
В нормальных условиях гелий химически инертен. В экстремальных можно создать соединения элемента, которые при нормальных показателях температуры и давления не являются стабильными. Например, гелий может образовывать соединения с йодом, вольфрамом, фтором, фосфором и серой, когда он подвергается действию электрического тлеющего разряда при бомбардировке электронами или в состоянии плазмы. Таким образом, были созданы HeNe, HgHe10, WHe2 и молекулярные ионы Не2+, Не2++, HeH+ и HeD+. Эта техника также позволила получить нейтральные молекулы Не2 и HgHe.
Плазма
Во Вселенной преимущественно распространен ионизированный гелий, свойства которого существенно отличаются от молекулярного. Электроны и протоны его не связаны, и он обладает очень высокой электропроводностью даже в частично ионизированном состоянии. На заряженные частицы сильное воздействие оказывают магнитные и электрические поля. Например, в солнечном ветре ионы гелия вместе с ионизированным водородом взаимодействуют с магнитосферой Земли, вызывая северные сияния.

Открытие месторождений в США
После бурения скважины в 1903 году в Декстере, штат Канзас, был получен негорючий газ. Первоначально не было известно, что в нем содержится гелий. Какой газ был найден, определил геолог штата Эразмус Хаворт, который собрал его образцы и в университете Канзаса с помощью химиков Кэди Гамильтона и Дэвида Макфарланда обнаружил, что тот содержит 72% азота, 15% метана, 1% водорода и 12% не было идентифицировано. Проведя последующие анализы, ученые обнаружили, что 1,84% пробы составляет гелий. Так узнали о том, что данный химический элемент присутствует в огромных количествах в недрах Великих равнин, откуда его можно извлечь из природного газа.
Промышленное производство
Это сделало Соединенные Штаты лидером мирового производства гелия. По предложению сэра Ричарда Трельфалла, ВМС США профинансировали три небольших экспериментальных завода для получения этого вещества во время Первой мировой войны с целью обеспечить заградительные аэростаты легким негорючим подъемным газом. По данной программе были произведены в общей сложности 5700 м3 92-процентного He, хотя до этого были получены лишь менее 100 л газа. Часть этого объема была использована в первом в мире гелиевом дирижабле ВМФ США С-7, который совершил свой первый рейс из Хэмптон-Роудс (штат Вирджиния) в Боллинг-Филд (Вашингтон, округ Колумбия) 7 декабря 1921 года.
Хотя процесс низкотемпературного сжижения газа в то время не был достаточно разработан, чтобы оказаться существенным во время Первой мировой войны, производство продолжалось. Гелий в основном использовался в качестве подъемного газа в летательных аппаратах. Спрос на него вырос во время Второй мировой войны, когда его стали применять при экранированной дуговой сварке. Элемент также имел важное значение в проекте создания атомной бомбы «Манхэттен».

Национальный запас США
В 1925 году правительство Соединенных Штатов создало Национальный запас гелия в Амарилло, штат Техас, с целью обеспечения военных дирижаблей во время войны и коммерческих воздушных кораблей в мирное время. Использование газа после Второй мировой сократилось, но запас был увеличен в 1950-х годах для обеспечения, среди прочего, его поставок в качестве теплоносителя, применяемого в производстве кислородно-водородного ракетного топлива в период космической гонки и холодной войны. Использование гелия в США в 1965 году в восемь раз превысило пиковое потребление военного времени.
После принятия закона о гелии 1960 года Горное бюро подрядило 5 частных предприятий для извлечения элемента из природного газа. Для этой программы был построен 425-км газопровод, соединивший эти заводы с правительственным частично истощенным газовым месторождением неподалеку от Амарилло в Техасе. Гелий-азотная смесь закачивалась в подземное хранилище и оставалась там, пока в ней не возникала необходимость.
К 1995 году был собран запас объемом миллиард кубометров, а задолженность Национального резерва составила 1,4 млрд долларов, что побудило Конгресс США в 1996 г. поэтапно отказаться от него. После принятия в 1996 г. закона о приватизации гелия Министерство природных ресурсов приступило к ликвидации хранилища в 2005 году.

Чистота и объемы производства
Гелий, произведенный до 1945 года, имел чистоту около 98%, остальные 2% приходились на азот, что было достаточным для дирижаблей. В 1945 г. было произведено небольшое количество 99,9-процентного газа для использования в дуговой сварке. К 1949 г. чистота получаемого элемента достигла 99,995%.
На протяжении многих лет Соединенные Штаты производили более 90% мирового объема коммерческого гелия. Начиная с 2004 года, ежегодно его вырабатывалось 140 млн м3, 85% из которых приходится на США, 10% производилось в Алжире, а остальное – в России и Польше. Основными источниками гелия в мире являются газовые месторождения Техаса, Оклахомы и Канзаса.
Процесс получения
Гелий (чистотой 98,2%) выделяют из природного газа путем сжижения других компонентов при низких температурах и при высоких давлениях. Адсорбция других газов охлажденным активированным углем позволяет добиться чистоты 99,995%. Небольшой объем гелия производится при сжижении воздуха в больших масштабах. Из 900 т воздуха можно получить около 3,17 куб. м газа.

Сферы применения
Благородный газ нашел применение в разных областях.
- Гелий, свойства которого позволяют получать сверхнизкие температуры, используется как охлаждающий агент в Большом адронном коллайдере, сверхпроводящих магнитах аппаратов МРТ и спектрометров ядерного магнитного резонанса, спутниковой аппаратуры, а также для сжижения кислорода и водорода в ракетах «Аполлон».
- В качестве инертного газа для сварки алюминия и др. металлов, при производстве оптоволокна и полупроводников.
- Для создания давления в топливных баках ракетных двигателей, особенно тех, которые работают на жидком водороде, т. к. только гелий газообразный сохраняет свое агрегатное состояние, когда водород остается жидким);
- He-Ne газовые лазеры используются для сканирования штрих-кодов на кассах в супермаркетах.
- Гелий-ионный микроскоп позволяет получить лучшие изображения, чем электронный.
- Благодаря высокой проницаемости благородный газ используется для проверки утечек, например, в системах кондиционирования воздуха автомобилей, а также для быстрого наполнения подушек безопасности при столкновении.
- Низкая плотность позволяет наполнять декоративные шары с гелием. Инертный газ заменил взрывоопасный водород в дирижаблях и воздушных шарах. Например, в метеорологии, шары с гелием используются для подъема измерительных приборов.
- В криогенной технике служит теплоносителем, поскольку температура этого химического элемента в жидком состоянии минимально возможная.
- Гелий, свойства которого обеспечивают ему низкую реактивность и растворимость в воде (и крови), в смеси с кислородом нашел применение в дыхательных составах для подводного плавания с аквалангом и проведения кессонных работ.
- Метеориты и горные породы анализируются на содержание данного элемента для определения их возраста.
Гелий: свойства элемента
Основные физические свойства He следующие:
- Атомный номер: 2.
- Относительная масса атома гелия: 4,0026.
- Точка плавления: нет.
- Точка кипения: -268,9 °C.
- Плотность (1 атм, 0 °C): 0,1785 г/п.
- Состояния окисления: 0.
Источник
Гелий, свойства атома, химические и физические свойства.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
He 2 Гелий
4,002602(2) 1s2
Гелий — второй элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 2. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), первом периоде периодической системы.
Атом и молекула гелия. Формула гелия. Строение атома гелия
Изотопы и модификации гелия. Гелий-I и гелий-II Гелий-3
Свойства гелия (таблица): температура, плотность, давление и пр.
Физические свойства гелия
Химические свойства гелия. Взаимодействие гелия. Реакции с гелием
Получение гелия
Применение гелия
Таблица химических элементов Д.И. Менделеева
Атом и молекула гелия. Формула гелия. Строение атома гелия:
Гелий (He, лат. helium) – химический элемент VIII группы короткой формы (18-й группы длинной формы) периодической системы химических элементов первого периода системы химических элементов Д. И. Менделеева, с атомным номером 2.
Гелий – неметалл. Гелий возглавляет группу инертных газов в периодической таблицы химических элементов Д. И. Менделеева.
Как простое вещество гелий представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
Молекула гелия одноатомна.
Химическая формула гелия He.
Электронная конфигурация атома гелия 1s2. Потенциал ионизации (первый электрон) атома гелия равен 24,47 эВ (2361,3 кДж/моль).
Строение атома гелия. Атом гелия состоит из положительно заряженного ядра (+2), вокруг которого по атомной оболочке (s-орбитали) движутся два электрона. Поскольку гелий расположен в первом периоде, оболочка всего одна. В свою очередь ядро атома гелия состоит из двух протонов и двух нейтронов.
Радиус атома гелия составляет 31 пм.
Атомная масса атома гелия 4,002602(2) а. е. м. (г/моль).
Гелий – практически инертный химический элемент.
Изотопы и модификации гелия. Гелий-I и гелий-II:
Изотопы гелия – разновидности атомов (и ядер) химического элемента гелия, имеющие разное содержание нейтронов в ядре.
Всего известно на данный момент времени 8 изотопов, но только два из них стабильны. Остальные представляют собой шесть искусственных радиоактивных изотопа.
Природный гелий состоит из двух стабильных изотопов: 4He (изотопная распространённость – 99,99986 %) и гораздо более редкого 3He (0,00014 %, содержание гелия-3 в разных природных источниках может варьировать в довольно широких пределах).
Гелий в атмосфере, почти весь состоящий из тяжёлого нуклида 4He, является продуктом α-распада тяжёлых радиоактивных элементов (урана, тория, актиния), лишь незначительная его часть является реликтовой (то есть захваченной миллиарды лет назад уплотнявшейся космической пылью, из которой образовалась Земля). Ежегодно накапливается в доступных для изучения толщах Земли и вод (25-28)⋅106 м³ гелия.
Содержание 3He в выделенном из атмосферы гелии ничтожно мало, отношение 3He/4He для воздуха равно 1,1⋅10−6, а для гелия из природных газов 1,4⋅10−7. Установлено, что 3He получается в результате β-распада тяжёлого нуклида водорода – трития, который образуется в ряде ядерных реакций в земной коре и верхних слоях атмосферы.
Звёздный гелий (гелий Вселенной) – продукт термоядерной реакции синтеза ядер водорода, протекающей на Солнце и звездах по протон-протонному и углеродно-азотному циклам.
Искусственно получены также другие – тяжёлые радиоактивные изотопы гелия с массовыми числами 5-10:
– 5He, состоящий из двух протонов и трех нейтронов,
– 6He, состоящий из двух протонов и четырех нейтронов,
– 7He, состоящий из двух протонов и пяти нейтронов,
– 8He, состоящий из двух протонов и шести нейтронов.
– 9He, состоящий из двух протонов и семи нейтронов.
– 10He, состоящий из двух протонов и восьми нейтронов.
Свойства гелия (таблица): температура, плотность, давление и пр.:
| Общие сведения | |
| Название | Гелий |
| Прежнее название | |
| Латинское название | Helium |
| Символ | Нe |
| Номер в таблице | 2 |
| Тип | Неметалл |
| Подтип | Инертный газ |
| Открыт | Норман Локьер, Англия, 1868 г., Пьер Жюль Сезар Жансен, Франция, 1868 г. |
| Внешний вид и пр. | Инертный газ без цвета, запаха и вкуса |
| Содержание в атмосфере и воздухе (по массе) | 0,000073 % |
| Содержание в земной коре (по массе) | 5,5×10-10 % |
| Содержание в морях и океанах (по массе) | 7,2×10-10 % |
| Содержание во Вселенной и космосе (по массе) | 23 % |
| Содержание в Солнце (по массе) | 23 % |
| Содержание в организме человека (по массе) | |
| Свойства атома | |
| Атомная масса (молярная масса)* | 4,002602(2) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 |
| Радиус атома (вычисленный) | 31 пм |
| Эмпирический радиус | |
| Ковалентный радиус | 28 пм |
| Радиус иона | 93 пм |
| Радиус Ван-дер-Ваальса | 140 пм |
| Химические свойства | |
| Степени окисления | |
| Валентность | |
| Электроотрицательность | 4,5 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 2372,32 кДж/моль (24,58738880 (15) эВ) |
| Электродный потенциал | 0 |
| Физические свойства | |
| Плотность | 1,785×10-4 г/см3(при 0 °C и нормальных условиях, состояние вещества – газ), 1,7846×10-4 г/см3 (при 20 °C и нормальных условиях, состояние вещества – газ), 0,13 г/см3 (при –269 °C и нормальных условиях, состояние вещества – жидкость) |
| Температура плавления | -272,20 °C (0,95 К, -457,96 °F) (при 2,5 МПа) |
| Температура кипения | -268,928 °C (4,222 K, -452,070 °F) |
| Температура разложения | |
| Температура самовоспламенения смеси газа с воздухом | |
| Удельная теплота плавления (энтальпия плавления ΔHпл) | 0,0138 кДж/моль |
| Удельная теплота испарения (энтальпия кипения ΔHкип) | 0,0829 кДж/моль |
| Удельная теплоемкость при постоянном давлении | |
| Молярная теплоёмкость | 20,78 Дж/(K·моль) |
| Молярный объём | 31,81 см³/моль |
| Теплопроводность (при нормальных условиях) | 0,1513 Вт/(м·К) |
| Теплопроводность (при 300 K) | 0,152 Вт/(м·К) |
| Критическая температура | -267,95 °C (5,1953 К, -450,31 °F) |
| Критическое давление*** | 0,22746 МПа |
| Критическая плотность | 0,0693 г/см3 |
| Тройная точка | -259,35 (13,8033 К), 7,041 кПа |
| Давление паров | 1 мм.рт.ст. (при -271,9°C), 10 мм.рт.ст. (при -271,4°C), 100 мм.рт.ст. (при -270,5°C) |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| Стандартная энтальпия образования ΔH | 0 кДж/моль (при 298 К, для состояния вещества – газ) |
| Стандартная энергия Гиббса образования ΔG | 0 кДж/моль (при 298 К, для состояния вещества – газ) |
| Стандартная энтропия вещества S | 126,04 Дж/(моль·K) (при 298 К, для состояния вещества – газ) |
| Стандартная мольная теплоемкость Cp | 20,79 Дж/(моль·K) (при 298 К, для состояния вещества – газ) |
| Энтальпия диссоциации ΔHдисс | |
| Диэлектрическая проницаемость | 1,000068 (при 0°C), 1,0555 (при -271,095°C) |
| Магнетизм | диамагнитный материал |
| Магнитная восприимчивость | −1,88 ·10−63/моль (при 298 K) |
| Электропроводность в твердой фазе | |
| Удельное электрическое сопротивление | |
| Сверхпроводимость при температуре | |
| Твёрдость по Моосу | |
| Твёрдость по Бринеллю | |
| Твёрдость по Виккерсу | |
| Скорость звука | 1056 м/с (30 °C, состояние вещества – газ), 965 м/с (0 °C, состояние вещества – газ), 237,66 м/с (-272,165 °C, состояние среды – жидкость), 231,4 м/с (-271,39 °C, состояние вещества – жидкость), 221,7 м/с (-270,97 °C, состояние вещества – жидкость), 223,3 м/с (-270,65 °C, состояние вещества – жидкость), 179,8 м/с (-268,93 °C, состояние вещества – жидкость) |
| Поверхностное натяжение | |
| Динамическая вязкость газов и жидкостей | 0,0188 мПа·с (при 0 °C), 0,0229 мПа·с (при 100 °C), 0,0269 мПа·с (при 200 °C), 0,0342 мПа·с (при 400 °C), 0,0407 мПа·с (при 600 °C) |
| Коэффициент теплового расширения | |
| Модуль Юнга | |
| Модуль сдвига | |
| Объемный модуль упругости | |
| Коэффициент Пуассона | |
| Структура решётки | гексагональная |
| Параметры решётки | a = 3,570 Å, c = 5,84 Å |
| Отношение c/a | 1,633 |
| Температура Дебая | |
| Конденсат Бозе-Эйнштейна | |
| Двумерные материалы |
Примечание:
* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
*** Критическое давление гелия согласно httpshttps://chemister.ru/Database/properties.php?dbid=1&id=212 [Россия] составляет 0,229 МПа.
Физические свойства гелия:
При стандартных температуре и давлении гелий – бесцветный, не имеющий запаха и вкуса, нетоксичный, инертный одноатомный газ с химической формулой He.
При нормальных условиях гелий ведёт себя практически как идеальный газ. При всех условиях гелий является моноатомным веществом.
Гелий – лёгкий газ. Гелий легче воздуха в 7,26 раза, но тяжелее водорода. Так, один кубический метр воздуха, который состоит из смеси разных газов, весит 1,293 кг, а один кубический метр гелия 0,178 кг. Поэтому, например, мыльные пузыри, наполненные гелием, на воздухе стремятся вверх. Один кубический метр гелия может поднять предмет массой 1,115 кг.
Плотность гелия (Нe) составляет 0,00017846 г/см3 при 20 °C и нормальных условиях, а при –269 °C плотность жидкого гелия составляет 0,13 г/см3.
Теплопроводность гелия при 300 K составляет 0,152 Вт/(м·К). Гелий обладает большей теплопроводностью, чем у всех других газов, за исключением водорода. Теплопроводность гелия примерно в 6,255 раз выше теплопроводности воздуха – 0,0243 Вт/(м·К).
Гелий (Нe) почти не растворяется в воде и органических растворителях. Так, растворимость гелия в воде составляет 0,000179 г/100 г (при температуре 30 °C).
Гелий не растворяется в металлах, как, например, водород.
Скорость диффузии гелия сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.
При обычных условиях и выше −250 °С при расширении гелий разогревается, а не охлаждается как большинство газов (“нормально” он начинает себя вести ниже −250 оС).
Температура кипения гелия (Нe) составляет −268,928 °C.
Точка кипения гелия (T = 4,222 K для 4He) наименьшая среди всех веществ. При атмосферном давлении гелий не переходит в твёрдую фазу даже при абсолютном нуле.
При 2,17 К и обычном давлении гелий претерпевает фазовый переход второго рода (от гелия I к гелию II), сопровождающийся резким изменением ряда свойств: теплоемкости, вязкости, плотности. Для гелия II (ниже 2,17 K) характерна сверхтекучесть – способность протекать без трения через узкие щели (размером менее 100 нм). У гелия-II отсутствует вязкость. Гелий II также обладает огромной теплопроводностью. Поэтому в отличие от бурно кипящего гелия I, выглядит как спокойная жидкость с ясно видимым мениском. Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только с помощью квантовой механики.
Наглядно сверхтекучесть жидкого гелия проявляется, например, в ходе следующего опыта. Если сверхтекучий жидкий гелий налить в сосуд, он начнет вытекать наружу через его края в направлении более высокой температуры, даже если уровень жидкости сильно ниже краев этого сосуда.
Жидкий гелий практически не растворяет другие вещества.
Гелий – единственное вещество не затвердевающее при обычном давлении даже вблизи 0 K, он кристаллизуется только под давлением выше 2,5 МПа. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при нормальных условиях.
Температура плавления гелия (Нe) при давлении 2,5 МПа составляет −272,2 °C.
При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов на розовый, оранжевый, жёлтый, ярко-жёлтый, жёлто-зелёный и зелёный. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра. Важнейшие линии гелия в видимой части спектра лежат между 706,52 нм и 447,14 нм. Уменьшение давления приводит к увеличению длины свободного пробега электрона, то есть к возрастанию его энергии при столкновении с атомами гелия. Это приводит к переводу атомов в возбуждённое состояние с бо́льшей энергией, в результате чего и происходит смещение спектральных линий от красного к фиолетовому краю видимого спектра.
Критические параметры гелия (Нe) очень низкие: критическая температура гелия − 267,95 °C и критическое давление гелия 0,22746 МПа. Этим объясняются трудности при сжижении гелия.
Скорость звука в гелии (Нe) составляет: 1056 м/с (при 30 °C, состояние вещества – газ), 965 м/с (при 0 °C, состояние вещества – газ), 237,66 м/с (при -272,165 °C, состояние вещества – жидкость), 231,4 м/с (при -271,39 °C, состояние вещества – жидкость), 221,7 м/с (при -270,97 °C, состояние вещества – жидкость), 223,3 м/с (при -270,65 °C, состояние вещества – жидкость), 179,8 м/с (при -268,93 °C, состояние вещества – жидкость).
Динамическая вязкость гелия (Нe) составляет: 0,0188 мПа·с (при 0°C, состояние вещества – газ), 0,0229 мПа·с (при 100°C, состояние вещества – газ), 0,0269 мПа·с (при 200°C, состояние вещества – газ), 0,0342 мПа·с (при 400°C, состояние вещества – газ),
0,0407 мПа·с (при 600°C, состояние вещества – газ).
Химические свойства гелия. Взаимодействие гелия. Реакции с гелием:
При нормальных условиях гелий химически инертен.
Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние.
Например, гелий образует двухатомные молекулы He+2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором).
Получение гелия:
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие более 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя его свойство сжижаться труднее всех остальных газов.
Жидкий гелий впервые получен в 1908 г., твердый – в 1926 г.
Применение гелия:
Гелий используется во многих областях промышленности и быту:
– в металлургии в качестве защитного инертного газа для выплавки чистых металлов;
– в пищевой промышленности (зарегистрирован в качестве пищевой добавки E939) как пропеллент и упаковочный газ;
– в качестве хладагента для получения сверхнизких температур (в частности, для перевода металлов в сверхпроводящее состояние);
– для наполнения воздухоплавающих судов (дирижаблей и аэростатов). В отличие от водорода гелий в силу негорючести абсолютно безопасен;
– в дыхательных смесях для глубоководного погружения;
– для наполнения воздушных шариков и оболочек метеорологических зондов;
– для заполнения газоразрядных трубок;
– как компонент рабочего тела в гелий-неоновых лазерах;
– в качестве носителя в газовой хроматографии;
– и пр.
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источник: https://de.wikipedia.org/wiki/Helium, https://de.wikipedia.org/wiki/Helium, https://ru.wikipedia.org/wiki/Гелий, https://chemister.ru/Database/properties.php?dbid=1&id=212
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
гелий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле гелия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
940
Источник
