Какими свойствами характеризуются вещества молекулярного строения
Все вещества состоят из атомов, которые объединяются в определенные структуры с помощью различных устойчивых связей. При этом структурная решетка физического тела может состоять, либо из отдельных однотипных групп атомов — молекул, либо из отдельных атомов. По типу связей различают вещества молекулярного и немолекулярного строения. Рассмотрим примеры веществ с молекулярным типом строения.

Строение вещества
Агрегатное состояние вещества (твердое, жидкое или газообразное) и особенности его строения определяются взаимодействием атомов и молекул, из которых состоят все вещества. Теория о молекулярном устройстве всех физических объектов подтвердилась многочисленными экспериментами. Современные приборы (электронные микроскопы) позволяют даже увидеть и сфотографировать отдельные молекулы и их расположение (структуру).
Перечислим базовые положения о молекулярном устройстве веществ:
- Все физические тела состоят из молекул — мелких частиц, каждая из которых имеет все основные химические и физические свойства, присущие всему веществу;
- Молекулы состоят из атомов;
- Атомы состоят из отрицательно заряженных электронов и ядра, включающего в себя положительно заряженные протоны и нейтроны, не имеющие зарядов;
- Молекулы вещества находятся в непрерывном, хаотическом движении;
- Взаимодействие частиц имеет электромагнитную природу: при сближении происходит отталкивание, а при удалении друг от друга возобновляется притяжение. В равновесном состоянии силы притяжения и отталкивания уравновешивают друг другу.
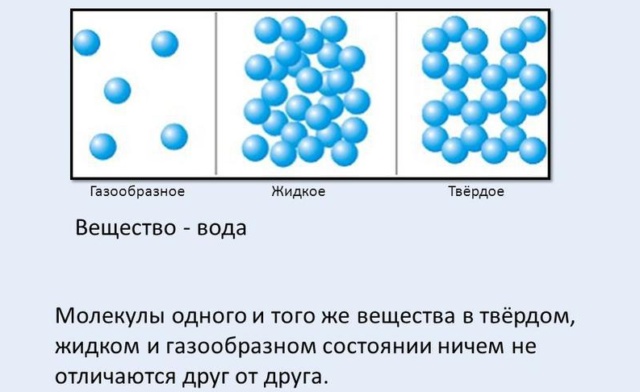
Рис. 1. Молекулы одного и того же вещества в разных агрегатных состояниях.
Древнегреческий философ Демокрит, живший более 2000 лет назад считается первым мыслителем, создавшим учение (теорию) о том, что весь наш мир построен из мельчайших. невидимых частичек — атомов. Слово атом имеет греческое происхождение (“атомос” — неделимый, неразрезаемый). Эта замечательная идея позднее была надолго забыта. Более тысячи лет безраздельно господствовало учение другого философа — Аристотеля, который отрицал существование атомов. Аристотель утверждал, что все вещества могут взаимно превращаться друг в друга, и любое тело можно делить до бесконечности. И Демокрит, и Аристотель строили свои предположения на основе общих, теоретических рассуждений. Только в начале ХIХ века на основе многочисленных опытов и экспериментов ученые (Гассенди, Ломоносов, Бойль, Мариотт, Дальтон и др.) окончательно пришли к общему мнению о реальности существования атомов и молекул.

Рис. 2. Портрет М. В. Ломоносова:.
Свойства веществ молекулярного строения
Для описания веществ со схожими свойствами выделяют два основных вида: вещества немолекулярного строения и вещества молекулярного строения. Вещества, состоящие из однотипных молекул, имеющих в своем составе один и тот же набор атомов, называются веществами молекулярного строения. Общими для этих веществ являются следующие свойства:
- Слабые связи между молекулами, которые при небольшом повышении температуры начинают разрываться — сначала происходит переход в жидкое состояние, а затем в газовую фазу;
- Низкие температуры плавления и кипения.
Примеры веществ молекулярного строения
К молекулярным веществам относятся:
- Большинство простых веществ-неметаллов: кислород (O2), сера (S2), фосфор (P4), водород (H2), азот (N2), хлор (Cl2), фтор (F2), бром (Br2), йод (I2);
- Соединения веществ-неметаллов друг с другом: аммиак (NH3), углекислый газ (CO2), серная кислота (HSO4), оксид азота (N2O5);
- Сахар;
- Нафталин.
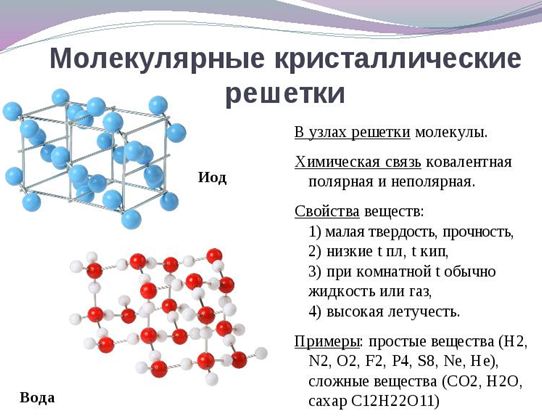
Молекулярная кристаллическая решетка образована молекулами, которые соединены между собой слабыми силами межмолекулярного притяжения. Поэтому эти вещества летучи (их можно обнаружить по запаху), имеют низкие температуры плавления, малую твердость (хрупкие) и являются диэлектриками (практически не проводят электрический ток).
Чаще всего молекулярные вещества при нормальных условиях находятся в жидком или газообразном агрегатном состоянии. Некоторые молекулярные вещества могут быть в твердом виде, но их отличительными свойствами являются: легкоплавкость и растворимость в воде (если в узлах полярные молекулы). Примерами таких веществ могут служить: сахар, глюкоза, нафталин, CO2 (“сухой лед”).

Рис. 3. Молекулярные кристаллические решетки, например: кислород, сера йод, вода:.
Атомов в составе молекулы может быть от 2 штук до бесконечности. Одно из первых мест по количеству атомов занимает молекула ДНК (дезоксирибонуклеиновая — кислота). В одной молекуле ДНК содержится атомов:
- углерода — 5750;
- водорода — 7227;
- кислорода — 4131;
- азота — 2215;
- фосфора — 590.
Что мы узнали?
Итак, мы узнали, что к веществам с молекулярным строением относятся газообразные, жидкие и твердые вещества, молекулярная кристаллическая решетка которых образована молекулами, соединенными между собой слабыми силами межмолекулярного притяжения. Такие вещества летучи (обнаруживаются по запаху), имеют низкие температуры плавления, малую твердость (хрупкие) и являются диэлектриками (практически не проводят электрический ток).
Тест по теме
Оценка доклада
Средняя оценка: 4.4. Всего получено оценок: 144.
Источник
Эта лекция будет посвящена
следующим понятиям: “вещества молекулярного и немолекулярного
строения”, “кристаллические решётки”.
Молекулярные
вещества
Молекулярные
вещества –
это вещества, мельчайшими структурными частицами которых являются молекулы
Молекулы – наименьшая частица молекулярного
вещества, способная существовать самостоятельно и сохраняющая его химические
свойства.
Молекулярные
вещества имеют низкие температуры плавления и кипения и находятся в стандартных
условиях в твердом, жидком или газообразном состоянии.
Например,
Вода – жидкость, tпл=0°С;
tкип=100°С
Вода
– самое известное и весьма распространенное вещество на нашей планете:
поверхность Земли на 3/4 покрыта водой, человек
на 65 % состоит из воды, без воды невозможна жизнь, так как в водном растворе
протекают все клеточные процессы организма. Вода – молекулярное вещество. Это
одно из немногих веществ, которое в природных условиях встречается в твердом,
жидком и газообразном состояниях, и единственное вещество, для которого в
каждом из этих состояний есть свое название. Особенностями строения воды
вызваны ее необычные свойства. Например, при замерзании вода увеличивается в
объеме, поэтому лед плавает в своем расплаве – жидкой воде, а наибольшая
плотность воды наблюдается при 4 oС, поэтому зимой большие
водоемы до дна не промерзают. На свойствах воды основана и сама шкала
температур Цельсия (0 o – температура замерзания,
100 o – температура кипения). С причинами этих явлений и с
химическими свойствами воды вы познакомитесь позже.
Немолекулярные
вещества
Немолекулярные
вещества –
это вещества, мельчайшими структурными частицами которых являются атомы или ионы.
Немолекулярные
вещества находятся в стандартных условиях в твердом агрегатном состоянии и
имеют высокие температуры плавления и кипения.
Например, Поваренная соль – твердое вещество, tпл=801°С;
tкип=1465°С; Железо
Железо – серебристо-белый, блестящий,
ковкий металл. Это немолекулярное вещество. Среди металлов железо занимает
второе место после алюминия по распространенности в природе и первое место по
значению для человечества. вместе с другим металлом – никелем – оно образует
ядро нашей планеты. Чистое железо не имеет широкого практического применения.
Знаменитая Кутубская колонна, расположенная в окрестностях Дели, высотой около
семи метров и весом 6,5 т, имеющая возраст почти 2800 лет (она поставлена в IX
в. до н. э.) – один из немногих примеров использования чистого железа (99,72
%); возможно, что именно чистотой материала и объясняется долговечность и
коррозионная устойчивость этого сооружения.

В
виде чугуна, стали и других сплавов железо используется буквально во всех
отраслях техники. Его ценные магнитные свойства используются в генераторах
электрического тока и электромоторах. Железо является жизненно необходимым
элементом для человека и животных, так как оно входит в состав гемоглобина
крови. При его недостатке клетки тканей получают недостаточно кислорода, что
ведет к очень тяжелым последствиям.
Для большинства веществ характерна способность в
зависимости от условий находиться в одном из трёх агрегатных состояний:
твёрдом, жидком, газообразным.
Например, вода при нормальном давлении в интервале
температур 0-100°С является жидкостью, при температуре выше 100°С находится в
газообразном состоянии, а при температуре ниже 0°С является твёрдым веществом.
Вещества в твёрдом состоянии различают аморфные и кристаллические.
Характерной особенностью аморфных тел является
отсутствие определенной температуры плавления, то есть отсутствует четкий
переход от твердого состояния к жидкому: при нагревании аморфное тело
становится только более текучим. К аморфным относят смола, воск, парафин,
стекло, большинство пластмасс и т.д.
Для кристаллических веществ характерна конкретная
температура плавления, т.е. вещество с кристаллическим строением переходит из
твёрдого состояния в жидкое не постепенно, а резко, при достижении конкретной
температуры, например, сахар, лёд, поваренная соль. Если
скорость роста кристаллов мала при охлаждении – образуется стеклообразное
состояние (аморфное).
Разница в физических свойствах аморфных и
кристаллических твёрдых веществ обусловлена строением. В аморфном веществе
отсутствует порядок в расположение частиц.

Рис. Примеры решеток кристаллических и аморфных тел
– кварц аморфный и кристаллический.
Таким образом, в случае кристаллических
веществ можно говорить о таком понятии, как кристаллическая решётка.
При низких температурах, когда тепловое движение
затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую
решётку.
Кристаллическая решетка – это пространственный
каркас, соединяющий точки пространства, в которых находятся частицы, образующие
кристалл
В самой кристаллической решетке различают узлы –
точки пространства, в которых находятся частицы, образующие кристалл и меж
узловое пространство.
В зависимости от того, какие частицы в узлах
кристаллической решётки, различают: молекулярную,
атомную, ионную и металлические кристаллические решётки.
Пример вещества с атомной кристаллической решёткой:

Пример вещества с ионной кристаллической решёткой – кристаллическая решётка поваренной соли NaCl:

Пример вещества с молекулярной кристаллической решёткой:

Пример вещества с металлической кристаллической решёткой:


Свойства веществ с различной кристаллической решёткой (таблица)
Между положением элемента в периодической системе и
кристаллической решёткой его соответствующего простого вещества существует
тесная взаимосвязь.

Выполните задания по данной теме:
1. Какой тип
кристаллической решётки у следующих широко используемых в быту веществ: вода,
уксусная кислота (CH3COOH), сахар (C12H22O11),
калийное удобрение (KCl), речной
песок (SiO2) –
температура плавления 17100C, аммиак
(NH3), поваренная соль? Сделайте обобщённый вывод: по
каким свойствам вещества можно определить тип его кристаллической решётки?
2. По
формулам приведённых веществ: SiC, CS2, NaBr, C2H2 –
определите тип кристаллической решётки (ионная, молекулярная) каждого
соединения и на основе этого опишите физические свойства каждого из четырёх
веществ.
3. Тренажёр
№1. “Кристаллические решётки”
4. Тренажёр
№2. “Тестовые задания”
5. Тест
(самоконтроль):
A.
Вещества,
имеющие молекулярную кристаллическую решётку, как правило:
a).
тугоплавки и хорошо растворимы в воде
б).
легкоплавки и летучи
в).
Тверды и электропроводны
г).
Теплопроводны и пластичны
B.
Понятия
«молекула» не применимо по отношению к структурной единице вещества:
a).
вода
б).
кислород
в).
алмаз
г).
озон
C.
Атомная
кристаллическая решётка характерна для:
a).
алюминия и
графита
б).
серы и йода
в).
оксида кремния и хлорида
натрия
г).
алмаза и бора
D.
Если
вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно,
то его кристаллическая решётка:
а).
молекулярная
б).
атомная
в).
ионная
г).
металлическая
Источник
Вещества могут существовать в трёх агрегатных состояниях: газообразном, жидком и твёрдом. Например, существует водяной пар (вода в газообразном агрегатном состоянии), жидкая вода и лёд (вода в твёрдом агрегатном состоянии).
В газообразном состоянии вещество существует в виде отдельных частиц (молекул, атомов или ионов). Расстояние между частицами в газах намного превышает размеры этих частиц. Частицы в газообразных веществах движутся с очень большими скоростями и неупорядоченно (хаотически).
В жидкостях расстояние между отдельными частицами намного меньше, поэтому силы взаимного притяжения между ними существенно больше, чем в газах. Скорость хаотического перемещения частиц в жидкостях намного меньше, чем в газах.
Частицы, составляющие твёрдое тело (атомы, молекулы или ионы), плотно упакованы и совершают колебательные движения. Различают кристаллические и аморфные твёрдые тела.
Кристаллические вещества. Для кристаллических веществ характерно упорядоченное расположение частиц, из которых они состоят. Например, снежинка имеет совершенную форму благодаря тому, что молекулы воды, из которых она состоит, располагаются упорядоченно по отношению друг к другу. Кристаллы соли, сахара, серы, горного хрусталя, алмаза также имеют геометрически правильную форму.
Правильная форма кристаллов обусловлена особенностями их внутреннего строения. В кристаллах ионы, атомы или молекулы расположены в определённом порядке, на определённых расстояниях друг от друга.
Совокупность точек пространства, в которых располагаются частицы, образующие кристалл, называют КРИСТАЛЛИЧЕСКОЙ РЕШЁТКОЙ.
В зависимости от того, какие частицы находятся в узлах этой решётки, различают атомные, молекулярные и ионные кристаллические решётки.
Атомные кристаллические решётки. В узлах атомных кристаллических решёток находятся отдельные атомы. Эти атомы могут располагаться в пространстве по-разному, поэтому и форма кристаллов бывает различной. Например, в узлах кристаллических решёток алмаза и графита находятся атомы углерода, но из-за различного расположения атомов кристаллы алмаза и графита имеют разную форму.
Молекулярные кристаллические решётки. В узлах молекулярных кристаллических решёток находятся молекулы. Например, в узлах кристаллической решётки иода находятся молекулы иода .
Ионные кристаллические решётки. Такие решётки характерны для ионных соединений. В узлах ионных решёток находятся противоположно заряженные ионы. Типичными представителями ионных соединений являются соли. Например, в узлах кристаллической решётки хлорида натрия (поваренной соли) находятся ионы натрия и хлорид-ионы .
В хлориде натрия ионы находятся на одинаковых расстояниях друг от друга, образуя кристаллы кубической формы. В кристаллах поваренной соли отдельных молекул хлорида натрия не существует.
Аморфные вещества. Существует достаточно много твёрдых веществ, частицы которых, подобно частицам в газах и жидкостях, расположены неупорядоченно (хаотически). Такие вещества называют аморфными. Свойства кристаллических и аморфных веществ существенно различаются. Например, если любое кристаллическое вещество имеет определённую температуру плавления, то аморфные вещества её не имеют.
Различить кристаллические и аморфные вещества можно, если их подвергнуть механическому воздействию: например, ударить молотком. Если аккуратно разбить кусочки поваренной соли, серы или графита, то можно заметить, что они раскалываются на мелкие кристаллы, имеющие определённую форму. Так ведут себя кристаллические вещества. Аморфные вещества, например стекло, при ударе рассыпаются на осколки, не имеющие определённой формы.
Вещества молекулярного и немолекулярного строения. Все вещества можно разделить на две большие группы: вещества, имеющие молекулярное строение, и вещества с немолекулярным строением.
Вещества, которые состоят из молекул, — это вещества МОЛЕКУЛЯРНОГО СТРОЕНИЯ.
Вещества, которые состоят из атомов или ионов, относят к веществам НЕМОЛЕКУЛЯРНОГО СТРОЕНИЯ.
Кристаллическая решётка хлорида натрия:
Вещества с молекулярным и немолекулярным строением существенно различаются по своим свойствам. Чтобы расплавить вещество, необходимо разрушить его кристаллическую решётку. Оказывается, что в кристаллической решётке связи между молекулами гораздо слабее, чем связи между атомами или ионами. Поэтому, как правило, вещества с молекулярным строением имеют низкие температуры плавления и кипения. Такие вещества часто летучи и имеют запах. Вещества с немолекулярным строением имеют высокие температуры плавления и кипения. Эти вещества твёрдые, нелетучие и не имеют запаха.
Можно ли по физическим свойствам вещества определить, какое строение оно имеет — молекулярное или немолекулярное? Вещества с молекулярным строением при обычных условиях — это газы (кислород, водород, азот и др.), жидкости (вода, спирт, эфир и др.) или легкоплавкие твёрдые вещества, такие, как кристаллическая сера (температура плавления около 113 °C) или белый фосфор (температура плавления 44 °C).
Источник
Неорганические и органические соединения отличаются по строению. Меньше веществ, образованных молекулами. Гораздо чаще встречается немолекулярные соединения. Частицы веществ могут быть упорядочены расположены в пространстве, образуют кристаллическую решетку. Тип структуры влияет на свойства различных химических соединений.
Молекулярное и немолекулярное строение веществ
Представления о существовании атомов возникли в древности. Греческое название переводится как «неделимые». Долгое время термины «атом», «корпускула», «молекула» были почти синонимами. Ясность внесли химики всего мира в 1860 году. Ученые приняли решение называть атомами мельчайшие частицы вещества. Они могут входить в состав молекул и немолекулярных структур.
Строение — это характеристика структурных единиц вещества, их расположение в пространстве (кристаллическая решетка).
Таблица 1.
Типы веществ по строению
Типы | Общие признаки | Тип кристаллической решетки |
Вещества молекулярного строения. | Мельчайшие структурные единицы (частицы) — молекулы. | Молекулярная. |
Вещества немолекулярного строения. | Мельчайшие структурные частицы — атомы или ионы. | Атомная, ионная или металлическая. |
Неметаллы, их соединения — вещества преимущественно молекулярного строения. Водород, кислород, азот, хлор, моно- и диоксид углерода, аммиак состоят из молекул сравнительно небольшого размера. Состав отражают формулы Н2, О2, N2, Cl2, СО, СО2, NH3. Наиболее распространенное вещество молекулярного строения — вода (Н2О) (Рис. 1).
Агрегатное состояние при разных температурах отличается. В обычных условиях эти вещества являются газами. Вода при комнатной температуре — жидкость, при 0°С — превращается в лед, имеющий кристаллическое строение. При 100°С образуется газ (пар).
Сахар и другие твердые органические вещества тоже состоят из молекул. Состав глюкозы отражает формула С6Н12О6. На рис. 2 показано пространственное расположение атомов в молекуле.
Немолекулярных соединений в природе гораздо больше. К этой группе относятся инертные газы, алмаз, графит (аллотропные видоизменения, модификации углерода), минерал кварц, различные соли, металлы. Это преимущественно твердые вещества (при комнатной температуре). Исключение — ртуть, жидкий металл, затвердевающий лишь при –30°С. Среди веществ немолекулярного строения встречаются наиболее твердые и тугоплавкие, обладающие высокой тепло- и электропроводностью.
Кристаллические решетки: типы и примеры
Структурные частицы природных и искусственно полученных веществ находятся в определенных точках пространства, на расстоянии друг от друга. Упорядоченное расположение называют кристаллической решеткой. В ее узлах находятся атомы, ионы или молекулы. На рисунках они обычно изображены кружочками. Черточками между ними условно обозначают химические связи.
Шаро-стержневые объемные модели тоже помогают лучше представить расположение структурных единиц в пространстве. Шарики символизируют частицы вещества, стержни между ними — химическую связь, как на рис. 3.
Вещества кристаллического строения широко распространены, имеют большое практическое значение. Они встречаются в природе, находят применение в промышленности, медицине, сельском хозяйстве, быту. (Рис. 4).
Рассмотрим особенности четырех основных типов кристаллической решетки.
Атомная
Такие кристаллические структуры распространены среди простых веществ. В узлах находятся атомы. Примеры веществ: графит и алмаз (аллотропные видоизменения, модификации углерода), кремний.
Прочную атомную кристаллическую решетку также имеют горный хрусталь и кварц (минералы состоят из диоксида кремния). Отличие от простых веществ существенное — в узлах находятся атомы кремния и кислорода, т. е. разных элементов.
Вещества атомного строения обычно твердые (за исключением графита), нерастворимые в воде, тугоплавкие, являются изоляторами или полупроводниками.
Молекулярная
В узлах кристаллической решетки — молекулы. Простые вещества с этим типом пространственного строения: S8 — кристаллическая сера, Р4 — белый фосфор, Br2 — бром, I2 — кристаллический йод. Н2О в виде льда, СО2 («сухой лед») — сложные вещества с молекулярной кристаллической решеткой.
Силы притяжения между структурными единицами относительно слабые, поэтому связи легко разрушаются. Например, йод возгоняется — переходит из твердого состояния в газообразное при комнатной температуре. (Рис. 5, 6).
Твердые органические соединения тоже имеют преимущественно молекулярную решетку. Это непрочные структуры, которые разрушаются при повышении температуры, растворении в воде.
Ионная
В узлах расположены ионы — заряженные частицы. Классический пример вещества с этим типом кристаллической решеткой — поваренная соль или хлорид натрия. (Рис. 7).
Катионы — положительно заряженные частицы. В электрическом поле они перемещаются к отрицательному полюсу источника тока (катоду). Отрицательные ионы движутся к аноду, имеющему заряд «+».
Ионная решетка характерна для солей, оксидов и гидроксидов металлов I–III групп периодической системы, большой группы соединений металлических элемент из других групп. Такие вещества обычно твердые и тугоплавкие.
Ионы высвобождаются при расплавлении и растворении. Расплавы и растворы являются электролитами, проводниками электрического тока, более слабыми, по сравнению с металлами.
Металлическая
Есть значительные отличия от трех предыдущих типов кристаллического строения. В узлах расположены нейтральные атомы и катионы. Между ними беспорядочно движутся электроны, образующие так называемый «электронный газ». (Рис. 8).
Металлы, их сплавы — твердые вещества, имеющие металлический блеск. Они тугоплавкие, обладают высокой тепло- и электропроводностью.
Все известные соединения состоят из атомов, молекул либо ионов. Упорядоченное расположение структурных единиц в пространстве — кристаллическая решетка. Физические свойства веществ во многом определяются типом соединения частиц.
Труднее разрушается атомная, легче — молекулярная кристаллическая решетка. Чтобы «освободить» частицы в составе ионного кристалла, достаточно растворить или расплавить вещество. Особенностью металлической решетки является наличие «электронного газа», высокая электропроводность веществ.
Источник
