Какими свойствами характеризуется молекула качественным составом
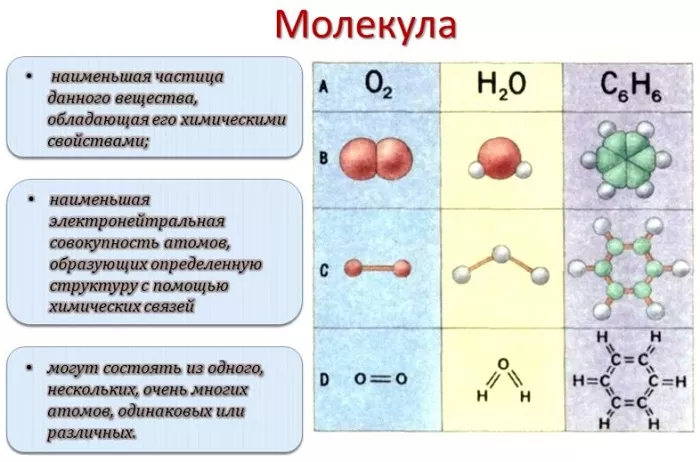
2.3. Молекулы. Химические формулы.
Молекулярные массы. Элементный состав веществ
Атомы
могут соединяться друг с другом. В результате этого соединения обычно
образуются более сложные частицы – молекулы. Например:
Эти
примеры показывают, что соединяться друг с другом могут атомы одного элемента и
атомы разных элементов. Число атомов, которые соединяются друг с другом, может
быть различным.
Состав
любой молекулы можно выразить химической
формулой.
Так,
молекула водорода имеет формулу Н2
. Число «2» в этой формуле показывает число атомов водорода в
молекуле водорода.
Числа
в химических формулах, которые показывают, сколько атомов данного элемента
входит в состав молекулы, называются индексами.
Молекула
хлороводорода
имеет формулу НСl, так как
она состоит из одного атома водорода и одного атома хлора. Молекула воды имеет
формулу Н2О. Эта формула
показывает, что молекула воды состоит из двух атомов водорода и одного атома
кислорода.
Таким
образом, химические формулы показывают качественный и количественный состав
молекулы.
Согласно
закону постоянства состава (Ж.
Пруст, Франция, 1808 г.):
Каждое чистое
вещество имеет постоянный качественный и количественный состав, который не
зависит от способа получения вещества.
Так
как вещество состоит из одинаковых молекул, то состав молекулы определяет
состав всего вещества. Различия в химических свойствах веществ обусловлены
различиями в составе и строении молекул, из которых состоят эти вещества.
Поэтому можно сделать вывод:
Молекула – это
наименьшая частица вещества, которая сохраняет его химические свойства.
Масса
любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы
молекулы используются относительные атомные массы, то получается относительная
молекулярная масса, которая обозначается символом Мr.
Например,
относительная молекулярная масса воды Н2О равна:
Относительная
молекулярная масса сульфата железа (III)равна:
Относительная
молекулярная масса вещества Мr – это число,
которое показывает, во сколько раз абсолютная масса молекулы данного вещества
больше 1/12 части абсолютной массы атома углерода С.
Например,
относительная молекулярная масса воды Мr
(Н2О)= 18. Это значит, что масса молекулы воды в 18 раз больше 1/12
части массы атома углерода.
Относительные
молекулярные массы, как и относительные атомные массы, являются величинами
безразмерными.
По
формуле вещества можно рассчитать массовую долю каждого химического элемента,
который входит в состав вещества.
Массовая доля (w) химического элемента в данном веществе равна
отношению относительной атомной массы данного элемента, умноженной на число его
атомов в молекуле, к относительной молекулярной массе вещества:
Массовые
доли обычно выражаются в процентах:
Рассчитаем,
например, массовые доли водорода и кислорода в воде Н2О:
УПРАЖНЕНИЯ
1.
Рассчитайте
массовую долю марганца в оксиде марганца (VII).
Решение: Молярные массы веществ равны: М(Mn) = 55
г/моль, М(О) = 16 г/моль, M(Mn2O7)=2М(Mn)+7М(О)= 222
г/моль. Следовательно, масса Mn2O7 количеством вещества 1 моль
составляет:
m(Mn2O7) = M(Mn2O7)·n(Mn2O7)
= 222·1= 222 г.
Из
формулы Mn2O7следует, что количество вещества атомов
марганца в два раза больше количества вещества оксида марганца (VII). Значит,
n(Mn) = 2n(Mn2O7)
= 2 моль,
m(Mn)= n(Mn)·M(Mn) = 2·55
= 110 г.
Таким
образом, массовая доля марганца в оксиде марганца(VII) равна:
ω(X)=m(Mn) : m(Mn2O7)
= 110:222 = 0,495 или 49,5%.
_______________________________________________________________
2.
Определите массовую долю кристаллизационной воды в дигидрате хлорида
бария BaCl2 • 2H2O.
Решение: Молярная масса BaCl2 • 2H2O составляет:
М(BaCl2 • 2H2O) = 137+ 2 • 35,5 + 2 • 18 =244 г/моль.
Из формулы BaCl2 • 2H2O следует, что 1 моль
дигидрата хлорида бария содержит 2 моль Н2О. Отсюда можно определить
массу воды, содержащейся в BaCl2 • 2H2O: m(H2O) = 2 • 18 = 36 г. Находим
массовую долю кристаллизационной воды в дигидрате хлорида бария
BaCl2 • 2H2O. ω(H2O) = m(H2O)/ m(BaCl2 • 2H2O) = 36/244 = 0,1475 =
14,75%.
_______________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Какие частицы обычно образуются в
результате соединения атомов.
2.
Чем можно выразить состав любой
молекулы.
3.
Что показывают химические формулы
4.
Чему равна масса молекулы
5.
Чему равна массовая доля данного
элемента в данном веществе.
6.
Опишите качественный м
количественный состав молекул следующих веществ: метан СН4, сода Na2CO3,
глюкоза C6H12O6
, хлор Cl2
, сульфат алюминия Al2(SO4)3.
7.
Молекула фосгена состоит из одного
атома углерода, одного атома кислорода и двух атомов хлора. Молекула мочевины
состоит из одного атома углерода, одного атома кислорода и двух атомных групп
NH2. Напишите формулы фосгена и мочевины.
8.
Подсчитайте общее число атомов в
следующих молекулах:
Рассчитайте относительные
молекулярные массы веществ, которые указаны в упражнении 6.
.
Чему равны массовые доли элементов в следующих
веществах:
В
каком из этих веществ массовая доля азота наибольшая и в каком – наименьшая.
1. Про молекулу нельзя сказать, что она: | |
а) сохраняется в химических реакциях | б) носитель химических свойств |
в) разрушается в химических реакциях | г) имеет тот же качественный состав, |
2. Нельзя утверждать, что в состав молекулы воды | |
а) два атома Н и один атом О | б) молекула Н2 и один атом |
в) атомы различных химических | г) атомы Н и О в массовом соотношении |
3. Какими свойствами | |
а) качественным составом | б) строением |
в) количественным составом | г) электрической проводимостью |
4. Что одинакового для молекул НСl и | |
а) масса | б) массовая доля водорода |
в) качественный состав | г) число атомов в молекуле |
5. Что показывает химическая формула H2SO4: | |
а) одну молекулу серной кислоты | б) относительную атомную массу серной |
в) нет верного ответа | г) пространственное строение молекулы |
6. Какие свойства характеризуют и молекулу, и | |
а) качественный состав | б) электрическая проводимость |
в) физические свойства | г) агрегатное состояние |
7. Массовая доля хлора в его оксиде равна 59,66 %. | |
а) Cl2O | б) Cl2O3 |
в) Cl2O5 | г) Cl2O7 |
8. Какова формула оксида железа, в котором массовая | |
а) FeO | б) Fe2O3 |
в) Fe3O4 | г) FeO3 |
9. Какова массовая | |
а) 11 | б) 10 |
в) 15 | г)12 |
10. Рассчитайте массовую долю фосфора в веществе H3PO4: | |
а) 32 | б) 65 |
в) 36 | г) 17 |
Ответы:
1 | а |
2 | б |
3 | г |
4 | г |
5 | а |
6 | а |
7 | б |
8 | б |
9 | а |
10 | а |
Источник
Одним из основополагающих понятий современной науки является понятие молекулы. Его введение европейскими учеными в 1860 г. дало толчок к развитию не только химии и физики, но и других естественных наук.
Молекулой, в наиболее общем определении, называется частица, образованная из нескольких (двух или более) атомов, объединенных между собой ковалентными связями. Она не имеет электрического заряда, все электроны в её составе имеют пару.
Молекулы, несущие заряд, называются ионами, неспаренные электроны – радикалами. Качественный и количественный состав их стабилен. Количество ядер атомов, электронов и их взаимное расположение позволяют отличать молекулы разных веществ друг от друга.
Что такое молекула в физике
В физике этим понятием оперируют при изучении свойств разных сред (газы, жидкости) и твердых тел.

Также их свойствами объясняются явления диффузии, теплопроводности и вязкость веществ.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.

При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
В качестве примера рассмотрим строение наименьшей частицы воды.
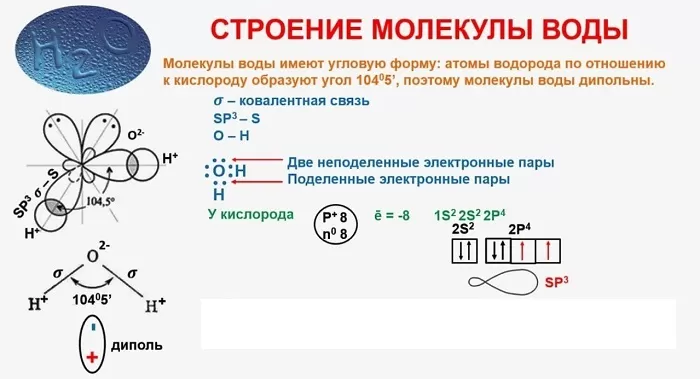
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
Металлическая – ядра атомов металлов, расположенные в узлах кристаллических решёток, объединены общим облаком электронов.
Водородная – основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Ионная – имеет электрическую природу. Сильно поляризована. Возникает при притяжении ионов, несущих противоположный заряд.
Ковалентная – может быть полярной и неполярной. Образуется за счет пары электронов, совместно принадлежащей двум атомам. Отличается наибольшей устойчивостью и энергетической емкостью.
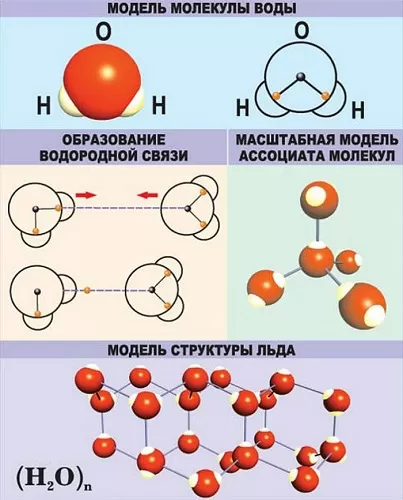
Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.
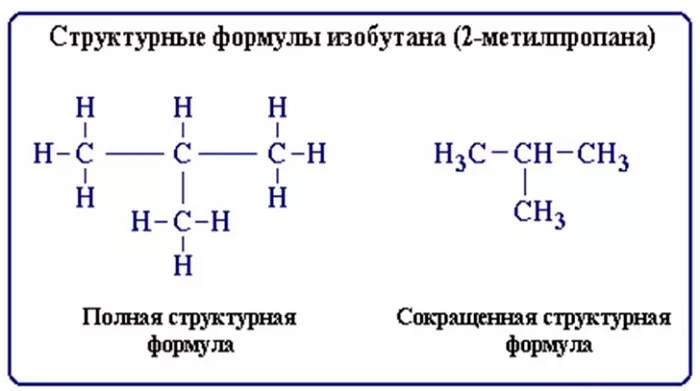
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Строение частицы вещества активно изучается. Для этого используют различные экспериментальные и теоретические методы. К экспериментальным относят рентгеновский структурный анализ, спектроскопия, массспектрометрия и др. К теоретическим – расчётные методы квантовой химии.
Масса (размер) молекулы
В зависимости о количества ядер атомов, входящих в их состав, можно выделить молекулы двухатомные, трехатомные и т. д.

В том случае, если количество атомов велико, молекула носит название макромолекулы.
Путем сложения масс атомов, входящих в состав частицы, можно определить молекулярную массу. В зависимости от её величины, все вещества делят на высоко- и низкомолекулярные.
Свойства молекулы

Современная наука выделяет следующие свойства молекул:
Электрические – этими свойствами определяется то, как ведет себя вещество в электрическом поле. Атомы, входящие в состав молекулы, состоят, в свою очередь, из положительно заряженного ядра и электронов, несущих отрицательный заряд. Эти заряды внутри самой молекулы располагаются неравномерно, в связи с этим возникает так называемый дипольный момент и смещение электронной плотности в сторону одного из атомов.
Оптические – дают характеристику того, как ведет себя вещество в поле световой волны. К оптическим свойствам относят способность поляризовать свет, преломлять его и рассеивать.
Магнитные – объясняются распределением электронов в атомах.
Различают вещества:
диамагнитные – парных электронов нет;
парамагнитные – имеются непарные электроны.
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.
Источник
В уроке 4 «Сложные вещества» из курса «Химия для чайников» дадим определение химическим соединениям, рассмотрим различия органических и неорганических соединений, а также выясним, что означает качественный и количественный состав. Напоминаю, что в прошлом уроке «Молекулы и простые вещества» мы рассмотрели, что такое молекулы, простые вещества, а также металлы и неметаллы.
Химические элементы существуют не только в виде свободных атомов и простых веществ. Они также могут входить в состав самых различных химических соединений.
Вещества, состоящие из атомов разных химических элементов, называются сложными веществами или химическими соединениями.
Органические и неорганические вещества
Подавляющее большинство химических веществ — это сложные вещества. Вы уже знаете некоторые из них. Вода, метан, сахар, поваренная соль — сложные вещества. Сложные вещества делятся на две группы — неорганические и органические.
Органические вещества
Все органические вещества объединяет главный признак: в их состав обязательно входят атомы углерода. Кроме углерода, в состав органических веществ чаще всего входят атомы водорода, кислорода, а также азота, фосфора, серы. Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение (рис. 41).
Простейшим органическим веществом является природный газ метан. Но вам, наверное, знакомы и такие органические вещества, как сахар (сахароза), уксусная и лимонная кислоты, спирт, крахмал, белки, жиры, пластмассы и т. д. Органических веществ миллионы. Они содержатся во всех животных и растительных организмах (откуда и произошло их название), входят в состав пищи, топлива, лекарств, красителей, самых разнообразных материалов.
Неорганические вещества
Неорганические вещества являются соединениями всех остальных элементов. К неорганическим традиционно относят также несколько веществ, содержащих углерод: углекислый и угарный газы, мел, соду и некоторые другие. Неорганических веществ около 700 тыс., но их общая масса многократно превышает массу органических веществ. Почти все они — твердые вещества немолекулярного строения (рис. 42), входят в состав минералов, почв, горных пород.
Качественный и количественный состав веществ
Каждое вещество характеризуется определенным качественным и количественным составом.
Качественный состав вещества показывает, из атомов каких элементов оно состоит. Например, вода состоит из атомов водорода и кислорода, а метан— из атомов углерода и водорода. Число атомов каждого элемента в составе мельчайшей частицы вещества характеризует его количественный состав. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула метана — из одного атома углерода и четырех атомов водорода.
Сложное вещество можно с помощью различных химических методов разложить на несколько новых веществ, и так до тех пор, пока не получатся вещества, каждое из которых будет являться простым. Например, сахар при нагревании разлагается на воду и уголь (углерод):
а воду можно разложить с помощью электрического тока на водород и кислород:
Свойства простых веществ, которые при этом получаются (углерода, кислорода и водорода), совершенно не похожи на свойства сложных веществ — сахара и воды. Это разные вещества с разными свойствами. Свойства сложного вещества не являются суммой свойств простых веществ, которые образуются при его разложении.
Сложные вещества, как и простые, имеют либо молекулярное, либо немолекулярное строение. При этом вещества молекулярного строения могут существовать при обычных условиях в различных агрегатных состояниях. Например, метан — газ, вода — жидкость, сахар — твердое вещество.
Вещества немолекулярного строения при обычных условиях — твердые кристаллы, например поваренная соль, мел. Конечно, при нагревании (иногда до нескольких тысяч градусов) такие вещества плавятся, а затем переходят и в парообразное состояние.
Отличия между сложными веществами и смесями веществ
Необходимо различать сложные вещества и смеси веществ:
| Сложное вещество (химическое соединение) | Смесь веществ |
| Образуется в результате соединения атомов различных элементов между собой (химический процесс) | Образуется в результате смешивания различных веществ (физический процесс) |
| Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено | Свойства веществ, из которых составлена смесь, не изменяются |
| Имеет определенный качественный и количественный состав | Состав произвольный |
| Разлагается на составные части только в результате химических процессов | Разделяется на составные части с помощью различных физических методов |
Краткие выводы урока:
- Сложными называются вещества, состоящие из атомов разных химических элементов.
- Каждое чистое вещество имеет определенный качественный и количественный состав.
- Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено.
- Сложные вещества имеют молекулярное или немолекулярное строение.
- Все сложные вещества делятся на органические и неорганические.
Надеюсь урок 4 «Сложные вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Химия – наука о веществах, их свойствах, превращениях и явлениях, сопровождающих эти превращения.
Вещества – это то, из чего состоят предметы (физические тела) окружающего мира. Вещества, существующие в природе, постоянно претерпевают различные изменения.
Явления – различные изменения, которые происходят с веществами.
Физические явления – явления, не сопровождающиеся превращениями одних веществ, в другие (обычно изменяется агрегатное состояние веществ или их форма).
Химические явления – явления, в результате которых из данных веществ образуются другие.
Иначе химические явления называют химическими реакциями.
Каждое вещество обладает строго определёнными свойствами.
Свойства веществ – признаки, позволяющие отличить одни вещества от других, или установить сходство между ними.
Физические свойства:
m – масса, V – объём, ρ – плотность.
Масса может быть выражена в граммах, объем в миллилитрах (если это жидкость) или литрах (если это газ).
1 мл = 1 см3, 1 л = 1 дм3, 1000 л = 1 м3
Поэтому плотность измеряют в г/мл, г/см3 (если это жидкость), или в г/л, г/дм3 (если это газ).
Если принять V = 1, то плотность – это масса единичного объёма вещества.
Химические свойства – это те химические реакции, в которые вступает данное вещество.
Так же можно сказать, что химические свойства – это те химические реакции, которые характеризуют группу веществ (класс веществ). Например, мы будем в дальнейшем изучать свойства воды, свойства класса оксидов, свойства класса алканов и т.д.
ООсновы атомно – молекулярного учения
Идея о том, что вещества состоят из мельчайших частиц возникла в Древней Греции в философских учениях Левкиппа и его ученика Демокрита. Эти частицы они назвали атомами (неделимые).
Существование атомов было доказано эмпирическим путём в конце 16 – начале 17 века Джоном Дальтоном и М. В. Ломоносовым. Ими же были заложены основы атомно – молекулярного учения.
В настоящее время, в связи с открытием делимости атома и появлением теории химической связи, основные положения атомно – молекулярного учения существенно изменились. Его суть можно свести к ряду важных положений, которые необходимо запомнить.
Все вещества, существующие в природе, представляют собой совокупность очень большого числа частиц (атомов, молекул или ионов). В зависимости от типа частиц все вещества условно подразделяют на две группы: вещества молекулярного строения и вещества немолекулярного строения (атомного или ионного).
Вещества молекулярного строения – вещества, основной структурной единицей которых является молекула.
Вещества немолекулярного строения – вещества, основными структурными единицами которых являются атомы или ионы.
Частицы, из которых состоит данное вещество, взаимодействуют между собой посредством электромагнитных (кулоновских) сил и находятся в постоянном движении. Движение частиц ограничено силами взаимодействия между ними.Каждое вещество, в зависимости от условий (температуры, давления) может находиться в определённом агрегатном состоянии.
В твёрдом агрегатном состоянии вещества, составляющие его частицы находятся относительно упорядоченно (кристаллическое состояние), их кинетическая энергия (энергия движения) существенно меньше чем потенциальная (энергия покоя). В газообразном состоянии, частицы свободно движутся в предоставленном им объёме и их кинетическая энергия существенно выше чем потенциальная.
В жидкости же потенциальная энергия частиц примерно равна их кинетической энергии. Это связано с тем, что часть частиц жидкости находится относительно упорядоченно в составе так называемых кластеров(англ. cluster— скопление). Другие же частицы свободно перемещаются по объёму жидкости. Чем ниже температура жидкости, тем больше в ней кластеров и наоборот.
Рис. Кластеры воды, где число молекул 20-220
Следует отметить, что существуют еще два дополнительные “состояния”. Это жидкокристаллическое состояние и состояние плазмы.
Цитоплазматическая мембрана клетки – типичный пример жидкого кристалла. Молекулы фосфолипидов в биологической мембране относительно упорядоченно распределяются в двух слоях, но при этом могут в пределах слоя свободно перемещаться, а также “перескакивать” из одного слоя в другой.
Жидкие кристаллы имеют широкое применение в технике (напр., ЖК-мониторы компьютеров).
Плазма (от греч. πλάσμα «вылепленное», «оформленное») — ионизованный газ.
Плазма в своём составе содержит свободные электроны, катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы).
Так как плазма содержит заряженные частицы, то она проводит электрический ток и на неё можно воздействовать внешним магнитным полем. Различают низкотемпературную и высокотемпературную плазму.
Изучает свойства плазмы наука физика.
Вещество из одного агрегатного состояния может переходить в другие агрегатные состояния при изменении внешних условий – температуры (T) и давления (P). Такие переходы принято называть фазовыми переходами.
Так, при повышении температуры, твердое вещество превращается в жидкость, а жидкость при ещё большей температуре превращается в газ. Дальнейшее повышение температуры переводит газ в плазму. При таких переходах вещество в другие вещества не превращается. Напомним, что такие явления мы называем физическими. Поэтому фазовые переходы – это физические явления.
При понижении температуры происходят обратные фазовые переходы – газ превращается в жидкость, а жидкость переходит в твердое состояние.
Фазовые переходы имеют названия.
Твердое —> Жидкое (плавление, обратный переход – кристаллизация)
Жидкое —> Газообразное (испарение, обратный переход – конденсация)
Газообразное —> Плазма (ионизация, обратный переход – деионизация)
Твердое —> Газообразное (сублимация или возгонка, обратный переход – десублимация)
Вещество – совокупность большого числа частиц, находящаяся в определённом агрегатном состоянии в зависимости от условий (температуры и давления).
Поэтому, например, такая фраза как: “Вода – жидкое вещество”, является некорректной. Если мы говорим об агрегатном состоянии вещества, то следует обязательно уточнить условия в которых находится вещество – температуру и давление. Такая фраза как: “При нормальном атмосферном давлении и комнатной температуре, вода – жидкое по агрегатному состоянию вещество”, является правильной.
С точки зрения физики, что более точно, вещество – это форма материи, состоящая из частиц, обладающих массой покоя. Существуют частицы, не обладающие массой покоя, например, фотоны. Материя, состоящая из частиц, не обладающих массой покоя называется поле.
Протоны, нейтроны, электроны – это частицы, обладающие массой покоя, следовательно это частицы вещества. Но химия не изучает вещество, состоящее, к примеру, из электронов (электронный газ), или вещество, состоящее из нейтронов (нейтронный газ). Это удел физики.
Химия изучает вещества, состоящие из атомов, молекул или ионов.
Ввиду этого вещество условно можно подразделить на физическое (электронный газ в проводнике, нейтронный газ и т.д.) и химическое (состоящее из атомов, молекул, ионов, свободных радикалов).
Источник
