Какими свойствами будет обладать полипептид
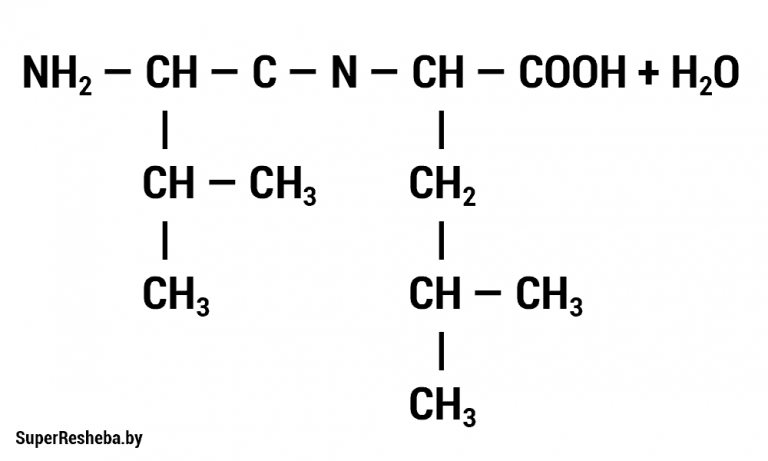
1. Запишите формулу дипептида, образованного двумя молекулами аминокислот.

2. В состав полипептида входят следующие аминокислоты: аланин, лизин, глутаминовая кислота. Какими свойствами будет обладать полипептид — гидрофильными или гидрофобными? Ответ поясните. Формулы данных аминокислот приведены в учебнике (с. 19, рис. 6).
Полипептид будет гидрофильным.
3. Альбумин сыворотки крови человека имеет относительную молекулярную массу 68 400. Определите количество аминокислотных остатков в молекуле этого белка, принимая во внимание, что средняя относительная молекулярная масса одной аминокислоты равна 120.
$dfrac{68400}{120} = 570$ (аминокислотных остатков).
4. Определите, сколько остатков глюкозы содержится в моле- куле гликогена, если его относительная молекулярная масса составляет примерно $1.62 · 10^6.$
$1.62 · dfrac{10^6}{162} = 10 000$ (остатков глюкозы).
5. Рассчитайте, сколько граммов глицерина было израсходовано клетками организма на синтез жира, если известно, что при этом было затрачено 21 моль высших карбоновых кислот.
На 1 моль глицерина приходится 3 моль кислот. Было использовано 7 моль глицерина. $M(mathrm{C_3H_8O_3}) = 92$ г/моль.
6. В молекуле ДНК на долю цитидиловых нуклеотидов приходится 20 %. Определите процентное содержание остальных нуклеотидов в этой ДНК.
Гуаниловых кислот — 20 %; адениловых — 30 %; тимидиловых — 30 %.
7. Фрагмент молекулы ДНК содержит 280 остатков цитидиловых нуклеотидов, что составляет 14 % от общего количества нуклеотидов. Определите длину данного фрагмента молекулы ДНК.
Ц + Г = $560;$ А + Т = $72 % = 1440;$ $dfrac{560 + 1440}{2} = 1000;$ длина фрагмента равна $340$ нм.
8. Фрагмент молекулы ДНК состоит из 5760 нуклеотидов, из них 1125 тимидиловых нуклеотидов. Определите количество адениловых, гуаниловых и цитидиловых нуклеотидов в данном фрагменте молекулы ДНК.
А = Т = $1125;$ $5760 – 1125 – 1125 = 3510;$ Г = Ц = $dfrac{3510}{2} = 1755.$
9. Длина фрагмента молекулы ДНК равна 68 нм, что составляет 10 % от длины всей молекулы. На долю адениловых нуклеотидов в данной молекуле ДНК приходится 12 %. Определите относительную молекулярную массу фрагмента молекулы ДНК, принимая во внимание, что относительная молекулярная масса одного нуклеотида равна 354, и число всех видов нуклеотидов в данной молекуле ДНК.
$dfrac{68,нм}{0.34,нм} = 200;$ $200 · 354 = 70 800.$
10. У исследователя есть три молекулы ДНК одинаковой длины. Известно, что содержание тимидиловых нуклеотидов (Т) в первом образце составляет 20 % от общего числа нуклеотидов, во втором — 36 %, в третьем — 8 %. Исследователь начал нагревать данные молекулы ДНК, постепенно повышая температуру. При этом происходило отделение комплементарных цепей друг от друга — так называемое плавление ДНК. Какой образец начал плавиться первым, а какой расплавился в последнюю очередь? Почему?
Поскольку во втором образце содержится меньше Г–Ц (потому как больше тимидиловых нуклеотидов), он начал плавится первым, а в последнюю очередь расплавился третий, где содержание Г–Ц наибольшее (тимидиловых нуклеотидов наименьшее).
Источник
Образование пептидной связи
Пепти́ды (греч. πεπτος «питательный») — семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—. Обычно подразумеваются пептиды, состоящие из α-аминокислот, однако термин не исключает пептидов, полученных из любых других аминокарбоновых кислот[1].
Пептиды, последовательность которых короче примерно 10—20 аминокислотных остатков, могут также называться олигопепти́дами (от др.-греч. ὀλίγος «малочисленный»); при большей длине последовательности они называются полипепти́дами (от греч. πολυ- «много»); полипептиды могут иметь в молекуле неаминокислотные фрагменты, например углеводные остатки. Белка́ми обычно называют полипептиды, содержащие, примерно, от 50 аминокислотных остатков[2] с молекулярной массой более 5000[3], 6000[4] или 10000[5][6]дальтон.
В 1900 году немецкий химик-органик Герман Эмиль Фишер выдвинул гипотезу о том, что пептиды состоят из цепочки аминокислот, образованных определёнными связями, и уже в 1902 году он получил неопровержимые доказательства существования пептидной связи, а к 1905 году разработал общий метод, при помощи которого стало возможным синтезировать пептиды в лабораторных условиях. Постепенно учёные изучали строение различных соединений, разрабатывали методы разделения полимерных молекул на мономеры, синтезировали всё больше и больше пептидов.
Олиго- и полипептиды, белки[править | править код]
Грань между олигопептидами и полипептидами (тот минимальный размер, при котором молекула пептида перестаёт считаться олигопептидом и становится полипептидом) достаточно условна. Источники, разграничивающие олиго- и полипептиды, как правило, определяют границу между олигопептидами и полипептидами как 10 (согласно Химической Энциклопедии[4]) или 10—20 (согласно определению ИЮПАК[1]) аминокислотных остатков. Иногда четкая грань не проводится вообще (так, например, согласно учебнику Ленинжера[6], размер олигопептидов — несколько, а полипептидов — много аминокислотных остатков), и формально олигопептидная молекула окситоцин, состоящая из 9 аминокислотных остатков, может упоминаться как полипептид.
Белками можно считать пептиды, масса которых превышает 5000—10 000, и(или) длина превышает 50—90 аминокислотных остатка. Эта граница тоже условна, однако в основных источниках справочной информации, где эта граница обозначена (включая ИЮПАК), она лежит в указанных пределах. Диапазон масс согласуется с диапазоном размеров подстановкой средней массы аминокислотного остатка (110 Да).
История[править | править код]
Пептиды впервые были выделены из гидролизатов белков, полученных с помощью ферментирования.
- Термин пептид предложен Э. Фишером, который к 1905 г. разработал общий метод синтеза пептидов.
В 1953 В. Дю Виньо синтезировал окситоцин, первый полипептидный гормон. В 1963 г., на основе концепции твердофазного пептидного синтеза (P. Меррифилд) были созданы автоматические синтезаторы пептидов.
Использование методов синтеза полипептидов позволило получить синтетический инсулин и некоторые ферменты.
На сегодняшний день известно более 1500 видов пептидов, определены их свойства и разработаны методы синтеза.
Панкреатические молекулы полипептидного характера[править | править код]
- en:NPY
- Пептид YY
- APP Avian pancreatic polypeptide
- en:HPP Human pancreatic polypeptide
Свойства пептидов[править | править код]
Пептиды постоянно синтезируются во всех живых организмах для регулирования физиологических процессов. Свойства пептидов зависят, главным образом, от их первичной структуры — последовательности аминокислот, а также от строения молекулы и её конфигурации в пространстве (вторичная структура).
Классификация пептидов и строение пептидной цепочки[править | править код]
Молекула пептида — это последовательность аминокислот: два и более аминокислотных остатка, соединённых между собой амидной связью, составляют пептид.
Количество аминокислот в пептиде может сильно варьировать. И в соответствии с их количеством различают:
- олигопептиды — молекулы, содержащие до десяти аминокислотных остатков; иногда в их названии упоминается количество входящих в их состав аминокислот, например, дипептид, трипептид, пентапептид и др.;
- полипептиды — молекулы, в состав которых входит более десяти аминокислот…
Соединения, содержащие более ста аминокислотных остатков, обычно называются белками. Однако это деление условно, некоторые молекулы, например, гормон глюкагон, содержащий лишь двадцать девять аминокислот, называют белковым гормоном.
По качественному составу различают:
- гомомерные пептиды — соединения, состоящие только из аминокислотных остатков;
- гетеромерные пептиды — вещества, в состав которых входят также небелковые компоненты.
Пептиды также делятся по способу связи аминокислот между собой:
- гомодетные — пептиды, аминокислотные остатки которых соединены только пептидными связями;
- гетеродетные пептиды — те соединения, в которых помимо пептидных связей встречаются ещё и дисульфидные, эфирные и тиоэфирные связи.
Цепочка повторяющихся атомов называется пептидным остовом: (—NH—CH—OC—).
Участок (—CH—) с аминокислотным радикалом образует соединение (—NH—C(R1)H—OC—), называемое аминокислотным остатком.
N-концевой аминокислотный остаток имеет свободную α-аминогруппу (—NH), в то время как у C-концевого аминокислотного остатка свободной является α-карбоксильная группа (OC—).
Пептиды различаются не только по аминокислотному составу, но и по количеству, а также расположению и соединению аминокислотных остатков в полипептидную цепочку.
Пример: Про-Сер-Про-Ала-Гис и Гис-Ала-Про-Сер-Про — несмотря на одинаковый количественный и качественный состав, эти пептиды имеют совершенно разные свойства[источник не указан 635 дней].
Пептидная связь[править | править код]
Пептидная (амидная) связь — это вид химической связи, которая возникает вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты.
Амидная связь очень прочная, и в нормальных клеточных условиях (37 °C, нейтральный pH) самопроизвольно не разрывается. Пептидная связь разрушается при действии на неё специальных протеолитических ферментов (протеаз, пептидгидролаз).
Значение[править | править код]
Пептидные гормоны и нейропептиды, например, регулируют большинство процессов организма человека, в том числе принимают участие в процессах регенерации клеток. Пептиды иммунологического действия защищают организм от попавших в него токсинов. Для правильной работы клеток и тканей необходимо адекватное количество пептидов. Однако с возрастом и при патологии возникает дефицит пептидов, который существенно ускоряет износ тканей, что приводит к старению всего организма.
Сегодня проблему недостаточности пептидов в организме научились решать. Пептидный пул клетки восполняют синтезированными в лабораторных условиях короткими пептидами.
Синтез пептидов[править | править код]
Образование пептидов в организме происходит в течение нескольких минут, химический же синтез в условиях лаборатории — достаточно длительный процесс, который может занимать несколько дней, а разработка технологии синтеза — несколько лет. Однако, несмотря на это, существуют довольно весомые аргументы в пользу проведения работ по синтезу аналогов природных пептидов.
Во-первых, путём химической модификации пептидов возможно подтвердить гипотезу первичной структуры. Аминокислотные последовательности некоторых гормонов стали известны именно благодаря синтезу их аналогов в лаборатории.
Во-вторых, синтетические пептиды позволяют подробнее изучить связь между структурой аминокислотной последовательности и её активностью. Для выяснения связи между конкретной структурой пептида и его биологической активностью была проведена огромная работа по синтезу не одной тысячи аналогов. В результате удалось выяснить, что замена лишь одной аминокислоты в структуре пептида способна в несколько раз увеличить его биологическую активность или изменить её направленность. А изменение длины аминокислотной последовательности помогает определить расположение активных центров пептида и участка рецепторного взаимодействия.
В-третьих, благодаря модификации исходной аминокислотной последовательности, появилась возможность получать фармакологические препараты. Создание аналогов природных пептидов позволяет выявить более «эффективные» конфигурации молекул, которые усиливают биологическое действие или делают его более продолжительным.
В-четвёртых, химический синтез пептидов экономически выгоден. Большинство терапевтических препаратов стоили бы в десятки раз больше, если бы были сделаны на основе природного продукта.
Зачастую активные пептиды в природе обнаруживаются лишь в нанограммовых количествах. Плюс к этому, методы очистки и выделения пептидов из природных источников не могут полностью разделить искомую аминокислотную последовательность с пептидами противоположного или же иного действия. А в случае специфических пептидов, синтезируемых организмом человека, получить их возможно лишь путём синтеза в лабораторных условиях.
Биологически активные пептиды[править | править код]
Пептиды, обладая высокой физиологической активностью, регулируют различные биологические процессы.
По биорегуляторному действию пептиды принято делить на несколько групп:
- соединения, обладающие гормональной активностью (глюкагон, окситоцин, вазопрессин и др.);
- вещества, регулирующие пищеварительные процессы (гастрин, желудочный ингибирующий пептид и др.);
- пептиды, регулирующие аппетит (эндорфины, нейропептид-Y, лептин и др.);
- соединения, обладающие обезболивающим эффектом (опиоидные пептиды);
- органические вещества, регулирующие высшую нервную деятельность, биохимические процессы, связанные с механизмами памяти, обучения, возникновением чувства страха, ярости и др.;
- пептиды, которые регулируют артериальное давление и тонус сосудов (ангиотензин II, брадикинин и др.).
- пептиды, которые обладают противоопухолевым и противовоспалительным свойствами (Луназин)
Однако такое деление условно, так как действие многих пептидов не ограничивается каким-либо одним направлением. Так, например, вазопрессин, помимо сосудосуживающего и антидиуретического действия, улучшает память.
Пептидные гормоны[править | править код]
Пептидные гормоны — это многочисленный и наиболее разнообразный по составу класс гормональных соединений, представляющий собой биологически активные вещества. Их образование происходит в специализированных клетках железистых органов, после чего активные соединения поступают в кровеносную систему для транспортировки к органам-мишеням. По достижении цели гормоны специфически воздействуют на определённые клетки, взаимодействуя с соответствующим рецептором.
Нейропептиды[править | править код]
Нейропептиды — соединения, синтезируемые в нейронах, обладающие сигнальными свойствами.
Действие нейропептидов на ЦНС очень разнообразно. Они воздействуют непосредственно на мозг и контролируют сон, влияют на память, поведение, процесс обучения, обладают обезболивающим действием.
Тахикининовые пептиды (Tachykinin peptides)[править | править код]
- Субстанция Р
- en:Kassinin
- Нейрокинин А (en:Neurokinin A)
- en:Eledoisin
- Нейрокинин В (en:Neurokinin B)
Пептиды иммунологического действия[править | править код]
Наиболее изученные пептиды, участвующие в иммунном ответе — тафцин, тимопотин II и тимозин α1. Их синтез в клетках организма человека обеспечивает функционирование иммунной системы.
Терминология по теме[править | править код]
- Полипептиды — пептиды, с числом аминокислотных остатков больше 10-20
- Олигопептиды — пептиды с числом аминокислот в цепи до 10-20
- Дипептиды
- Трипептиды
- Гексапептиды
- Нейропептиды пептиды, ассоциированные с нервной тканью
- Пептидные гормоны — пептиды с Гормональной активностью
См. также[править | править код]
- Белки
- Аминокислоты
- Рибосома
Примечания[править | править код]
- ↑ 1 2 IUPAC. Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: https://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook.P04898.
- ↑ IUPAC. Biochemical Nomenclature and Related Documents, 2nd edition, (the «White Book») p. 48 Portland Press, 1992. Edited C Liebecq. [ISBN 1-85578-005-4]
https://www.chem.qmul.ac.uk/iupac/AminoAcid/A1113.html#AA11 - ↑ Белки // «Химическая энциклопедия», изд. «Советская энциклопедия», М., 1988
- ↑ 1 2 Пептиды // «Химическая энциклопедия», изд. «Советская энциклопедия», М., 1988
- ↑ UPAC. Compendium of Chemical Terminology, 2nd ed. (the «Gold Book»). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: https://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook.P04898.
- ↑ 1 2 David L. Nelson, Michael M. Cox Lehninger Principles of Biochemistry. — 4. — W. H. Freeman, 2004. — 85 с.
Источник
