Какими основными свойствами обладает белок

Áåëêè – ïðèðîäíûå ïîëèïåïòèäû ñ îãðîìíîé ìîëåêóëÿðíîé ìàññîé. Îíè âõîäÿò â ñîñòàâ âñåõ æèâûõ îðãàíèçìîâ è âûïîëíÿþò ðàçëè÷íûå áèîëîãè÷åñêèå ôóíêöèè.
Ñòðîåíèå áåëêà.
Ó áåëêîâ ñóùåñòâóåò 4 óðîâíÿ ñòðîåíèÿ:
- ïåðâè÷íàÿ ñòðóêòóðà áåëêà – ëèíåéíàÿ ïîñëåäîâàòåëüíîñòü àìèíîêèñëîò â ïîëèïåïòèäíîé öåïè, ñâåðíóòûõ â ïðîñòðàíñòâå:

- âòîðè÷íàÿ ñòðóêòóðà áåëêà – êîíôîðìàöèÿ ïîëèïåïòèäíîé öåïè, ò.ê. ñêðó÷èâàíèå â ïðîñòðàíñòâå çà ñ÷åò âîäîðîäíûõ ñâÿçåé ìåæäó NH è ÑÎ ãðóïïàìè. Åñòü 2 ñïîñîáà óêëàäêè: α-ñïèðàëü è β– ñòðóêòóðà.
α-ñïèðàëü Íà îäíîì âèòêå óêëàäûâàþòñÿ 4 àìèíîêèñëîòíûõ îñòàòêà, êîòîðûå íàõîäÿòñÿ ñíàðóæè ñïèðàëè. |
β-ñòðóêòóðà. Ïîëèïåïòèäíàÿ öåïü ðàñòÿíóòà, åå ó÷àñòêè ðàñïîëàãàþòñÿ ïàðàëëåëüíû äðóã äðóãó è óäåðæèâàþòñÿ âîäîðîäíûìè ñâÿçÿìè. |
- òðåòè÷íàÿ ñòðóêòóðà áåëêà – ýòî òðåõìåðíîå ïðåäñòàâëåíèå çàêðó÷åííîé α-ñïèðàëü èëè β-ñòðóêòóðû â ïðîñòðàíñòâå:

Ýòà ñòðóêòóðà îáðàçóåòñÿ çà ñ÷åò äèñóëüôèäíûõ ìîñòèêîâ –S-S- ìåæäó öèñòåèíîâûìè îñòàòêàìè.  îáðàçîâàíèè òàêîé ñòðóêòóðû ó÷àñòâóþò ïðîòèâîïîëîæíî çàðÿæåííûå èîíû.
- ÷åòâåðòè÷íàÿ ñòðóêòóðà áåëêà îáðàçóåòñÿ çà ñ÷åò âçàèìîäåéñòâèÿ ìåæäó ðàçíûìè ïîëèïåïòèäíûìè öåïÿìè:

Ñèíòåç áåëêà.
 îñíîâå ñèíòåçà ëåæèò òâåðäîôàçíûé ìåòîä, â êîòîðîì ïåðâàÿ àìèíîêèñëîòà çàêðåïëÿåòñÿ íà ïîëèìåðíîì íîñèòåëå, à ê íåé ïîñëåäîâàòåëüíî ïîäøèâàþòñÿ íîâûå àìèíîêèñëîòû. Ïîñëå ïîëèìåð îòäåëÿþò îò ïîëèïåïòèäíîé öåïè.
Ôèçè÷åñêèå ñâîéñòâà áåëêà.
Ôèçè÷åñêèå ñâîéñòâà áåëêà îïðåäåëÿþòñÿ ñòðîåíèåì, ïîýòîìó áåëêè äåëÿò íà ãëîáóëÿðíûå (ðàñòâîðèìûå â âîäå) è ôèáðèëëÿðíûå (íåðàñòâîðèìûå â âîäå).
Õèìè÷åñêèå ñâîéñòâà áåëêîâ.
1. Äåíàòóðàöèÿ áåëêà (ðàçðóøåíèå âòîðè÷íîé è òðåòè÷íîé ñòðóêòóðû ñ ñîõðàíåíèåì ïåðâè÷íîé). Ïðèìåð äåíàòóðàöèè – ñâåðòûâàíèå ÿè÷íûõ áåëêîâ ïðè âàðêå ÿèö.
2. Ãèäðîëèç áåëêîâ – íåîáðàòèìîå ðàçðóøåíèå ïåðâè÷íîé ñòðóêòóðû â êèñëîì èëè ùåëî÷íîì ðàñòâîðå ñ îáðàçîâàíèåì àìèíîêèñëîò. Òàê ìîæíî óñòàíîâèòü êîëè÷åñòâåííûé ñîñòàâ áåëêîâ.
3. Êà÷åñòâåííûå ðåàêöèè:
Áèóðåòîâàÿ ðåàêöèÿ – âçàèìîäåéñòâèå ïåïòèäíîé ñâÿçè è ñîëåé ìåäè (II) â ùåëî÷íîì ðàñòâîðå. Ïî îêîí÷àíèþ ðåàêöèè ðàñòâîð îêðàøèâàåòñÿ â ôèîëåòîâûé öâåò.
Êñàíòîïðîòåèíîâàÿ ðåàêöèÿ – ïðè ðåàêöèè ñ àçîòíîé êèñëîòîé íàáëþäàåòñÿ æåëòîå îêðàøèâàíèå.
Áèîëîãè÷åñêîå çíà÷åíèå áåëêà.
1. Áåëêè – ñòðîèòåëüíûé ìàòåðèàë, èç íåãî ïîñòðîåíû ìûøöû, êîñòè, òêàíè.
2. Áåëêè – ðåöåïòîðû. Ïåðåäàþò è âîñïðèíèìàþò ñèãíàë, ïîñòóïàþùèõ îò ñîñåäíèõ êëåòîê èç îêðóæàþùåé ñðåäû.
3. Áåëêè èãðàþò âàæíóþ ðîëü â èììóííîé ñèñòåìå îðãàíèçìà.
4. Áåëêè âûïîëíÿþò òðàíñïîðòíûå ôóíêöèè è ïåðåíîñÿò ìîëåêóëû èëè èîíû â ìåñòî ñèíòåçà èëè íàêîïëåíèÿ. (Ãåìîãëîáèí ïåðåíîñèò êèñëîðîä ê òêàíÿì.)
5. Áåëêè – êàòàëèçàòîðû – ôåðìåíòû. Ýòî î÷åíü ìîùíûå ñåëåêòèâíûå êàòàëèçàòîðû, êîòîðûå óñêîðÿþò ðåàêöèè â ìèëëèîíû ðàç.
Åñòü ðÿä àìèíîêèñëîò, êîòîðûå íå ìîãóò ñèíòåçèðîâàòüñÿ â îðãàíèçìå – íåçàìåíèìûå, èõ ïîëó÷àþò òîëüêî ñ ïèùåé: òèçèí, ôåíèëàëàíèí, ìåòèíèí, âàëèí, ëåéöèí, òðèïòîôàí, èçîëåéöèí, òðåîíèí.
Источник
Белки – высокомолекулярные соединения, построенные из аминокислот и являются одними из наиболее сложных по строению и составу среди всех органических соединений.
Биологическая роль белков исключительно велика: они составляют основную массу протоплазмы и ядер живых клеток. Белковые вещества находятся во всех растительных и животных организмах. О запасе белков в природе можно судить по общему количеству живого вещества на нашей планете: масса белков составляет примерно 0,01% от массы земной коры, то есть 1016 тонн.
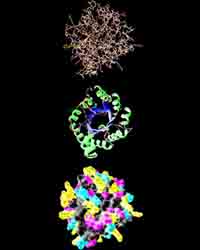 Молекулы белка
Молекулы белка
Белки по по своему элементному составу отличаются от углеводов и жиров: кроме углерода, водорода и кислорода они ещё содержат азот. Кроме того, Постоянной составной частью важнейших белковых соединений является сера, а некоторые белки содержат фосфор, железо и йод.
Свойства белков
1. Разная растворимость в воде. Растворимые белки образуют коллоидные растворы.
2. Гидролиз – под действием растворов минеральных кислот или ферментов происходит разрушение первичной структуры белка и образование смеси аминокислот.
3. Денатурация – частичное или полное разрушения пространственной структуры, присущей данной белковой молекуле. Денатурация происходит под действием:
- – высокой температуры
- – растворов кислот, щелочей и концентрированных растворов солей
- – растворов солей тяжёлых металлов
- – некоторых органических веществ (формальдегида, фенола)
- – радиоактивного излучения
Строение белков
Строение белков начали изучать в 19 веке. В 1888г. русский биохимик А.Я.Данилевский высказал гипотезу о наличии в белках амидной связи. Эта мысль в дальнейшем была развита немецким химиком Э.Фишером и в его работах нашла экспериментальное подтверждение. Он предложил полипептидную теорию строения белка. Согласно этой теории молекула белка состоит из одной длинной цепи или нескольких полипептидных цепей, связанных друг с другом. Такие цепи могут быть различной длины.
Фишером проведена большая экспериментальная работа с полипептидами. Высшие полипептиды, содержащие 15-18 аминокислот, осаждаются из растворов сульфатом аммония (аммиачными квасцами), то есть проявляют свойства, характерные для белков. Было показано, что полипептиды расщепляются теми же ферментами, что и белки, а будучи введёнными в организм животного, подвергаются тем же превращениям, как и белки, а весь их азот выделяется нормально в виде мочевины (карбамида).
Исследования, проведённые в 20 веке, показали, что существует несколько уровней организации белковой молекулы.
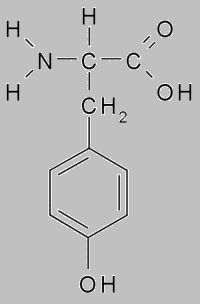 Белок тирозин
Белок тирозин
В организме человека тысячи различных белков и практически все они построены из стандартного набора 20 аминокислот. Последовательность аминокислотных остатков в молекуле белка называют первичной структурой белка. Свойства белков и их биологические функции определяются последовательностью аминокислот. Работы по выяснению первичной структуры белка впервые были выполнены в Кембриджском университете на примере одного из простейших белков – инсулина. В течение посте 10 лет английский биохимик Ф.Сенгер проводил анализ инсулина. В результате анализа выяснено, что молекула инсулина состоит из двух полипептидных цепей и содержит 51 аминокислотный остаток. Он установил, что инсулин имеет молярную массу 5687 г/моль, а его химический состав отвечает формуле C254H337N65O75S6. Анализ проводился вручную с использованием ферментов, которые избирательно гидролизуют пептидные связи между определёнными аминокислотными остатками.
В настоящее время большая часть работы по определению первичной структуры белков автоматизирована. Так была установлена первичная структура фермента лизоцима.
Тип “укладки” полипептидной цепочки называют вторичной структурой. У большинства белков полипептидная цепь свёртывается в спираль, напоминающую “растянутую пружину” (называют “А-спираль” или “А-стуктура”). Еще один распространённый тип вторичной структуры – структура складчатого листа (называют “B – структура”). Так, белок шёлка – фиброин имеет именно такую структуру. Он состоит из ряда полипептидных цепей, которые располагаются параллельно друг-другу и соединяются посредством водородных связей, большое число которых делает шёлк очень гибким и прочным на разрыв.
При всём этом практически не существует белков, молекулы которых на 100% имеют “А-структуру” или “B – структуру”.
 Белок фиброин – белок натурального шёлка
Белок фиброин – белок натурального шёлка
Пространственное положение полипептидной цепи называют третичной структурой белкой. Большинство белков относят к глобулярным, потому что их молекулы свёрнуты в глобулы. Такую форму белок поддерживает благодаря связям между разнорзаряженными ионами (-COO- и -NH3+ и дисульфидных мостиков. Кроме того, молекула белка свёрнута так, что гидрофобные углеводородные цепи оказываются внутри глобулы, а гидрофильные – снаружи.
Способ объединения нескольких молекул белка в одну макромолекулу называют четвертичной стуктурой белка. Ярким примером такого белка может быть гемоглобин. Было установлено, что, например, для взрослого человека молекула гемоглобина состоит из 4-х отдельных полипептидных цепей и небелковой части – гема.
Свойства белков объясняет их различное строение. Большинство белков аморфно, в спирте, эфире и хлороформе нерастворимо. В воде некоторые белки могут растворяться с образованием коллоидного раствора. Многие белки растворимы в растворах щелочей, некоторые – в растворах солей, а некоторые – в разбавленном спирте. Кристаллическое состояние белов встречается редко: примером могут быть алейроновые зёрна, встречающиеся в клещевине, тыкве, конопле. Кристаллизуется также альбумин куриного яйца и гемоглобин в крови.
Гидролиз белков
При кипячении с кислотами или щелочами, а также под действием ферментов белки распадаются на более простые химические соединения, образуя в конце цепочки превращения смесь A-аминокислот. Такое расщепление называется гидролизом белка. Гидролиз белка имеет большое биологическое значение: попадая в желудок и кишечник животного или человека, белок расщепляется под действием ферментов на аминокислоты. Образовавшиеся аминокислоты в дальнейшем под влиянием ферментов снова образуют белки, но уже характерные для данного организма!
В продуктах гидролиза белков кроме аминокислот были найдены углеводы, фосфорная кислота, пуриновые основания. Под влиянием некоторых факторов например, нагревания,растворов солей, кислот и щелочей, действия радиации, встряхивания, может нарушиться пространственная структура, присущая данной белковой молекуле. Денатурация может носить обратимый или необратимый характер, но в любом случае аминокислотная последовательность, то есть первичная структура, остаётся неизменной. В результате денатурации белок перестаёт выполнять присущие ему биологические функции.
Для белков известны некоторые цветные реакции, характерные для их обнаружения. При нагревании мочевины образуется биурет, который с раствором сульфата меди в присутствии щелочи даёт фиолетовое окрашивание или качественная реакция на белок, которую можно провести дома). Биуретовую реакцию даёт вещества, содержащие амидную группу, а в молекуле белка эта группа присутствует.
Ксантопротеиновая реакция заключается в том, что белок от концентрированной азотной кислоты окрашивается в жёлтый цвет. Эта реакция указывает на наличие в белке бензольной группы, которая имеется в таких аминокислотах, как фениланин и тирозин.
При кипячении с водным раствором нитрата ртути и азотистой кислоты, белок даёт красное окрашивание. Эта реакция указывает на наличие в белке тирозина. При отсутствии тирозина красного окрашивания не появляется.
Источник
Содержание статьи:
- Что такое белок
- Виды белков
- Синтез белка
- Состав белков
- Свойства
- Функции белков
- Строение
- Переваривание белков
- Обмен белков в организме
- Продукты богатые белком
- Норма в день для организма
- Усваиваемость белка
- Вред белков
Белки – это важные компоненты, которые имеют большое значение для нормальной работы организма. Источниками этих веществ являются животные и растительные продукты. Чтобы белковые элементы полноценно усваивались организмом, необходимо правильно употреблять их.

Что такое белок
Белок – это органическое соединение, которое включает альфа-аминокислоты. Они соединяются в цепь пептидной связью. В живых организмах белковый состав определяется генетическим кодом. В процессе выработки этих веществ обычно принимает участие 20 аминокислот. Их сочетания создают белковые молекулы, которые отличатся своими свойствами.
Виды белков

Виды белков бывают следующие:
- Белки куриных яиц. Они усваиваются лучше всего и считаются эталонными. Всем известно, что яйца включают белок, который почти на 100 % состоит из альбумина, и желток.
- Казеин. При попадании в желудок вещество превращается в сгусток, который долгое время переваривается. Это обеспечивает невысокую скорость расщепления белка, что провоцирует стабильное снабжение организма аминокислотами.
- Белки молочной сыворотки. Такие компоненты расщепляются быстрее всего. Уровень аминокислот и пептидов в крови увеличивается уже в течение 1 часа после употребления таких продуктов. При этом кислотообразующая функция желудка остается неизменной.
- Соевые белки. Такие вещества имеют сбалансированный состав важных аминокислот. После употребления подобных продуктов снижается содержание холестерина. Потому такую пищу стоит есть людям с лишним весом. При этом главным минусом соевых белков считается наличие ингибитора пищеварительного фермента трипсина.
- Растительные белки. Такие вещества усваиваются человеческим организмом достаточно плохо. Их клетки обладают толстыми оболочками, которые не поддаются влиянию пищеварительного сока. Также проблемы с усвоением обусловлены наличием ингибиторов пищеварительных ферментов в отдельных растениях.
- Рыбный белок. Изолят рыбного белка достаточно медленно расщепляется до состояния аминокислот.
Синтез белка

Синтез белка осуществляется в особых частицах – рибосомах.
Этот процесс происходит в несколько стадий:
- активация аминокислот;
- инициация белковой цепи;
- элонгация;
- терминация;
- сворачивание и процессинг.
Состав белков

Состав белков представляет собой линейные полимеры, которые включают остатки α-L-аминокислот. Также в белковых молекулах могут присутствовать модифицированные аминокислотные остатки и составляющие неаминокислотной природы.
Аминокислоты обозначают сокращениями, включающими 1 или 3 буквы. Белки, которые имеют длину от 2 до нескольких десятков аминокислотных остатков, называют пептидами. Если наблюдается высокая степень полимеризации, их именуют белками. Однако такое деление считается достаточно условным.
Свойства белков

Для белков характерны следующие свойства:
- Различная растворимость в воде. Белковые элементы, которые растворяются, приводят к формированию коллоидных растворов.
- Гидролиз. Под влиянием ферментов или растворов минеральных кислот разрушается первичное строение белка и формируется смесь аминокислот.
- Денатурация. Под этим термином понимают частичное или полное разрушение структуры белковой молекулы. Этот процесс может происходить под воздействием разных факторов – повышенных температур, растворов солей тяжелых металлов, кислот или щелочей, радиоактивного излучения, отдельных органических веществ.
Функции белков
Рассмотрим детальнее ряд важных функций белков:
- Строительная. Такие вещества принимают участие в формировании клеток и внеклеточных элементов. Они присутствуют в составе мембранклеток, сухожилий, волос.
- Транспортная. Белковый компонент крови, который называется гемоглобином, присоединяет кислород и распространяет его в разные ткани и органы. После чего обратно переносит углекислый газ.
- Регуляторная. Гормоны белкового характера участвуют в обменных процессах. Инсулин отвечает за регуляцию содержания глюкозы в крови, обеспечивает выработку гликогена, повышает трансформацию углеводов в жиры.
- Защитная. При попадании в организм инородных объектов или микроорганизмов вырабатываются особенные белки – антитела. Они помогают связать и нейтрализовать антигены. Фибрин, который вырабатывается из фибриногена, останавливает кровотечения.
- Двигательная. Существуют особые сократительные белковые элементы. К ним относят актин и миозин. Эти веществаобеспечивают сокращение мышечных тканей.
- Сигнальная. В поверхностной клеточной мембране присутствуют белковые молекулы, которые могут менять третичную структуру под влиянием внешних факторов. Это помогает принимать сигналы извне и передавать в клетку команды.
- Запасающая. У животных белковые вещества обычно не запасаются. К исключениям относят яичный альбумин и казеин, который присутствует в молоке. При этом белки способствуют скоплению определенных веществ. Распад гемоглобина приводит к тому, что железо не выводится, а сохраняется. Благодаря этому формируется комплекс с ферритином.
- Энергетическая. Распад 1 г белка сопровождается синтезом 17,6 кДж энергии. Вначале белковые элементы распадаются до аминокислот, а затем – до конечных продуктов. В результате вырабатывается вода, аммиак и углекислый газ. При этом белки применяются в качестве источника энергии лишь в том случае, если остальные – израсходованы.
- Каталитическая. Это одна из наиболее важных функций белковых элементов. За нее отвечают ферменты, которые активизируют биохимические процессы в клеточных структурах.
Строение белков

Среди органических веществ белки, которые называются биополимерами, считаются самыми многочисленными. Они отличаются разнообразием. На долю этих веществ приходится 50-80 % сухой массы клетки.
Белковые молекулы отличаются большими размерами. Потому их нередко именуют макромолекулами. В строение белков входят углерод, водород, азот, кислород. Помимо этого, в них могут присутствовать сера, железо, фосфор.
Белки отличаются числом – от 100 до нескольких тысяч, составом, последовательностью мономеров. В качестве мономеров выступают аминокислоты.
Переваривание белков

Белки усваиваются в желудке и тонком кишечнике. Процесс переваривания представляет собой гидролитическое расщепление белков до аминокислот.
Он имеет определенные особенности:
- протеолитические ферменты продуцируются в неактивном состоянии;
- активирование наблюдается в просвете пищеварительного тракта за счет частичного протеолиза;
- протеазы пищеварительного тракта характеризуются субстратной специфичностью – они могут относиться к эндопептидам или экзопептидазам.
Основным ферментом желудка, который расщепляет белки, считается пепси. Он синтезируется в неактивном состоянии и представляет собой профермент пепсиноген. Под воздействием соляной кислоты наблюдается частичный протеолиз пепсиногена. В результате появляется активная форма – пепсин.
Обмен белков в организме

Обмен белков в организме значительно сложнее, чем метаболизм липидов или углеводов. Жирные кислоты попадают в клетки почти в исходном виде, а углеводы – служат источником энергии. При этом основной строитель мышц претерпевает немало изменений в организме. На отдельных этапах белок преобразуется в углеводы. Как следствие, вырабатывается энергия.
Существует несколько этапов белкового обмена, для каждого из которых характерны определенные особенности:
- Попадание белков в организм. Под действием слюны происходит расщепление связей гликогена. Как следствие, формируется глюкоза, доступная для усвоения. Оставшиеся ферменты запечатываются. На этой стадии белки, которые присутствуют в продуктах, распадаютсяна отдельные элементы.Впоследствии они будут перевариваться.
- Переваривание. Под действием панкреатина и остальных ферментов наблюдается последующая денатурация до белков первого порядка. Организм способен получать аминокислоты исключительно из простейших белковых цепей. Для этого он вырабатывает кислоту. Это облегчает расщепление веществ.
- Расщепление на аминокислоты. Под действием клеток слизистых оболочек кишечника денатурированные белки попадают в кровь. Простой белок преобразуется организмом в аминокислоты.
- Расщепление до энергии. Под действием большого количества заменителей инсулина и ферментов для усваивания углеводов белок трансформируется в глюкозу. При нехватке энергии организм не выполняет денатурацию белка, а сразуегорасщепляет. В результате вырабатывается чистая энергия.
- Перераспределение аминокислот. Белковые элементы циркулируют в системном кровотоке и под действием инсулина попадают во все клетки. Как следствие, образуются требуемые аминокислотные связи. По мере распространения белков по организму происходит восстановление фрагментов мышечных элементов и структур, которые связаны со стимуляцией выработки, работой мозга, дальнейшей ферментацией.
- Образование новых белковых структур. Аминокислоты связываются с микроразрывами в мышцах и приводят к созданию новых тканей. Как следствие, наблюдается гипертрофия мышц. Аминокислоты в требуемом составе трансформируются в мышечно-белковую ткань.
- Обмен белков. При избытке таких структур под влиянием инсулина они снова проникают в систему кровообращения. Это приводит к формированию новых структур. При существенном напряжении в мышцах, длительном голодании или в период заболевания организм использует белки для компенсации недостатка аминокислот в остальных тканях.
- Перемещение липидных структур. Белки, которые соединяются в фермент липазу, способствуют перемещению и перевариванию с желчью полинасыщенных жирных кислот. Эти элементы принимают участие в перемещении жиров и выработке холестерина. С учетом состава аминокислот белки могут синтезироваться в полезный или вредный холестерин.
- Выведение окисленных продуктов. Использованные аминокислоты покидают организм с продуктами обмена. Мышцы, которые повреждаются вследствие нагрузок, тоже выводятся из организма.
Продукты богатые белком

Существует довольно много источников таких элементов. Животные продукты богатые белком, бывают следующие:
- Куриное мясо. 100 г продукта включает около 20 г белков. При этом такое мясо почти не содержит жира. Это актуально для людей, которые контролируют свой вес или занимаются спортом.
- Рыба. Самыми ценными источниками белка считаются тунец и лосось. Помимо этого, в продуктах имеются ценные кислоты омега-3, которые обеспечивают стабилизацию функций сердца и улучшают настроение.
- Свинина. В зависимости от жирности мяса в 100 г продукта может присутствовать 11-16 г белков. Также свинина включает витамины группы В.
- Яйца. В 1 яйце присутствует 6 г белка. Также продукт включает витамин В12 и холин.
- Говядина. На 100 г продукта приходится 19 г белков. Также говядина включает железо, карнитин и креатин
К растительным источникам белков стоит отнести следующее:
- Бобовые. Эти продукты включают большое количество белков. 100 г гороха содержит 23 г этих компонентов, а в сое присутствует 34 г белков.
- Орехи. Они представляют собой ценные источники белков и включают ненасыщенные жирные кислоты.
- Грибы. Эти продукты включают 2-5 % белков от общего количества. При этом есть сведения, что пищевые компоненты из грибов усваиваются с большим трудом.
- Гречка. В 100 г продукта присутствует 13 г белков. В гречке нет глютена, потому она вызывает аллергических реакций. При этом крупа включает фитонутриенты, которые сказываются на выработке инсулина и восстанавливают метаболизм.
Норма белка в день для организма

Норма белка в день для организма взрослого человека составляет минимум 50 г в чистом виде, что соответствует 150 г белого мяса или рыбы. Люди, которые активно занимаются спортом и нацелены на развитие мышечных тканей, должны употреблять большее количество белков.
Для профилактики распада мышечной ткани женщины должны употреблять минимум 1 г белка на 1 кг веса. Однако оптимальным количеством считается 2 г. Для мужчин этот параметр увеличивается до 3 г. Это означает, что представитель сильного пола весом 90 кг должен съедать в день 270 г чистого белка.
Усваиваемость белка

При употреблении таких веществ, стоит помнить о чувстве меры. Избыточное количество белков представляет определенную опасность. Они с трудом перевариваются и могут вызвать нарушения пищеварительных функций.
Проблемы с усвоением белков могут возникать в следующих ситуациях:
- Избыточное количество белка за 1 прием пищи. За 1 прием организм не может усвоить больше 35 г белков. Помимо этого, избыток таких веществ отрицательно влияет на пищеварительные функции. Организм не способен переварить большое количество протеинов. Как следствие, неусвоенная часть начинает гнить в пищеварительных органах. Это провоцирует запоры, увеличение ацетона и нарушения в работе поджелудочной железы.
- Систематическое переедание. Диетологи советуют придерживаться принципов дробного питания – 4-5 раз в день. Это помогает лучше переваривать пищу, в том числе и белки.
- Употребление большого количества трудноперевариваемых белков. Протеины могут усваиваться в разном объеме. Есть белки, которые легко перевариваются. Однако существуют и трудноперевариваемые продукты. Эталоном белковой пищи считаются куриные яйца. Также к легким белкам относят нежирные кисломолочные продукты, куриное филе, кролика.
- Исключение жиров. Безусловно, жирные продукты содержат большое количество калорий и с трудом усваиваются. Однако полностью отказываться от них не следует. Это чревато гормональными нарушениями, ухудшением состояния волос и кожи. Также исключение жиров провоцирует нарушение процесса переваривания белков. Чтобы обеспечить эффективную работу печени и выведение продуктов синтеза белка, стоит включать в рацион желчегонные жиры. Они присутствуют в оливковом и кунжутном маслах.
- Дефицит жидкости. Нарушение питьевого режима провоцирует разные проблемы, включая ухудшение усвоения белка. В сутки человек должен пить 30-40 мл воды на 1 кг массы тела. В жаркую погоду или при серьезных физических нагрузках норма дополнительно повышается на 500-800 мл.
- Неправильные дополнения к белкам. Чтобы протеины усваивались максимально хорошо, их рекомендуется сочетать с овощами. В такой пище присутствуют ферменты и клетчатка. Это облегчает переваривание белков.
Вред белков

Нарушения белкового обмена представляют большой вред для организма. Эти вещества принимают участие почти во всех физиологических процессах. При нарушении обмена белков есть риск развития опасных нарушений.
При этом для здоровых людей белки представляют опасность лишь при избыточном потреблении в течение долгого периода времени. При соблюдении белковых диет, которые базируются на употреблении большого количества протеинов, нужно помнить о чувстве меры. Такие системы питания должны быть кратковременными и плавными.
Избыточное количество белков в рационе провоцирует поражение почек и печени. Это связано со сложным процессом выведения веществ. В этом случае вырабатываются кетоновые тела, которые провоцируют отравление организма.
При некоторых патологиях есть противопоказания к употреблению белков. К ним относят подагру, недостаточность почек и печени, хроническую форму панкреатита.
Белки представляют собой ценные вещества, которые принимают участие во всех физиологических процессах. Потому каждый человек должен употреблять достаточное количество протеинов. При этом необходимо помнить о чувстве меры и соблюдать рекомендации врачей.
Источник


