Какими общими свойствами обладают вещества находящиеся в газообразном состоянии

На сегодняшний день известно о существовании более чем 3 миллионов различных веществ. И цифра эта с каждым годом растет, так как химиками-синтетиками и другими учеными постоянно производятся опыты по получению новых соединений, обладающих какими-либо полезными свойствами.
Часть веществ – это природные обитатели, формирующиеся естественным путем. Другая половина – искусственные и синтетические. Однако и в первом и во втором случае значительную часть составляют газообразные вещества, примеры и характеристики которых мы и рассмотрим в данной статье.

Агрегатные состояния веществ
С XVII века принято было считать, что все известные соединения способны существовать в трех агрегатных состояниях: твердые, жидкие, газообразные вещества. Однако тщательные исследования последних десятилетий в области астрономии, физики, химии, космической биологии и прочих наук доказали, что есть еще одна форма. Это плазма.
Что она собой представляет? Это частично или полностью ионизированные газы. И оказывается, таких веществ во Вселенной подавляющее большинство. Так, именно в состоянии плазмы находятся:
- межзвездное вещество;
- космическая материя;
- высшие слои атмосферы;
- туманности;
- состав многих планет;
- звезды.
Поэтому сегодня говорят, что существуют твердые, жидкие, газообразные вещества и плазма. Кстати, каждый газ можно искусственно перевести в такое состояние, если подвергнуть его ионизации, то есть заставить превратиться в ионы.
Газообразные вещества: примеры
Примеров рассматриваемых веществ можно привести массу. Ведь газы известны еще с XVII века, когда ван Гельмонт, естествоиспытатель, впервые получил углекислый газ и стал исследовать его свойства. Кстати, название этой группе соединений также дал он, так как, по его мнению, газы – это нечто неупорядоченное, хаотичное, связанное с духами и чем-то невидимым, но ощутимым. Такое имя прижилось и в России.
Можно классифицировать все газообразные вещества, примеры тогда привести будет легче. Ведь охватить все многообразие сложно.
По составу различают:
- простые,
- сложные молекулы.
К первой группе относятся те, что состоят из одинаковых атомов в любом их количестве. Пример: кислород – О2, озон – О3, водород – Н2, хлор – CL2, фтор – F2, азот – N2 и прочие.
Ко второй категории следует относить такие соединения, в состав которых входит несколько атомов. Это и будут газообразные сложные вещества. Примерами служат:
- сероводород – H2S;
- хлороводород – HCL;
- метан – CH4;
- сернистый газ – SO2;
- бурый газ – NO2;
- фреон – CF2CL2;
- аммиак – NH3 и прочие.
Классификация по природе веществ
Также можно классифицировать виды газообразных веществ по принадлежности к органическому и неорганическому миру. То есть по природе входящих в состав атомов. Органическими газами являются:
- первые пять представителей предельных углеводородов (метан, этан, пропан, бутан, пентан). Общая формула CnH2n+2;
- этилен – С2Н4;
- ацетилен или этин – С2Н2;
- метиламин – CH3NH2 и другие.
К категории газов неорганической природы относятся хлор, фтор, аммиак, угарный газ, силан, веселящий газ, инертные или благородные газы и прочие.
Еще одной классификацией, которой можно подвергнуть рассматриваемые соединения, является деление на основе входящих в состав частиц. Именно из атомов состоят не все газообразные вещества. Примеры структур, в которых присутствуют ионы, молекулы, фотоны, электроны, броуновские частицы, плазма, также относятся к соединениям в таком агрегатном состоянии.
Свойства газов
Характеристики веществ в рассматриваемом состоянии отличаются от таковых для твердых или жидких соединений. Все дело в том, что свойства газообразных веществ особенные. Частицы их легко и быстро подвижны, вещество в целом изотропное, то есть свойства не определяются направлением движения входящих в состав структур.
Можно обозначить самые главные физические свойства газообразных веществ, которые и будут отличать их от всех остальных форм существования материи.
- Это такие соединения, которые нельзя увидеть и проконтролировать, ощутить обычными человеческими способами. Чтобы понять свойства и идентифицировать тот или иной газ, опираются на четыре описывающих их все параметра: давление, температура, количество вещества (моль), объем.
- В отличие от жидкостей газы способны занимать все пространство без остатка, ограничиваясь лишь величиной сосуда или помещения.
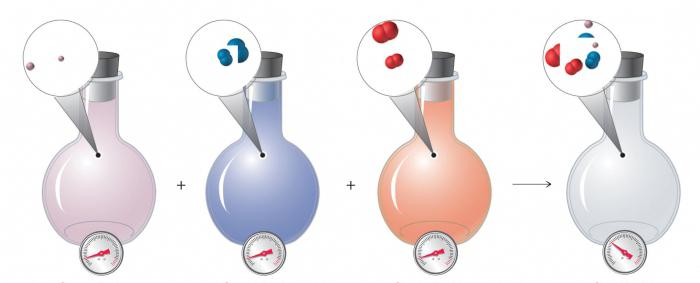
- Все газы между собой легко смешиваются, при этом у этих соединений нет поверхности раздела.
- Существуют более легкие и тяжелые представители, поэтому под действием силы тяжести и времени, возможно увидеть их разделение.
- Диффузия – одно из важнейших свойств этих соединений. Способность проникать в другие вещества и насыщать их изнутри, совершая при этом совершенно неупорядоченные движения внутри своей структуры.
- Реальные газы электрический ток проводить не могут, однако если говорить о разреженных и ионизированный субстанциях, то проводимость резко возрастает.
- Теплоемкость и теплопроводность газов невысока и колеблется у разных видов.
- Вязкость возрастает с увеличением давления и температуры.
- Существует два варианта межфазового перехода: испарение – жидкость превращается в пар, сублимация – твердое вещество, минуя жидкое, становится газообразным.
Отличительная особенность паров от истинных газов в том, что первые при определенных условиях способны перейти в жидкость или твердую фазу, а вторые нет. Также следует заметить способность рассматриваемых соединений сопротивляться деформациям и быть текучими.

Подобные свойства газообразных веществ позволяют широко применять их в самых различных областях науки и техники, промышленности и народном хозяйстве. К тому же конкретные характеристики являются для каждого представителя строго индивидуальными. Мы же рассмотрели лишь общие для всех реальных структур особенности.
Сжимаемость
При разных температурах, а также под влиянием давления газы способны сжиматься, увеличивая свою концентрацию и снижая занимаемый объем. При повышенных температурах они расширяются, при низких – сжимаются.
Под действием давления также происходят изменения. Плотность газообразных веществ увеличивается и, при достижении критической точки, которая для каждого представителя своя, может наступить переход в другое агрегатное состояние.
Основные ученые, внесшие вклад в развитие учения о газах
Таких людей можно назвать множество, ведь изучение газов – процесс трудоемкий и исторически долгий. Остановимся на самых известных личностях, сумевших сделать наиболее значимые открытия.
- Амедео Авогадро в 1811 году сделал открытие. Неважно, какие газы, главное, что при одинаковых условиях их в одном объеме их содержится равное количество по числу молекул. Существует рассчитанная величина, имеющая название по фамилии ученого. Она равна 6,03*1023 молекул для 1 моль любого газа.
- Ферми – создал учение об идеальном квантовом газе.
- Гей-Люссак, Бойль-Мариотт – фамилии ученых, создавших основные кинетические уравнения для расчетов.
- Роберт Бойль.
- Джон Дальтон.
- Жак Шарль и многие другие ученые.
Строение газообразных веществ
Самая главная особенность в построении кристаллической решетки рассматриваемых веществ, это то, что в узлах ее либо атомы, либо молекулы, которые соединяются друг с другом слабыми ковалентными связями. Также присутствуют силы ван-дер-ваальсового взаимодействия, когда речь идет о ионах, электронах и других квантовых системах.
Поэтому основные типы строения решеток для газов, это:
- атомная;
- молекулярная.
Связи внутри легко рвутся, поэтому эти соединения не имеют постоянной формы, а заполняют весь пространственный объем. Это же объясняет отсутствие электропроводности и плохую теплопроводность. А вот теплоизоляция у газов хорошая, ведь, благодаря диффузии, они способны проникать в твердые тела и занимать свободные кластерные пространства внутри них. Воздух при этом не пропускается, тепло удерживается. На этом основано применение газов и твердых тел в совокупности в строительных целях.

Простые вещества среди газов
Какие по строению и структуре газы относятся к данной категории, мы уже оговаривали выше. Это те, что состоят из одинаковых атомов. Примеров можно привести много, ведь значительная часть неметаллов из всей периодической системы при обычных условиях существует именно в таком агрегатном состоянии. Например:
- фосфор белый – одна из аллотропных модификаций данного элемента;
- азот;
- кислород;
- фтор;
- хлор;
- гелий;
- неон;
- аргон;
- криптон;
- ксенон.
Молекулы этих газов могут быть как одноатомными (благородные газы), так и многоатомными (озон – О3). Тип связи – ковалентная неполярная, в большинстве случаев достаточно слабая, но не у всех. Кристаллическая решетка молекулярного типа, что позволяет этим веществам легко переходить из одного агрегатного состояния в другое. Так, например, йод при обычных условиях – темно-фиолетовые кристаллы с металлическим блеском. Однако при нагревании сублимируются в клубы ярко-фиолетового газа – I2.

К слову сказать, любое вещество, в том числе металлы, при определенных условиях могут существовать в газообразном состоянии.
Сложные соединения газообразной природы
Таких газов, конечно, большинство. Различные сочетания атомов в молекулах, объединенные ковалентными связями и ван-дер-ваальсовыми взаимодействиями, позволяют сформироваться сотням различных представителей рассматриваемого агрегатного состояния.
Примерами именно сложных веществ среди газов могут быть все соединения, состоящие из двух и более разных элементов. Сюда можно отнести:
- пропан;
- бутан;
- ацетилен;
- аммиак;
- силан;
- фосфин;
- метан;
- сероуглерод;
- сернистый газ;
- бурый газ;
- фреон;
- этилен и прочие.
Кристаллическая решетка молекулярного типа. Многие из представителей легко растворяются в воде, образуя соответствующие кислоты. Большая часть подобных соединений – важная часть химических синтезов, осуществляемых в промышленности.
Метан и его гомологи
Иногда общим понятием “газ” обозначают природное полезное ископаемое, которое представляет собой целую смесь газообразных продуктов преимущественно органической природы. Именно он содержит такие вещества, как:
- метан;
- этан;
- пропан;
- бутан;
- этилен;
- ацетилен;
- пентан и некоторые другие.
В промышленности они являются очень важными, ведь именно пропан-бутановая смесь – это бытовой газ, на котором люди готовят пищу, который используется в качестве источника энергии и тепла.

Многие из них используются для синтеза спиртов, альдегидов, кислот и прочих органических веществ. Ежегодное потребление природного газа исчисляется триллионами кубометров, и это вполне оправданно.
Кислород и углекислый газ
Какие вещества газообразные можно назвать самыми широко распространенными и известными даже первоклассникам? Ответ очевиден – кислород и углекислый газ. Ведь это они являются непосредственными участниками газообмена, происходящего у всех живых существ на планете.
Известно, что именно благодаря кислороду возможна жизнь, так как без него способны существовать только некоторые виды анаэробных бактерий. А углекислый газ – необходимый продукт “питания” для всех растений, которые поглощают его с целью осуществления процесса фотосинтеза.
С химической точки зрения и кислород, и углекислый газ – важные вещества для проведения синтезов соединений. Первый является сильным окислителем, второй чаще восстановитель.
Галогены
Это такая группа соединений, в которых атомы – это частицы газообразного вещества, соединенные попарно между собой за счет ковалентной неполярной связи. Однако не все галогены – газы. Бром – это жидкость при обычных условиях, а йод – легко возгоняющееся твердое вещество. Фтор и хлор – ядовитые опасные для здоровья живых существ вещества, которые являются сильнейшими окислителями и используются в синтезах очень широко.
Источник
Газообразные вещества – вещества со слабыми связями между частицами. Главные свойства газов – это подвижность и хаотичное движение частиц, направление которых меняется при столкновении. Газ – одно из 4 агрегатных состояний веществ, которые на сегодняшний день известны науке.
Четыре агрегатных состояния вещества

Газообразное состояние вещества – одно из трех «классических». Помимо него, выделяются также твердые и жидкие вещества. В последнее время в учебниках встречается определение и четвертого агрегатного состояния – плазмы. Это ионизированные (частично или полностью) газы. Четвертый тип агрегатного состояния был выявлен при изучении космоса, и, оказывается, он встречается во Вселенной чаще всего. Плазма – это составная часть многих планет, основа звезд, туманностей, высших слоев атмосферы Земли.
Далее речь пойдет о газах. Они были открыты сравнительно недавно, позже жидких и твердых веществ, так как не поддавались изучению человеческим глазом. Развитие науки в сфере газообразных соединений началось с XVII века.
Краткая история открытия газов
Современное название газам дал Жан Баптист ван Гельмонт (1580-1644), голландский химик. В первые годы XVII века он экспериментальным путем впервые получил «мертвый воздух» (углекислый газ). С этого и началось изучение газообразных соединений. Слово «газ» Гельмонт выбрал для названия по аналогии с греческим словом «хаос», так как, по его словам, видел в полученном им «паре» сходство с «хаосом древних». Но некоторые ученые спорят, что принятое сейчас обозначение все же пошло от немецкого «gasen», что в переводе означает «кипеть».
Больше всего открытий ученые совершили позже, уже в XVIII-XIX веках. В 1802 г. французский исследователь Гей-Люссак открыл закон теплового расширения газов: при повышении температуры увеличивается объем газообразных веществ. Вдохновленный его примером, в 1811 итальянский химик Амедео Авогадро открыл закон, который позднее назвали его же именем. Закон звучит так: «число молекул всегда одно и то же в одинаковых объемах любых газов». Иными словами, в 1 моле любого газообразного вещества при одинаковых условиях (давление, температура) одно и то же число частиц. Это число – число Авогадро: 6,02 * 1023.
Помимо выделения общих законов, в тот же период ученые постепенно открывали отдельные газы:
- 1766 – Генри Кавендиш открыл водород («гремучий газ»);
- 1772 – Генри Кавендиш получил азот;
- 1774 – Джозеф Пристли в лабораторных условиях получил кислород;
- 1776 – Ж. Лассон впервые наблюдал образование угарного газа;
- 1886 – Анри Муссан выделил фтор;
- 1785 – М. Ван-Марум обнаружил озон и так далее.
На июль 2017 года открыто 826 газов, а в будущем, возможно, к газообразному агрегатному состоянию припишут еще 90 веществ. Многие открытые газы не природные, они получены в лабораторных условиях.
Свойства газообразных веществ
Выделяется целый ряд физических и химических свойств газов. Основные физические свойства:
- Газы способны занимать все отведенное им пространство, независимо от объема вещества. Это отличает их от жидкостей и твердых тел: и первые, и вторые занимают ограниченный объем. Простой пример данного свойства: если во время готовки закрыть кухню, запах останется только на ней. Если открыть дверь, он распространится по всей квартире. И в том, и в другом случае объем газа одинаковый.
- Газообразные вещества легко соединяются между собой. В полученных смесях нет четких границ: молекулы хаотично перемешиваются.
- Связи между частицами вещества очень слабые. Пространство между частицами в разы больше, чем размер самих частиц. Именно поэтому газы способны заполнять произвольные объемы.
- Объем газов может многократно сжиматься. Например, кислород можно сжать до 200 раз по сравнению с первоначальным объемом.
- Газы способны к диффузии, то есть к проникновению в другие вещества и перемешиванию. Это касается не только других газов, упомянутых выше. Например, частицы кислорода проникают в воду.
- Газы отличаются по тяжести молекул. В связи с этим, несмотря на диффузию, два газа с заметными различиями в массе постепенно разделятся.
- Газообразные вещества могут появляться путем межфазного перехода, то есть из других агрегатных состояний. Первый вариант межфазного перехода – испарение при нагреве жидкого вещества, второй – сублимация, при которой твердое вещество, минуя стадию жидкости, сразу становится газом.
- Газы не проводят электрический ток. Исключение составляют ионизированные вещества.
- У газов низкая теплопроводность и теплоемкость. Конкретные показатели зависят от типа молекул.
- Если газ находится под высоким давлением, он способен повредить стенки сосуда, если те недостаточно прочны. Объясняется это просто: чем больше давление, тем сильнее отталкиваются друг от друга частицы вещества. Потенциальная энергия газа увеличивается и вызывает взрывное расширение.
Если же газ подвергнуть высоким температурам, сначала он станет разреженным. Увеличится скорость теплового движения частиц. При достижении определенного температурного показателя произойдет тепловая ионизация, вещество перейдет в следующее агрегатное состояние – плазму.
Некоторые газы не имеют цвета, другие же заметны человеческому глазу. Например, I2, йод. Это вещество получают путем сублимации кристаллов йода, и его клубы имеют ярко выраженный фиолетовый оттенок. Но большинство соединений все же бесцветные, прозрачные и легкие, поэтому долгое время их не могли открыть и изучить.
Классификация газов

Вещества в газообразном состоянии принято делить на несколько категорий. Классификацию часто просят отразить в конспектах во время школьных занятий. Рассмотрим самые распространенные ее типы.
Органические и не органические
Органическими газами являются те вещества, которые содержат углерод. Примеры:
- этилен (С2Н4);
- метиламин (CH3NH2);
- ацетилен (C2H2).
Также к этой категории относятся метан, пропан, этан. Логично, что к неорганическим соединениям относятся те, в которых C отсутствует. Это аммиак, хлор и фтор, силан, гелий, неон, аргон и так далее. Инертные и благородные газы – не органические.
Простые и сложные
Органические и не органические газы, в свою очередь, делятся на простые и сложные. Перечисленные выше органические соединения – сложные. В них содержатся разные атомы: ацетилен (C2H2) – 2 атома углерода и 2 атома водорода, этилен (С2Н4) – 2 атома углерода и 4 водорода. Если же газ получается из одного или нескольких атомов одного и того же элемента таблицы Менделеева, его называют простым.
Простые газы: кислород O2, азот O3, водород H2, хлор Cl2. Перечислять можно и дальше.
Газообразные вещества в химии
Газы в химии начинают изучать в 8 классе. Рассмотрим основные свойства, которые принято включать в учебники по предмету.
Атомы или молекулы газов соединяются между собой ковалентными связями. Они очень слабые и часто рвутся, именно поэтому вещества в газообразном агрегатном состоянии способны заполнять произвольные объемы и емкости разных форм. Бывают два вида строения решеток у газов:
- атомная;
- молекулярная.
На уроках химии газообразные вещества часто получают в лабораторных условиях. Для этого могут пользоваться разными методами: нагревать жидкость, твердые вещества, добиваться реакции между сложными соединениями. Некоторые формулы реакций:
Zn + 2HCl = ZnCl2 + H2 – водород.
NH4Cl + NaOH = NaCl + H2O + NH3 – аммиак
CaCO3 + 2HCl = CaCl2 + H2O + CO2 – углекислый газ.
Так как многие газы прозрачны и не имеют запаха, используются дополнительные методы их обнаружения. Одни соединения усиливают пламя, другие останавливают горения. Ряд газообразных веществ может менять цвет взвешенной в воде извести, делать жидкость мутнее.
Примеры газов

В списке газов свыше 800 наименований. Стоит рассмотреть самые распространенные:
- Кислород. Формула – O Простой газ, который состоит из двух атомов кислорода. Отличительные особенности – отсутствие запаха, цвета и вкуса. По тяжести кислород немного превосходит воздух. Газ плохо растворяется в спирте и воде, из-за чего в жидкостях часто встречаются пузырьки кислорода. Диффузия хорошо проявляется в жидком серебре. Кислород – один из самых распространенных газов. В коре нашей планеты его 47%, в атмосфере – 20%, а в мировых водах 85%.
- Водород, обозначение – H Самый легкий из встречающихся в природе газ. Его масса меньше воздуха в 14 раз. Так же, как и кислород, бесцветен и безвкусен, полностью прозрачен. В воде растворение происходит плохо, но тот же процесс успешно протекает в палладии. Водород редко встречается в качестве отдельного элемента, большой процент частиц входит в различные соединения.
- Углекислый газ, CO Относится к сложным органическим газам. Объем в атмосфере – менее 1%. Способен кристаллизоваться при температуре -78,3 градуса по Цельсию, переходить в жидкое состояние при температуре 18-25 и давлении 6 Мпа. Тяжелее воздуха, но разница не такая значительная, как у водорода: масса больше в 1,5 раза. В обычных концентрациях у углекислого газа нет запаха и вкуса, но при больших скоплениях появляется кислый аромат (отсюда и название).
- Азот, N Занимает 78% атмосферы, но встречается и за пределами нашей планеты. В отличие от других газов, у азота прочная тройная связь, которую сложно разорвать. Азот растворяется в воде в 2 раза хуже, чем кислород, и в 8 раз хуже, чем водород. Вещество не имеет запаха.
Все перечисленные газы входят в состав воздуха и образуют земную атмосферу. Но большая часть, 98-99%, приходится на азот и кислород.
Если имеется желание, познакомиться с газообразными веществами поближе всегда можно при помощи лабораторных экспериментов. Однако при работе с газами нужно соблюдать предельную осторожность.
Источник
