Какими химическими свойствами обладают оксиды и гидроксиды элементов цинка и алюминия

Понятие об
амфотерных оксидах и гидроксидах
Первоначальная классификация химических элементов на металлы и неметаллы является
неполной. Существуют химические элементы и соответствующие им вещества, которые
проявляют двойственную природу – амфотерные свойства. Могут
взаимодействовать как с кислотами и кислотными оксидами, так и с основаниями и
основными оксидами, например,
а)
2Al(OH)3 + 3SO3 = Al2(SO4)3 +
3H2O
Al2O3 + 3H2SO4 =
Al2(SO4)3 + 3H2O
б)
2Al(OH)3 + Na2O = 2NaAlO2 +
3H2O
Al2O3 + 2NaOH = 2NaAlO2 +
H2O
Al(OH)3 ↔ H3AlO3 (ортоалюминиеваякислота) –H2O↔ HAlO2 (метаалюминиеваякислота), здесь AlO2 (I) – одновалентныйкислотныйостатокметаалюминат
Так,
гидроксид и оксид алюминия в реакциях (а) проявляют свойства основных гидроксидов
и оксидов, т.е. реагируют с кислотными гидроксидом и оксидом, образуя
соответствующую соль – сульфат алюминия Al2(SO4)3,
тогда как в реакциях (б) они же проявляют свойства кислотных гидроксидов
и оксидов, т.е. реагируют с основными гидроксидом и оксидом, образуя соль –
метаалюминат натрия NaAlO2. Если указанные реакции протекают в
водном растворе:
Al(OH)3 + NaOH = Na[Al(OH)4]
Другой
пример,
а)
Zn(OH)2 + SO3 = ZnSO4 + H2O
ZnO + H2SO4 = H2O
+ ZnSO4
б)
Zn(OH)2 + Na2O = Na2ZnO2 +
H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
ZnO + 2NaOH = Na2ZnO2 + H2O
Zn(OH)2↔H2ZnO2,
здесь ZnO2(II) – двухвалентный кислотный остаток цинкат.
Оксиды и
гидроксиды, которые способны реагировать и с кислотами, и со щелочами, называют
амфотерными.
Химические
элементы, которым соответствуют амфотерные оксиды и гидроксиды, обладают
переходными химическими свойствами, не относящимися ни к металлам, ни к
неметаллам, их называют амфотерными.
Амфотерность (от греч. amphoteros
– и тот, и другой) – способность химических соединений проявлять и кислотные, и
основные свойства в зависимости от природы реагента, с которым амфотерное
вещество вступает в кислотно-основное взаимодействие. Амфотерные оксиды и
гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные
свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным
оксидам соответствуют амфотерные гидроксиды, например,
ВeО – Вe(ОН)2,
Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Они являются слабыми
кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и
гидроксиды металлов, в которых валентность металла III, IV иногда II.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3,
SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных
подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и
некоторые другие.
Оксиды и гидроксиды, в которых валентность металла III, IV, являются,
как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3
и Fe(OH)3. Однако последние элементы в декадах d–элементов
(например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях
окисления, например, ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ
(нерастворимы в воде)
Амфотерный гидроксид | Кислотный остаток (А) | Оксид |
Zn(OH)2 | со щелочами проявляет кислотные H2ZnO2↔ZnO2 (II) кислотный остаток – цинкат | ZnO |
Al(OH)3 | со щелочами проявляет кислотные HAlO2↔AlO2 (I) кислотный остаток – метаалюминат | Al2O3 |
Be(OH)2 | со щелочами проявляет кислотные H2BeO2↔BeO2 (II) кислотный остаток – бериллат | BeO |
Cr(OH)3 | со щелочами проявляет кислотные HCrO2↔CrO2 (I) кислотный остаток – хромат | Cr2O3 |
1.Реагируют с кислотами: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2.Реагируют со щелочами: Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Видео “Амфотерные свойства гидроксида алюминия”
Видео “Получение и химические свойства амфотерных
гидроксидов”
Тренажёр “Амфотерные свойства оксида алюминия”
Тренажёр – виртуальная лаборатория “Амфотерные свойства оксида алюминия”
Применение
Из всех амфотерных гидроксидов наибольшее применение находит гидроксид
алюминия:
·
лекарственные препараты, приготовленные на
основе гидроксида алюминия, врач назначает при нарушении
кислотно-щелочного баланса в пищеварительном тракте;
·
в качестве антипирена (средства для
подавления способности гореть) вещество вводят в состав пластмасс и красок;
·
путём разложения гидроксида алюминия в
металлургии получают оксид алюминия (глинозём) — сырьё для получения
металлического алюминия.
Товары, в
производстве которых используется гидроксид алюминия: лекарственный препарат
«Алмагель» и металлургический глинозём
Гидроксид цинка в
промышленности служит сырьём для получения различных соединений этого металла,
в основном — солей.
Источник
Быстрая регистрация
После регистрации вы можете задавать вопросы и отвечать на них, зарабатывая деньги. Ознакомьтесь с правилами, будем рады видеть вас в числе наших экспертов!
Создать аккаунт
Вопрос
Imba
Imba
Imba
Imba
Imba
Imba
Imba
Imba
Imba
Imba
Загрузить ещё
Оксид – это соединение кислорода с элементом. Следовательно любой металл образует оксид. Есть четыре вида: основные, кислотные, амфотерные, индеферентные.
Спаивание алюминия осложняет оксидная плёнка. На этом металле она образуется мгновенно и препятствует прилипанию припоя. Но паять алюминий обычным паяльником всё же можно. Для этого существуют специальные припои и флюсы. Ныне приобрести их можно в интернет-магазинах, либо в специализированных магазинах и отделах.
Хотя спаять алюминиевые детали возможно без особых припоев и флюсов. Подобного рода хитрости были известны умельцам родом из СССР, где голь была на выдумку хитра.
Суть пайки … Читать далее
Да, оксид 3% также хорошо может закрасить седину, как и оксид 6%. Главное, подбираете нужный цвет, и смешивайте все в правильных пропорциях, например, в пропорции 1:1. То есть, количество краски должно быть равно количеству оксида.
Алюминиевый отливается цельным, из материала, который теплоемок и стоек к ржавчине, нет швов, меньше возможностей протечки, да она почти невозможна. Оребрение делается для того, чтобы повысить теплоотдачу. Все это позволяет быть алюминиевым батареям не огромными, и одновременно теплыми и надежными.
Биметаллические радиаторы похожи на алюминиевые тем, что у них алюминиевая конструкция сверху, но внутри стальные трубы. Как видим, протечь он может, потому что сначала делаются трубы, а … Читать далее
Разогревать или готовить еду в алюминиевой посуде в микроволновке можно, в отличие от посуды, даже стеклянной или керамической с напылением.
Микроволновки, которые были произведены до восьмидесятых годов, нельзя было использовать для приготовления и разогревания пищи в алюминиевой посуде из-за их конструкции.
Современные микроволновки позволяют использовать для приготовления или разогревания пищи алюминиевую … Читать далее
Если у вас в наличии имеется алюминий и хорошо оборудованная мастерская, то из этого металла можно изготовить много чего, начиная от простых заклёпок и заканчивая корпусами моторных катеров, лодок, парусных яхт, фюзеляжами и крыльями самолётов лёгкомоторной авиации.
Алюминий прекрасно формуется. Его можно гнуть, прокатывать через вальцы, штамповать, из него можно делать различное литьё. Таким образом можно наладить производство алюминиевого профиля. Имея профиль можно делать антенны … Читать далее
Оксид – продукт окисления или соединения простых веществ с кислородом. Приведем примеры оксидов.
Оксид углерода или углекислый газ – химическая формула – СО2.
Оксид водорода или вода – Н2О.
Оксид цинка – ZnO.
Цинк необходим каждому человеку для нормального развития костной ткани, роста, поддержания нормального уровня жизни. Без цинка ухудшается самочувствие, становится ломкими волосы, начинают крошится зубы.
Источник
Определение
Амфотерность (от др.-греч. амфотеро — «двойственный», «обоюдный») — способность некоторых соединений проявлять в зависимости от условий как кислотные, так и основные свойства.
Понятие амфотерность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром.
А. Ганч в рамках общей химической теории кислотно-основных взаимодействий (1917-1927 г.г.) предложил следующее определение:
Определение
Амфотерность — способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии, особенно в зависимости от свойств растворителя.
Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, то есть проявлять основные свойства.
Запомнить! Амфотерными свойствами обладают оксиды и гидроксиды
элементов главных подгрупп – бериллий, алюминий, галлий, мышьяк, сурьма, селен и др.,
элементов побочных подгрупп – хром, цинк, медь (II), железо (III), молибден, вольфрам и др.
Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер. Амфотерными свойствами обладают также некоторые органические соединения. Например, аминокислоты $(NH_2)R-COOH$, содержат в своей структуре одновременно карбоксильную группу -СООН, обуславливающую кислотные свойства, то есть являющуюся донором протона водорода, и амино-группу $NH_2$, обеспечивающую основные свойства, то есть являющуюся акцептором протонов водорода за счет неподеленной электронной пары азота.
Получение амфотерных гидроксидов
Общим способом получения амфотерных гидроксидов является осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента, например:
$ZnSO_4 + 2NaOH longrightarrow Zn(OH)_2 downarrow+ Na_2SO_4$
В ряде случаев при осаждении образуется не гидроксид, а гидрат оксида соответствующего элемента (например, гидраты оксидов железа(III), хрома(III), олова(II) и др.). Химические свойства таких гидратов по большей части аналогичны свойствам соответствующих гидроксидов.
Общие химические свойства амфотерных гидроксидов
Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами.
1. При нагревании разлагаются с образованием соответствующего амфотерного оксида, например:
$2Fe(OH)_3 xrightarrow{150-200^0 C} Fe_2O_3 + 3H_2O$
2. При взаимодействии с кислотами образуют растворимые соли, содержащие амфотерный катион, например:
$Zn(OH)_2 downarrow + 2HCl longrightarrow ZnCl_2 + 2H_2O$
3. При взаимодействии со щёлочью образуют растворимые соли с амфотерным элементом в анионе, например:
$Zn(OH)_2 downarrow + 2NaOH rightarrow Na_2[Zn(OH)_4]$
При сплавлении со щелочами образуют средние соли с амфотерным элементом в ионе кислотного остатка:
$Zn(OH)_2 downarrow + 2NaOH xrightarrow[]{t, ^circ C} Na_2ZnO_2 + 2H_2O$
Химические свойства амфотерных гидроксидов
Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями.
Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов. Например, для соединений хрома (III) характерны следующие реакции:
$Cr(OH)_3$ (тв) + $3HCl$ (р-р) $ longrightarrow CrCl_3$ (р-р) + $3H_2O$
$Cr(OH)_3$ (тв) + NaOH (р-р) + $2H_2O longrightarrow Na[Cr(OH)_4(H_2O)_2]$ (р-р)
$Cr_2O_3$ (тв) + 6HCl (р-р) $ longrightarrow 2CrCl_3$ (р-р) + $3H_2O$
$Cr_2O_3$ (тв) + $Na_2CO_3$ (плавл)$ longrightarrow 2NaCrO_2 + CO_2$ (газ)
Традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам не являются достаточно точными. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может быть описано как реакции ионного обмена гидратированных комплексов с ионами гидроксония и гидроксил-анионами $H_3O^+$ и $OH^–$. Например, для $Al(OH_3)$ ионные равновесия могут быть записаны следующим образом:
$[Al(OH)_3(H_2O)_3] + 3H_3O^+ leftrightarrow [Al(H_2O)_6]^{3+} + 3H_2O$ (в кислой среде)
$[Al(OH)_3(H_2O)_3] + 3OH^- leftrightarrow [Al(OH)_6]^{3-}$ (в щелочной среде)
В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа. Например, для цинка:
$ZnCl_2$ и $[Zn(H_2O)_4]SO_4$ (катионные))
$Na_2ZnO_2$ и $Na_2]Zn(OH)_4]$ (анионные).
Источник
Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CaO + H2O → Ca(OH)2
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи. При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
K2O + Al2O3 → 2KAlO2
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2—. Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:

Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe2+ можно окислить до иона Fe3+).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
FeO + C = Fe + CO

Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC2 + CO
Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
Fe2O3 + CO = Al2O3 + CO2
CuO + CO = Cu + CO2

4.2. Восстановление водородом.
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H2 = Cu + H2O

4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например, оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al2O3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Например, цезий взрывается на воздухе.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например: алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO

Железо можно вытеснить из оксида с помощью алюминия:
2Fe2O3 + 4Al → 4Fe + 2Al2O3
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например, аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe2+, Cr2+, Mn2+ и др.) могут выступать в качестве восстановителей.
Например, оксид железа (II) можно окислить кислородом до оксида железа (III):
4FeO + O2 = 2Fe2O3
Источник
Ключевые слова конспекта: амфотерность, амфотерные оксиды, амфотерные гидроксиды,
ГИДРОКСИДЫ
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
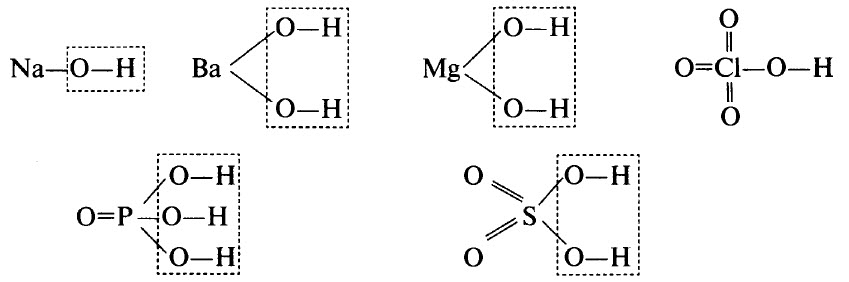
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
В результате реакций со щелочами в растворах образуются комплексные ионы – тетрагидроксоцинкаты (например, Na2[Zn(OH)4]), а при сплавлении – цинкаты (например, Na2ZnO2). Чтобы составить формулы цинкатов, запишите формулу гидроксида цинка Zn(OH)2 как формулу кислоты – H2ZnO2. Кислотным остатком такой кислоты является ион ZnO22–.
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н+ = Al3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
Чтобы составить формулы алюминатов, запишите формулу гидроксида алюминия Al(ОН)3 как H3AlO3. Теперь представьте, что от 1 моль этого соединения отщепляется 1 моль воды. Образуется соединение НАlO2, в котором кислотным остатком будет ион AlO2–.
В образовавшейся соли алюминий образует анион AlO2– (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4]–:
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока «Амфотерные оксиды и гидроксиды».
Следующая тема: «».
Источник

Оксиды и гидроксиды цинка и алюминия обладают амфотерными свойствами. Это значит, что они взаимодействуют как с кислотными оксидами и кислотами, так и с сильными основаниями (щелочами).
Свойства основания: Zn(OH)2+HNO3=Zn(NO3)2+2H2O
Кислотные свойства: NaOH+Al(OH)3=Na[Al(OH)4]