Какими химическими свойствами обладают этилен и его гомологи уравнения

Непредельные углеводороды, алкены
Таблица 2. Гомологический ряд алкенов.
| Название химического соединения | Структурная формула |
|---|---|
Этен (этилен) | C2H4 (СH2=CH2) |
Пропен (пропилен) | C3H6 (СH2=CH-CH3) |
Бутен | C4H8 |
Пентен | C5H10 |
Гексен | C6H12 |
Гептен | C7H14 |
Октен | C8H16 |
Нонен | C9H18 |
Декен | C10H20 |
Углеводородные радикалы, образованные от алкенов: — CH=CH2 – винил и –СН2 -СН=СН2 – аллил.
Изомерия
Для алкенов, начиная с бутена, характерна изомерия углеродного скелета:
CH2=CH-CH2-CH3 (бутен-1)
СН2-С(СН3)-СН3 (2-метилпропен-1)
и положения двойной связи:
CH2=CH-CH2-CH3 (бутен-1)
CH3-C=CH-CH3 (бутен-2)
Для алкенов, начиная с бутена-2, характерна геометрическая (цис-транс) изомерия (рис. 1).
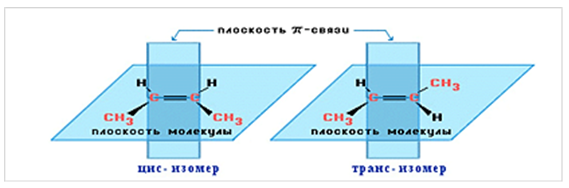
Рис. 1. Геометрические изомеры бутена-2.
Для алкенов, начиная с пропена, характерна межклассовая изомерия с циклоалканами. Так, составу C4H8 отвечают вещества класса алкенов и циклоалканов – бутен-1(2) и циклобутан.
Строение алкенов
Атомы углерода в молекулах алкенов находятся в sp2-гибридицациии: 3σ-связи располагаются в одной плоскости под углом 120![]() друг к другу, а π-связь образована p-электронами соседних атомов углерода. Двойная связь является сочетанием σ- и π-связей.
друг к другу, а π-связь образована p-электронами соседних атомов углерода. Двойная связь является сочетанием σ- и π-связей.
Физические свойства алкенов
При обычных условиях С2-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Получение
Основные способы получения алкенов:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-CHBr-CH3 + KOH = CH3-CH=CH-CH3 + KBr + H2O
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
CH3-CHCl-CHCl-CH3 + Zn = ZnCl2 + CH3-CH=CH-CH3
— дегидратация спиртов при их нагревании с серной кислотой (t >150![]() C) или пропускании паров спирта над катализатором
C) или пропускании паров спирта над катализатором
CH3-CH(OH)- CH3 = CH3-CH=CH2 + H2O
— дегидрирование алканов при нагревании (500![]() С) в присутствии катализатора (Ni, Pt, Pd)
С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH2 — CH3 = CH3-CH=CH2 + H2
Химические свойства
Большинство химических реакций алкенов протекают по механизму электрофильного присоединения:
— гидрогалогенирование – взаимодействие алкенов с галогенводородами (HCl, HBr), протекающее по правилу Марковникова (при присоединении полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрированному атому углерода при двойной связи)
CH3-CH=CH2 + HCl = CH3-CHCl-CH3
— гидратация — взаимодействие алкенов с водой в присутствии минеральных кислот (серной, фосфорной) с образованием спиртов, протекающее по правилу Марковникова
CH3-C(CH3)=CH2 + H2O = CH3-C(CH3)OH-CH3
— галогенирование — взаимодействие алкенов с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды
CH2=CH2 + Br2 = BrCH2-CH2Br
При нагревании смеси алкена с галогеном до 500![]() С возможно замещение атома водорода алкена по радикальному механизму:
С возможно замещение атома водорода алкена по радикальному механизму:
CH3-CH=CH2 + Cl2 = Cl-CH2-CH=CH2 + HCl
По радикальному механизму протекает реакция гидрирования алкенов. Условием протекания реакции является наличие катализоторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2=CH2 + H2 = CH3-CH3
Алкены способны окисляться с образованием различных продуктов, состав которых зависит от условий проведения реакции окисления. Так, при окислении в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомных спиртов:
3CH2=CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH
При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием кетоноы, карбоновых кислот или углекислого газа:
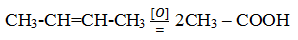
Окисление этилена кислородом при 200![]() С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2=CH2 +1/2O2 = CH3-CH=O
Алкены вступают в реакции полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов. Так, полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
n CH2=CH2 = -(-CH2-CH2-)n—
Примеры решения задач
Источник
Анонимный вопрос
7 декабря 2018 · < 100
Где используется этилен?
Применение и использование этилена (этена):
– как сырье в химической промышленности для органического синтеза различных органических соединений: галогенпроизводных, спиртов (этанола, этиленгликоля), винилацетата, дихлорэтан, винилхлорида, окиси этилена, полиэтилена, стирола, уксусной кислоты, этилбензола, этиленгликоля и пр.,
– в производстве полимеров.
Прочитать ещё 1 ответ
Какие углеводороды называются алкенами каковы их особенности химические свойства?
Люблю видеоигры, путешествия, электронику, урбанистику.
Алкены (олефины)–ненасыщенные ациклические углеводороды с одной двойной связью, общая формула гомологического ряда CnH2n. Название образуется от углеводорода с наиболее длинной цепью, содержащей двойную связь, с добавлением суффикса -ен. Цифрой указывается положение двойной связи.
Химические свойства:
Характер углерод – углеродной связи определяет тип химических реакций, в которые вступают органические вещества. Наличие в молекулах этиленовых углеводородов двойной углерод – углеродной связи обуславливает следующие особенности этих соединений:
– наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их в насыщенные возможно только в результате реакций присоединения, что является основной чертой химического поведения олефинов;
– двойная связь представляет собой значительную концентрацию электронной плотности, поэтому реакции присоединения носят электрофильный характер;
– двойная связь состоит из одной гамма- и одной П-связи, которая достаточно легко поляризуется.
Физические свойства:
- Температуры плавления и кипения алкенов (упрощённо) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При н.у. алкены с C2H4 до C4H8 — газы; с пентена C5H10 до гептадецена C17H34 включительно — жидкости, а начиная с октадецена C18H36 — твёрдые вещества. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Как этиловый и метиловый спирты влияют на нервную клетку? Какие необратимые процессы происходят в ней?
Естественные науки, НАУЧПОП.
Более ядовиты продукты метаболизма этилового и метилового спирта.
В печени имеется 2 фермента, способных “утилизировать” поступившие спирты. Метанол под действием фермента алкогольдегидрогеназа распадается на формальдегид, а этанол на ацетальдегид. Формальдегид токсичнее ацетальдегида, поэтому и метанол считается более опасным в сравнении с этанолом. Затем, спустя какое-то время альдегиды под действией другого фермента – альдегиддегидрогеназы распадаются до соответствующих карбоновых кислот – муравьиная (метановая) для метанола, и уксусная (этановая) для этанола. Эти соединения уже не представляют никакой угрозы для организма, позже они распадаются с образованием углекислого газа и воды. Но фермент альдегиддегидрогеназа работает у всех с разной скоростью, и поэтому алкогольное опьянение длится у всех по разному.
Метанол вызывает слепоту именно из-за пораженияглазного нерва.
Прочитать ещё 1 ответ
Для какого вещества характерна реакция гидрирования?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
Гидрирование-это реакция присоединения Н2 к органическим соединениям????
Она характерна для
????Для веществ с двойными и тройными связями
СН2=СН-СН2-СН3+Н2->
СН3-СН2-СН2-СН3
У бутена-1 двойная связь разорвалась, и к атомам С прикрепились водороды) получили бутан
Если гидрированию подвергнем алкины, то получим алкены(если Н2 мало) или алканы(если водорода много) ????
????СН≡С-СН3+Н2->СН2=СН-СН3 (пропин-1->пропен-1)
????СН≡С-СН3+2Н2->СН3-СН2-СН3
(пропин-1->пропан)
????Для альдегидов и кетонов
Если гидрируем альдегид получим первичный спирт, если кетон-вторичный
????СН3-СНО+Н2->СН3-СН2-ОН
(ацетальдегид->этанол)
????СН3-СО-СН3+Н2->СН3-СН(ОН)-СН3
(ацетон – >пропанол-2)
Все эти реакции идут при 400 градусах и катализоторе Ni????
Прочитать ещё 1 ответ
Источник
Формула – С2Н4 (СН2 = СН2). Молекулярная масса (масса одного моль) – 28 г/моль.
Углеводородный радикал, образованный от этилена называется винил (-CH = CH2). Атомы углерода в молекуле этилена находятся в sp2-гибридизации.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование
(электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
CH2 = CH2 + Br2 = Br-CH2-CH2Br.
Галогенирование этилена возможно также при нагревании (300![]() С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
CH2 = CH2 + Cl2 → CH2 = CH-Cl + HCl.
Гидрогалогенирование
— взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
CH2 = CH2 + HCl → CH3-CH2-Cl.
Гидратация
— взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
CH2 = CH2 + H2О → CH3-CH2-ОН.
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
CH2 = CH2 + HClO → CH2(OH)-CH2-Cl (1);
CH2 = CH2 + (CH3COO)2Hg + H2O → CH2(OH)-CH2-Hg-OCOCH3 + CH3COOH (2);
CH2 = CH2 + (CH3COO)2Hg + R-OH → R-CH2(OCH3)-CH2-Hg-OCOCH3 + CH3COOH (3);
CH2 = CH2 + BH3 → CH3-CH2-BH2 (4).
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
2ON-CH = CH2 + HCN →2ON-CH2-CH2-CN.
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH.
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:

Окисление
этилена кислородом при 200![]() С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O.
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3.
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот
(катионный механизм) или радикалов (радикальный механизм):
n CH2 = CH2 = -(-CH2-CH2-)n-.
Физические свойства этилена
Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо растворим в диэтиловом эфире. При смешении с воздухом образует взрывоопасную смесь
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-Br + KOH → CH2 = CH2 + KBr + H2O;
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
Сl-CH2-CH2-Cl + Zn → ZnCl2 + CH2 = CH2;
— дегидратация этилена при его нагревании с серной кислотой (t >150![]() C) или пропускании его паров над катализатором
C) или пропускании его паров над катализатором
CH3-CH2-OH → CH2 = CH2 + H2O;
— дегидрирование этана при нагревании (500![]() С) в присутствии катализатора (Ni, Pt, Pd)
С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH3 → CH2 = CH2 + H2↑.
Применение этилена
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров
(полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Примеры решения задач
Источник
Часть III. ОРГАНИЧЕСКАЯ ХИМИЯ
Раздел 16.
УГЛЕВОДОРОДЫ
§
16.6. Этилен и его гомологи
Свойства. Этилен — первый член
гомологического ряда — бесцветный газ с очень слабым сладковатым запахом, немного
легче воздуха, малорастворим в воде.
За
химическим свойствам этилен резко отличается от метана, что обусловлено
электронному строению его молекулы. Имея в молекуле двойную связь,
состоит из σ – и-связи,
этилен способен присоединять два одновалентных атома или радикалы за счет
разрыва -связи.
Способность к реакциям присоединения
характерная для всех алкенов. Рассмотрим типичные из них.
1. Присоединение водорода. Эта реакция
происходит при наличии катализатора — тонкоизмельченного никеля, платины или
палладия — при комнатной температуре:
Pt
CH2=CH2 + H2 −> СН3—СН3.
Присоединение водорода к веществу называется
реакцией гидрирования или гидрогенизации.
При гидрогенизации олефины
превращаются в насыщенные углеводороды.
2. Присоединение галогенов.
Реакция происходит при обычных условиях. Например:
СН2=СН2 + Сl2 -> lСН2—СНСl.
Дихлорэтан
Дихлорэтан
— жидкость, хорошо растворяет органические вещества.
СН2=СН2 + r2 −> r- СН2—СН2Вr.
Диброметан
Реакция присоединения брома является качественной
реакцией на непредельные углеводороды. Наличие последних свидетельствует обесцвечивание
красно-бурой бромной воды.
3. Присоединение галогеноводородов:
СН2=СН2 + Н —
Сl −>СН3—СН2Сl.
Легко прийти к выводу, что
галогенпроизводные углеводородов, например хлористый этил СН3—СН2Сl, можно добыть двумя способами: или
присоединением к этилену хлороводорода, либо замещением водорода в этане на хлор.
Присоединение галогеноводородов к
гомологов этилена происходит по правилу В. В. Марковникова: атом водорода
присоединяется к наиболее гидрогенизированного атома углерода, а атом галогена — к
наименее гидрогенизированного. Например:

4.
Присоединение воды (реакция гидратации). Реакция происходит при наличии
катализатора — серной кислоты:
H2SO4
CH2=CH2+ Н2O -> CH3—СН2ОН.
Это суммарное уравнение реакции.
Фактически реакция проходит в две стадии. Сначала происходит присоединение серной
кислоты к этилену в месте разрыва двойной связи с образованием етилсірчаної
кислоты:
СН2=СН2 + H-O-SO2-OH
-> CH3-CH2-O-SO2-OH.
Далее етилсірчана кислота,
взаимодействуя с водой, образует спирт и кислоту:
СН3—СН2—O—SO2—ОН + Н—ОН −> СН3—СН2ОН
+ HO—SO2—ОН.
Сейчас реакцию присоединения воды к
этилена при наличии твердых катализаторов применяют для промышленного
извлечения этилового спирта из непредельных углеводородов, содержащихся в газах
крекинга нефти (попутных газах), а также в коксовых газах.
Важным химическим свойством
этилена и его гомологов является способность легко окиснюватися уже при обычной
температуры. При этом окисление подлежат оба атома углерода, соединенные
двойной связью. Если этилен пропускать через водный раствор перманганата
калия КМnО4,
то характерная фиолетовая окраска последнего исчезает, происходит окисление
этилена перманганатом калия:
ЗСН2=СН2 + 2КМnO4 + 4Н2O -> ЗНОН2С—СН2ОН
+ 2МnO2 + 2КOН.
Этиленгликоль
Эту реакцию используют для
установка ненасыщенности органического вещества — наличия в ней двойных или
тройных связей.
Этилен горит светящимся пламенем с
образованием оксида углерода(IV)
и воды:
С2Н4 + 3O2 −> 2O2 + 2Н2О.
Для этилена, как и для всех ненасыщенных
углеводородов, характерны реакции полимеризации (см. § 16.7).
Добывания.
В лабораторных условиях этилен получают при нагревании этилового спирта с
водовідбираючими вещес нами (концентрированной серной кислотой, оксидом фосфора (V):
H2SO4, нагрев
С2Н5ОН
» СН2=СН2 + Н2O.
Это — процесс, обратный добыче
спирта из этилена (см. выше). Его можно представить так. Сначала спирт взаимодействует
с серной кислотой, образуя етилсірчану кислоту и воду:
![]()
Далее етилсірчана кислота при
температуре 180-200 °С разлагается на серную кислоту и этилен:
![]()
Олефины получают также при
нагревании галогенпроизводных с концентрированным спиртовым раствором щелочи:

В промышленных условиях этилен и его
гомологи выделяют из газов крекинга нефти. Очень важен способ их добывания —
дегидрирование соответствующих насыщенных углеводородов над никелевым катализатором:
Ni
СН3—СН3−>
СН2=СН2 + Н2;
Ni
СН3—СН2—СН3
−> СН2=СН-СН3 + Н2.
Применение. Этилен применяют
для получения этилового спирта, полиэтилена. Он ускоряет созревание плодов
(помидоров, цитрусовых и др) при введении небольших количеств его в воздух
теплиц. Этилен и его гомологи используются как химическое сырье для синтеза
многих органических веществ.
Источник
История открытия этилена
Этилен впервые был получен немецким химиком Иоганном Бехером в 1680 году при действии купоросного масла (H2SO4) на винный (этиловый) спирт (C2H5OH).
CH3-CH2-OH+H2SO4→CH2=CH2+H2O
Вначале его отождествляли с «горючим воздухом», т. е. с водородом. Позднее, в 1795 году этилен подобным же образом получили голландские химики Дейман, Потс-ван-Трусвик, Бонд и Лауеренбург и описали под названием «маслородного газа», так как обнаружили способность этилена присоединять хлор с образованием маслянистой жидкости – хлористого этилена («масло голландских химиков»), (Прохоров,1978).
Изучение свойств этилена, его производных и гомологов началось с середины XIX века. Начало практического использования этих соединений положили классические исследования А.М. Бутлерова и его учеников в области непредельных соединений и особенно создания Бутлеровым теории химического строения. В 1860 году он получил этилен действием меди на йодистый метилен, установив структуру этилена.
В 1901 году Дмитрий Николаевич Нелюбов выращивал горох в лаборатории, В Санкт-Петербурге, но семена давали искривленные, укороченные проростки, у которых верхушка была согнута крючком и не сгибалась. В теплице и на свежем воздухе проростки были ровные, рослые, и верхушка на свету быстро распрямляла крючок. Нелюбов предложил, что фактор, вызывающий физиологический эффект, находится в воздухе лаборатории.
В то время помещения освещали газом. В уличных фонарях горел тот же газ, и давно было замечено, что при аварии в газопроводе стоящие рядом с местом утечки газа деревья преждевременно желтеют и сбрасывают листья.
Осветительный газ содержал разнообразные органические вещества. Чтобы удалить примесь газа, Нелюбов пропускал его через разогретую трубку с оксидом меди. В «очищенном» воздухе проростки гороха развивались нормально. Для того чтобы выяснить, какое именно вещество вызывает ответ проростков, Нелюбов добавлял различные компоненты светильного газа по очереди, и обнаружил, что добавка этилена вызывает:
1) замедление роста в длину и утолщение проростка,
2) «не разгибающуюся» апикальную петельку,
3) Изменение ориентации проростка в пространстве.
Эта физиологическая реакция проростков была названа тройным ответом на этилен. Горох оказался настолько чувствительным к этилену, что его стали использовать в биотестах для определения низких концентрациях этого газа. Вскоре было обнаружено, что этилен вызывает и другие эффекты: листопад, созревание плодов и т.д. Оказалось, что этилен способны синтезировать сами растения, т.е. этилен является фитогормоном (Петушкова,1986).
Физические свойства этилена
Этиле́н — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином).
Этилен – бесцветный газ со слабым сладким запахом плотностью 1,178 кг/м³ (легче воздуха), его вдыхание оказывает наркотическое действие на человека. Этилен растворяется в эфире и ацетоне, значительно меньше — в воде и спирте. При смешении с воздухом образует взрывоопасную смесь
Затвердевает при –169,5°C, плавится при таких же температурных условиях. Кипит этен при –103,8°C. Воспламеняется при нагревании до 540°C. Газ хорошо горит, пламя светящееся, со слабой копотью. Округленная молярная масса вещества — 28 г/моль. Третий и четвертый представители гомологического ряда этена — тоже газообразные вещества. Физические свойства пятого и следующих алкенов отличаются, они являются жидкостями и твердыми телами.
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-Br + KOH → CH2 = CH2 + KBr + H2O;
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
Сl-CH2-CH2-Cl + Zn → ZnCl2 + CH2 = CH2;
— дегидратация этилена при его нагревании с серной кислотой (t >150˚ C) или пропускании его паров над катализатором
CH3-CH2-OH → CH2 = CH2 + H2O;
— дегидрирование этана при нагревании (500С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH3 → CH2 = CH2 + H2↑.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
1. Галогенирование(электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
CH2 = CH2 + Br2 = Br-CH2-CH2Br.
Галогенирование этилена возможно также при нагревании (300С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
CH2 = CH2 + Cl2 → CH2 = CH-Cl + HCl.
2. Гидрогалогенирование — взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
CH2 = CH2 + HCl → CH3-CH2-Cl.
3. Гидратация — взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
CH2 = CH2 + H2О → CH3-CH2-ОН.
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты(1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
CH2 = CH2 + HClO → CH2(OH)-CH2-Cl (1);
CH2 = CH2 + (CH3COO)2Hg + H2O → CH2(OH)-CH2-Hg-OCOCH3 + CH3COOH (2);
CH2 = CH2 + (CH3COO)2Hg + R-OH → R-CH2(OCH3)-CH2-Hg-OCOCH3 + CH3COOH (3);
CH2 = CH2 + BH3 → CH3-CH2-BH2 (4).
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
2ON-CH = CH2 + HCN →2ON-CH2-CH2-CN.
4. окисление. Этилен легко окисляется. Если этилен пропускать через раствор перманганата калия, то он обесцветится. Эта реакция используется для отличия предельных и непредельных соединений. В результате образуется этиленгликоль
3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH.
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
Окисление этилена кислородом при 200С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O.
5. гидрирование. При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3.
6. Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
n CH2 = CH2 = -(-CH2-CH2-)n-.
7. Горение:
C2H4 + 3O2 → 2CO2 + 2H2O
8. Димеризация. Димеризация — процесс образования нового вещества путём соединения двух структурных элементов (молекул, в том числе белков, или частиц) в комплекс (димер), стабилизируемый слабыми и/или ковалентными связями.
2CH2=CH2→CH2=CH-CH2-CH3
Применение
Этилен используют в двух основных категориях: в качестве мономера, из которого построены большие углеродные цепи, и в качестве исходного материала для других двух-углеродных соединений. Полимеризации – это повторяющиеся объединения множества мелких молекул этилена в более крупные. Этот процесс происходит при высоких давлениях и температурах. Области применения этилена многочисленны. Полиэтилен – это полимер, который используется особенно массово в производстве упаковочных пленок, проволочных покрытий и пластиковых бутылок. Еще одно применение этилена в качестве мономера касается формирования линейных α-олефинов. Этилен является исходным материалом для приготовления ряда двух-углеродных соединений, таких как этанол (технический спирт), окись этилена (антифриз, полиэфирные волокна и пленки), ацетальдегида и винил хлорида. Кроме этих соединений, этилен с бензолом образует этилбензол, который используется в производстве пластмасс и синтетического каучука. Рассматриваемое вещество является одним из простейших углеводородов. Однако свойства этилена делают его биологически и хозяйственно значимым.
Свойства этилена дают хорошую коммерческую основу для большого количества органических (содержащих углерод и водород) материалов. Одиночные молекулы этилена могут быть соединены вместе для получения полиэтилена (что означает много молекул этилена). Полиэтилен используется для изготовления пластмасс. Кроме того, он может быть использован для изготовления моющих средств и синтетических смазочных материалов, которые представляют собой химические вещества, используемые для уменьшения трения. Применение этилена для получения стиролов актуально в процессе создания резины и защитной упаковки. Кроме того, он используется в обувной промышленности, особенно это касается спортивной обуви, а также при производстве автомобильных покрышек. Применение этилена является коммерчески важным, а сам газ является одним из наиболее часто производимых углеводородов в глобальном масштабе.
Этилен используется в производстве стекла специального назначения для автомобильной промышленности .
Дата добавления: 2017-04-14; просмотров: 10757 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org – Контакты – Последнее добавление
Источник
