Какими химическими свойствами обладает железо

Одним из наиболее распространенных металлов в земной коре после алюминия считается железо. Физические и химические свойства его таковы, что оно обладает отличной электропроводностью, теплопроводностью и ковкостью, имеет серебристо-белый цвет и высокую химическую реакционную способность быстро коррозировать при высокой влажности воздуха или больших температурах. Находясь в мелкодисперсном состоянии, оно в чистом кислороде горит и самовоспламеняется на воздухе.
Начало истории железа
В третьем тысячелетии до н. э. люди стали добывать и научились обрабатывать бронзу и медь. Широкого применения из-за дороговизны они не получили. Продолжались поиски нового металла. История железа началась в первом веке до н. э. В природе его можно встретить только в виде соединений с кислородом. Для получения чистого металла необходимо отделить последний элемент. Расплавить железо долго не удавалось, так как его надо было нагреть до 1539 градусов. И только с появлением сыродутных печей в первом тысячелетии до новой эры стали получать этот металл. На первых порах он был хрупким, содержал много шлаков.

С появлением горнов качество железа значительно улучшилось. Дальнейшую обработку оно проходило в кузнеце, где ударами молота отделялся шлак. Ковка стала одним из главных видов обработки металла, а кузнечное дело незаменимой отраслью производства. Железо в чистом виде – это очень мягкий металл. В основном его используют в сплаве с углеродом. Эта добавка усиливает такое физическое свойство железа, как твердость. Дешевый материал вскоре широко проник во все сферы деятельности человека и сделал переворот в развитии общества. Ведь еще в древние времена железные изделия покрывались толстым слоем золота. Оно имело высокую цену по сравнению с благородным металлом.
Железо в природе
Одного алюминия в литосфере содержится больше, чем железа. В природе его можно встретить только в виде соединений. Трехвалентное железо, вступая в реакцию, окрашивает почву в бурый цвет и придает песку желтоватый оттенок. Оксиды и сульфиды железа разбросаны в земной коре, иногда наблюдаются скопления минералов, из которых впоследствии и добывают металл. Содержание двухвалентного железа в некоторых минеральных источниках придает воде особый привкус.

Ржавая вода, текущая из старых водопроводных труб, окрашивается за счет трехвалентного металла. Его атомы находятся и в организме человека. Они содержатся в гемоглобине (железосодержащем белке) крови, который снабжает организм кислородом и выводит углекислый газ. В составе некоторых метеоритов содержится чистое железо, иногда встречаются целые слитки.
Какими физическими свойствами железо обладает?
Это пластичный серебристо-белого цвета металл с сероватым оттенком, имеющий металлический блеск. Он является хорошим проводником электрического тока и теплоты. Благодаря пластичности он прекрасно поддается ковке и прокатке. Железо не растворяется в воде, но разжижается в ртути, плавится при температуре 1539 и кипит при 2862 градусов по Цельсию, имеет плотность 7,9 г/см³. Особенностью физических свойств железа является то, что металл притягивается магнитом и после аннулирования внешнего магнитного поля хранит намагниченность. Используя эти свойства его можно применять для изготовления магнитов.
Химические свойства
Железо обладает следующими свойствами:
- на воздухе и в воде легко окисляется, покрываясь ржавчиной;
- в кислороде накаленная проволока горит (при этом образуется окалина в виде оксида железа);
- при температуре 700–900 градусов по Цельсию вступает в реакцию с парами воды;
- при нагревании реагирует с неметаллами (хлором, серой, бромом);
- вступает в реакции с разбавленными кислотами, в результате получаются соли железа и водород;
- не растворяется в щелочах;
- способно вытеснить металлы из растворов их солей (железный гвоздь, в растворе медного купороса, покрывается красным налетом, – это выделяется медь);
- в концентрированных щелочах при кипячении проявляется амфотерность железа.
Особенность свойств
Одним из физических свойств железа является ферромагнитность. На практике с магнитными свойствами этого материала приходится встречаться часто. Это – единственный металл, который обладает такой редкостной чертой.

Под действием магнитного поля происходит намагничивание железа. Сформировавшиеся магнитные свойства металл еще долго сохраняет и сам остается магнитом. Такое исключительное явление объясняется тем, что структура железа содержит большое количество свободных электронов, способных передвигаться.
Запасы и добыча
Одним из самых распространенных элементов на земле является железо. По содержанию в земной коре занимает четвертое место. Известно множество руд, которые содержат его, например, магнитный и бурый железняк. Металл в промышленности получают в основном из руд гематита и магнетита при помощи доменного процесса. Вначале происходит его восстановление углеродом в печи при высокой температуре 2000 градусов по Цельсию.

Для этого сверху в доменную печь подают железную руду, кокс и флюс, а снизу нагнетается поток горячего воздуха. Также применяют и прямой процесс получения железа. Измельченную руду перемешивают со специальной глиной, получая окатыши. Далее их обжигают и с помощью водорода обрабатывают в шахтной печи, где оно легко восстанавливается. Получают твердое железо, а потом переплавляют его в электрических печах. Чистый металл восстанавливают из оксидов при помощи электролиза водных растворов солей.
Преимущества железа
Основные физические свойства вещества железа дают ему и сплавам следующие преимущества перед другими металлами:
- Обладают твердостью и прочностью, сохраняя упругость. У разных сплавов эти качества неодинаковы и зависят от легирующих добавок, способов производства и термообработки.
- Большое разнообразие чугуна и сталей позволяют использовать их для любых нужд в народном хозяйстве.
- Высокие магнитные свойства металла незаменимы для изготовления магнитопроводов.

- Выполнимость легкой механической обработки, благодаря физическим свойствам железа, дает возможность из его сплавов получать листы, прутки, балки, трубы, фасонные профили.
- Значительная ковкость материала позволяет использовать его для декоративных изделий.
- Низкая стоимость сплавов.
Недостатки
Кроме большого числа положительных качеств, есть и ряд отрицательных свойств металла:
- Изделия подвержены коррозии. Для устранения этого нежелательного эффекта с помощью легирования получают нержавеющие стали, а в остальных случаях делают специальную антикоррозийную обработку конструкций и деталей.
- Железо накапливает статическое электричество, поэтому изделия, содержащие его, подвергаются электрохимической коррозии и также требуют дополнительной обработки.
- Удельный вес металла составляет 7,13 г/см³. Это физическое свойство железа придает конструкциям и деталям повышенный вес.
Состав и структура
У железа по кристаллическому признаку есть четыре модификации, которые отличаются структурой и параметрами решетки. Для выплавки сплавов именно наличие фазовых переходов и легирующих добавок имеет существенное значение. Различают следующие состояния:
- Альфа-фаза. Она сохраняется до 769 градусов по Цельсию. В этом состоянии железо сохраняет свойства ферромагнетика и обладает объемно-центрированной решеткой кубического типа.
- Бета-фаза. Существует при температуре от 769 до 917 градусов по Цельсию. Имеет немного другие параметры решетки, чем в первом случае. Все физические свойства железа остаются прежними за исключением магнитных, их оно утрачивает.
- Гамма-фаза. Строение решетки становится гранецентрированным. Такая фаза проявляется в диапазоне 917–1394 градусов Цельсия.
- Омега-фаза. Такое состояние металла появляется при температуре выше 1394 градусов Цельсия. От прежней отличается только параметрами решетки.

Железо – самый востребованный металл в мире. Больше 90 процентов всего металлургического производства приходится именно на него.
Применение
Люди начали использовать сначала метеоритное железо, которое ценили выше золота. С тех пор область применения этого металла только расширялась. Ниже представлено применение железа, на основе его физических свойств:
- ферромагнитные оксиды используют для производства магнитных материалов: промышленных установок, холодильников, сувениров;
- оксиды железа применяют как минеральные краски;
- хлорид железа незаменим в радиолюбительской практике;
- сульфаты железа используют в текстильной промышленности;
- магнитная окись железа – один из важных материалов для производства устройств долговременной компьютерной памяти;
- ультрадисперсный порошок железа находит применение в черно-белых лазерных принтерах;
- прочность металла позволяет изготовлять оружие и броню;
- износостойкий чугун можно использовать для производства тормозов, дисков сцепления, а также деталей для насосов;
- жаростойкий – для доменных, термических, мартеновских печей;
- жаропрочный – для компрессорного оборудования, дизельных двигателей;
- высококачественная сталь используется для газопроводов, корпуса отопительных котлов, сушилок, стиральных и посудомоечных машин.
Заключение
Под железом часто подразумевают не сам метал, а его сплав – низкоуглеродистую электротехническую сталь. Получение чистого железа довольно сложный процесс, и поэтому его используют только для производства магнитных материалов. Как уже отмечалось, что исключительное физическое свойство простого вещества железа – это ферромагнетизм, т. е. способность намагничиваться в присутствии магнитного поля.

Магнитные свойства чистого металла до 200 раз превышают такие же показатели технической стали. На это свойство влияет и зернистость металла. Чем крупнее зерно, тем выше магнитные свойства. В некоторой степени оказывает влияние и механическая обработка. Такое чистое железо, удовлетворяющее этим требованиям, используют для получения магнитных материалов.
Источник
Железо – химический элемент четвертого периода и побочной подгруппы VIII группы периодической системы. Атом железа содержит восемь валентных электронов, однако в соединениях железо обычно проявляет степени окисления (+2) и (+3), редко – (+6). Имеются сообщения о получении соединений восьмивалентного железа.
Степень окисления +3 для железа является наиболее устойчивой. Соединения железа(III) могут быть восстановлены только под действием сильных восстановителей, таких как водород в момент выделения, сероводород. Эти реакции проводят в кислой среде:
$Fe_2(SO_4)_3 + H_2S = 2FeSO_4 + S + H_2SO_4$
Железо широко распространено в природе – это самый распространенный металл, после алюминия. Существует гипотеза о том, что внутреннее ядро Земли – целиком состоит из железа с примесью никеля и серы, а возможно и других элементов.
В природе железо встречается в виде руд – оксидов Fe$_2$O$_3$ (гематит, красный железняк) и Fe$_3$O$_4$ (магнетит, магнитный железняк), гидратированного оксида Fe$_2$O$_3 cdot$H$_2$O (лимонит, бурый железняк), карбоната FeCO$_3$ (сидерит), дисульфида FeS2 (пирит), редко встречается в виде самородков, попадающих на землю с метеоритами. Такое метеоритное железо было известно людям издревле. Освоение получения железа из железной руды послужило началом железного века.
Получение железа
В настоящее время железную руду восстанавливают коксом в доменных печах, при этом расплавленное железо частично реагирует с углеродом, образуя карбид железа Fe3C (цементит), а частично растворяет его. При затвердевании расплава образуется чугун. Чугун, используемый для получения стали, называют передельным.
Запомнить! Сталь, в отличие от чугуна, содержит меньшее количество углерода.
При получении стали, лишний углерод, содержащийся в чугуне, необходимо выжечь. Этого добиваются, пропуская над расплавленным чугуном воздух, обогащенный кислородом. Существует и прямой метод получения железа, основанный на восстановлении окатышей магнитного железняка природным газом:
Fe$_3$O$_4$ + CH$_4$ = 3Fe + CO$_2$ + 2H$_2$O
Физические свойства
Железо – серебристо-белый, ковкий и пластичный тугоплавкий (т. пл. 1535°C, т. кип. 2870°C) металл, при температурах ниже 769°C притягивается магнитом, то есть обладает ферромагнетизмом. Ферромагнитные свойства вызваны наличием в структуре металла отдельных зон – доменов, магнитные моменты которых под действием внешнего магнитного поля ориентируются в одну и ту же сторону. Железо существует в форме нескольких полиморфных (аллотропных) модификаций. При температурах ниже $910^0C$ устойчиво железо с объемно-центрированной кристаллической решеткой ($alpha$-Fe, немагнитное α-железо существующее при $769 – 910^0C$ называют β-Fe), в интервале температур $910 – 1400^0C$ – более плотная модификация с кубической гранецентрированной ($gamma$-Fe), а выше этой температуры и вплоть до температуры плавления вновь становится устойчивой структура с объемно-центрированной ячейкой (δ-Fe).
Химические свойства железа
Запомнить!
Степень окисления +2 железо проявляет при взаимодействии со слабыми окислителями: серой, йодом, соляной кислотой, растворами солей.
Степень окисления +3 железо проявляет при взаимодействии с сильными окислителями: хлором, бромом.
Смешанную степень окисления железо проявляет при взаимодействии с кислородом, водяным паром.
1) с кислотами. На влажном воздухе окисляется, покрываясь коричневой коркой гидратированного оксида Fe$_2$O$_3 cdot $H$_2$O, ржавчины. Железо легко растворяется в разбавленных кислотах:
Fe + 2HCl = FeCl$_2$ + H$_2$
но пассивируется в холодных концентрированных растворах кислот-окислителях – серной и азотной.
2) с солями.Будучи металлом средней химической активности, железо вытесняет другие, менее активные металлы из растворов их солей:
Fe + CuSO$_4$ = FeSO$_4$ + Cu
При этом, как и при растворении в кислотах, образуются соли двухвалентного железа.
3) с парами воды.При температуре белого каления железо реагирует с водой. Пропуская перегретый водяной пар через раскаленный на жаровне чугунный пушечный ствол, Лавуазье получил водород:
3Fe + 4H$_2$O = Fe$_3$O$_4$ + 4H$_2$.
4) с кислородом.В кислороде железо сгорает с образованием черyого порошка железной окалины – оксида железа(II, III) Fe$_3$O$_4$,имеющей тот же состав, что и природный минерал магнитный железняк^
3Fe + 2O$_2$ = Fe$_3$O$_4$
Искры, вырывающиеся при заточке стальных ножей или при резке стальных листов ацетилено-кислородным пламенем , также представляют собой раскаленные куски железной окалины.
5) с неметаллами. Степень окисления железа в образующихся соединениях зависит от силы окислителя – неметалла. Так, при взаимодействии с хлором образуется хлорид FeCl$_3$:
2Fe + 3Cl$_2$ = 2FeCl$_3$,
с серой – сульфид FeS:
Fe + S = FeS.
Соединения железа(II)
Запомнить! Оксид и гидроксид железа(II) обладают основными свойствами.
Соединения железа(II) являются сильными восстановителями и на воздухе легко окисляются до соединений трехвалентного железа:
4FeSO$_4$ + O$_2$ + 2H$_2$O = 4Fe(OH)SO$_4$.
Белый осадок гидроксида железа(II) Fe(OH)2, образующийся при действии на соли железа(II) растворов щелочей, на воздухе мгновенно зеленеет, образуя «зеленую ржавчину» – смешанный гидроксид железа(II) и железа(III), который лишь через некоторое время приобретает характерный для Fe$_2$O$_3 cdot$H$_2$O ржавый цвет.
Соединения железа(III)
Гидроксид железа(III) выпадает в виде коричневого осадка при действии растворов щелочей, сульфидов, карбонатов на соли железа(III):
2FeCl$_3$ + 3Na$_2$CO$_3$ + 6H$_2$O = 2Fe(OH)$_3^-$ +3CO$_2$+ 6NaCl
Запомнить! Оксид и гидроксид железа(III) являются слабо амфотерными, с преобладанием основных свойств.
Так, при растворении гидроксида железа(III) в кислотах образуются соли железа(III), а при сплавлении оксида с оксидами активных металлов – ферриты (ферраты(+3)):
2Fe(OH)$_3$ + 2H$_2$SO$_4$ = Fe$_2$(SO$_4$)$_3$ + 3H$_2$O,
Fe$_2$O$_3$ + CaO = CaFe$_2$O$_4$.
В концентрированных щелочах Fe(OH)$_3$ медленно растворяется, образуя гидроксоферраты, например, Na$_3$[Fe(OH)$_6$]:
$Fe(OH)_3 + 3NaOH_{textrm{водн.}} =Na_3[Fe(OH)_6]$
При действии недостатка кислот они разлагаются в образованием осадка гидроксида железа(III):
$Na_3[Fe(OH)_6] + 3HCl_{textrm{нед.}} =3NaCl + Fe(OH)_3downarrow +3H_2O$
$Na_3[Fe(OH)_6] + 6HCl_{textrm{изб.}} =3NaCl + FeCl_3 +6H_2O$
При пропускании углекислого газа они разлагаются на гидроксид железа(III) и карбонат натрия:
$2Na_3[Fe(OH)_6] + 3CO_2uparrow=3Na_2CO_3 + 2Fe(OH)_3downarrow +3H_2O$
Запомнить! Соли железа(III) и некоторых слабых кислот, например, сернистой и угольной не могут быть выделены из водных растворов по причине полного необратимого гидролиза
$2FeCl_3 + 3Na_2CO_3 + 3H_2O = 2Fe(OH)_3 +3CO_2uparrow + 6NaCl$
О протекании реакции судят по выделению газа и образованию коричневого осадка гидроксида железа(III).
Окисление Fe(OH)3 бромом в щелочной среде приводит к образованию вишневых растворов ферратов (+6):
2Fe(OH)$_3$ + 3Br$_2$ + 10KOH = 2K$_2$FeO$_4$ + 6KBr + 8H$_2$O.
Запомнить! Ферраты содержат железо в степени окисления (+6), и являются сильными окислителями.
Применение железа
В виде чугуна и стали железо находит широкое применение в народном хозяйстве. Хлорид железа(III) используется при травлении медных плат, а сульфат железа(III) – в качестве хлопьеобразователя (коагулянта) при очистке воды. Ферриты двухвалентных металлов (магния, цинка, кобальта, никеля) со структурой шпинели применяют в радиоэлектронике, вычислительной технике.
Соли железа(III) образуют желто-коричневые растворы, цвет которых объясняется гидролизом, приводящим к образованию коллоидного раствора гидроксида железа(III). Многие из них, например, хлорид FeCl3×6H2O («хлорное железо») сильно гигроскопичны, и при хранении в неплотно закрытых склянках, отсыревают.
Качественные реакции на катионы железа

На ионы железа существуют удобные качественные реакции. Если к раствору соли железа(III) прибавить разбавленный раствор роданида калия KCNS, то образуется интенсивно-красное окрашивание, вызванное образованием роданида железа(III):
$FeCl_3 + 3KSCN= Fe(SCN)_3 + 3KCl$
Другим реагентом на ионы железа(III) служит комплексное соединение гексацианоферрат(II) калия $K_4[Fe(CN)_6]$, часто называемый также “желтая кровяная соль”. Такое странное на первый взгляд название связано с тем, что раньше эту соль получали нагреванием крови с поташом и железными опилками. С солями железа(III) она дает синий коллоидный раствор «берлинской лазури» или “турнбуллева синь”:
$K_4[Fe(CN)_6] + FeCl_3 = KFe[Fe(CN)_6] downarrow + 3KCl$
.
Аналогичное синие окрашивание осадка того же состава можно получить при взаимодействии ионов железа(II) с раствором “красной кровяной соли” – гексацианоферрат(III) калия $K_3[Fe(CN)_6]$:
$K_3[Fe(CN)_6] + FeCl_2 = KFe[Fe(CN)_6] downarrow + 2KCl$
.
Таким образом, красная кровяная соль служит реактивом на соли двухвалентного железа. При более высоких концентрациях растворов выделяется нерастворимая в воде форма «берлинской лазури» состава $Fe_4[Fe(CN)_6]_3$. Именно это вещество долгое время использовали при крашении тканей. При работе с кровяными солями следует помнить об их токсичности.
Источник

Чистое железо (99,97%), очищенное методом электролиза
Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
СТРУКТУРА
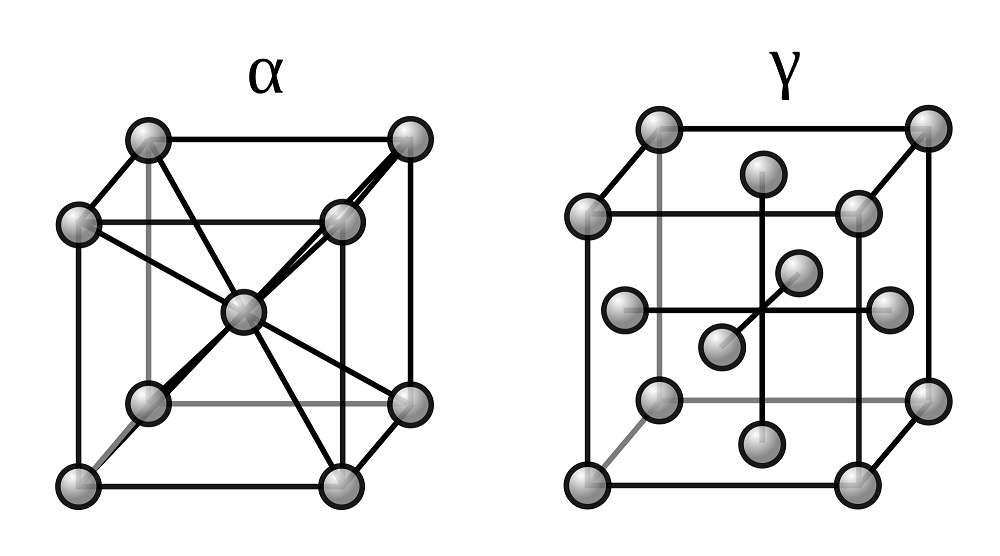
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

Железная руда
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

Железо
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10−5-1·10−8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ

Самородное железо
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
| Молекулярный вес | 55.85 г/моль |
| Происхождение названия | возможно англо-саксонского происхождения |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.57
| Strunz (8-ое издание) | 1/A.07-10 |
| Nickel-Strunz (10-ое издание) | 1.AE.05 |
| Dana (7-ое издание) | 1.1.17.1 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | железно-черный |
| Цвет черты | серый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | несовершенная по {001} |
| Твердость (шкала Мооса) | 4,5 |
| Излом | в зазубринах |
| Прочность | ковкий |
| Плотность (измеренная) | 7.3 — 7.87 г/см3 |
| Радиоактивность (GRapi) | |
| Магнетизм | ферромагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | изотропный |
| Цвет в отраженном свете | белый |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) — изометрический — гексаоктаэдральный |
| Пространственная группа | Im3m (I4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 2.8664Å |
| Двойникование | (111) также в пластинчатых массах {112} |
| Морфология | в маленьких пузырьках |
mineralpro.ru
13.07.2016
Источник
