Какими физическими свойствами обладают белки

Áåëêè – ïðèðîäíûå ïîëèïåïòèäû ñ îãðîìíîé ìîëåêóëÿðíîé ìàññîé. Îíè âõîäÿò â ñîñòàâ âñåõ æèâûõ îðãàíèçìîâ è âûïîëíÿþò ðàçëè÷íûå áèîëîãè÷åñêèå ôóíêöèè.
Ñòðîåíèå áåëêà.
Ó áåëêîâ ñóùåñòâóåò 4 óðîâíÿ ñòðîåíèÿ:
- ïåðâè÷íàÿ ñòðóêòóðà áåëêà – ëèíåéíàÿ ïîñëåäîâàòåëüíîñòü àìèíîêèñëîò â ïîëèïåïòèäíîé öåïè, ñâåðíóòûõ â ïðîñòðàíñòâå:

- âòîðè÷íàÿ ñòðóêòóðà áåëêà – êîíôîðìàöèÿ ïîëèïåïòèäíîé öåïè, ò.ê. ñêðó÷èâàíèå â ïðîñòðàíñòâå çà ñ÷åò âîäîðîäíûõ ñâÿçåé ìåæäó NH è ÑÎ ãðóïïàìè. Åñòü 2 ñïîñîáà óêëàäêè: α-ñïèðàëü è β– ñòðóêòóðà.
α-ñïèðàëü Íà îäíîì âèòêå óêëàäûâàþòñÿ 4 àìèíîêèñëîòíûõ îñòàòêà, êîòîðûå íàõîäÿòñÿ ñíàðóæè ñïèðàëè. |
β-ñòðóêòóðà. Ïîëèïåïòèäíàÿ öåïü ðàñòÿíóòà, åå ó÷àñòêè ðàñïîëàãàþòñÿ ïàðàëëåëüíû äðóã äðóãó è óäåðæèâàþòñÿ âîäîðîäíûìè ñâÿçÿìè. |
- òðåòè÷íàÿ ñòðóêòóðà áåëêà – ýòî òðåõìåðíîå ïðåäñòàâëåíèå çàêðó÷åííîé α-ñïèðàëü èëè β-ñòðóêòóðû â ïðîñòðàíñòâå:

Ýòà ñòðóêòóðà îáðàçóåòñÿ çà ñ÷åò äèñóëüôèäíûõ ìîñòèêîâ –S-S- ìåæäó öèñòåèíîâûìè îñòàòêàìè.  îáðàçîâàíèè òàêîé ñòðóêòóðû ó÷àñòâóþò ïðîòèâîïîëîæíî çàðÿæåííûå èîíû.
- ÷åòâåðòè÷íàÿ ñòðóêòóðà áåëêà îáðàçóåòñÿ çà ñ÷åò âçàèìîäåéñòâèÿ ìåæäó ðàçíûìè ïîëèïåïòèäíûìè öåïÿìè:

Ñèíòåç áåëêà.
 îñíîâå ñèíòåçà ëåæèò òâåðäîôàçíûé ìåòîä, â êîòîðîì ïåðâàÿ àìèíîêèñëîòà çàêðåïëÿåòñÿ íà ïîëèìåðíîì íîñèòåëå, à ê íåé ïîñëåäîâàòåëüíî ïîäøèâàþòñÿ íîâûå àìèíîêèñëîòû. Ïîñëå ïîëèìåð îòäåëÿþò îò ïîëèïåïòèäíîé öåïè.
Ôèçè÷åñêèå ñâîéñòâà áåëêà.
Ôèçè÷åñêèå ñâîéñòâà áåëêà îïðåäåëÿþòñÿ ñòðîåíèåì, ïîýòîìó áåëêè äåëÿò íà ãëîáóëÿðíûå (ðàñòâîðèìûå â âîäå) è ôèáðèëëÿðíûå (íåðàñòâîðèìûå â âîäå).
Õèìè÷åñêèå ñâîéñòâà áåëêîâ.
1. Äåíàòóðàöèÿ áåëêà (ðàçðóøåíèå âòîðè÷íîé è òðåòè÷íîé ñòðóêòóðû ñ ñîõðàíåíèåì ïåðâè÷íîé). Ïðèìåð äåíàòóðàöèè – ñâåðòûâàíèå ÿè÷íûõ áåëêîâ ïðè âàðêå ÿèö.
2. Ãèäðîëèç áåëêîâ – íåîáðàòèìîå ðàçðóøåíèå ïåðâè÷íîé ñòðóêòóðû â êèñëîì èëè ùåëî÷íîì ðàñòâîðå ñ îáðàçîâàíèåì àìèíîêèñëîò. Òàê ìîæíî óñòàíîâèòü êîëè÷åñòâåííûé ñîñòàâ áåëêîâ.
3. Êà÷åñòâåííûå ðåàêöèè:
Áèóðåòîâàÿ ðåàêöèÿ – âçàèìîäåéñòâèå ïåïòèäíîé ñâÿçè è ñîëåé ìåäè (II) â ùåëî÷íîì ðàñòâîðå. Ïî îêîí÷àíèþ ðåàêöèè ðàñòâîð îêðàøèâàåòñÿ â ôèîëåòîâûé öâåò.
Êñàíòîïðîòåèíîâàÿ ðåàêöèÿ – ïðè ðåàêöèè ñ àçîòíîé êèñëîòîé íàáëþäàåòñÿ æåëòîå îêðàøèâàíèå.
Áèîëîãè÷åñêîå çíà÷åíèå áåëêà.
1. Áåëêè – ñòðîèòåëüíûé ìàòåðèàë, èç íåãî ïîñòðîåíû ìûøöû, êîñòè, òêàíè.
2. Áåëêè – ðåöåïòîðû. Ïåðåäàþò è âîñïðèíèìàþò ñèãíàë, ïîñòóïàþùèõ îò ñîñåäíèõ êëåòîê èç îêðóæàþùåé ñðåäû.
3. Áåëêè èãðàþò âàæíóþ ðîëü â èììóííîé ñèñòåìå îðãàíèçìà.
4. Áåëêè âûïîëíÿþò òðàíñïîðòíûå ôóíêöèè è ïåðåíîñÿò ìîëåêóëû èëè èîíû â ìåñòî ñèíòåçà èëè íàêîïëåíèÿ. (Ãåìîãëîáèí ïåðåíîñèò êèñëîðîä ê òêàíÿì.)
5. Áåëêè – êàòàëèçàòîðû – ôåðìåíòû. Ýòî î÷åíü ìîùíûå ñåëåêòèâíûå êàòàëèçàòîðû, êîòîðûå óñêîðÿþò ðåàêöèè â ìèëëèîíû ðàç.
Åñòü ðÿä àìèíîêèñëîò, êîòîðûå íå ìîãóò ñèíòåçèðîâàòüñÿ â îðãàíèçìå – íåçàìåíèìûå, èõ ïîëó÷àþò òîëüêî ñ ïèùåé: òèçèí, ôåíèëàëàíèí, ìåòèíèí, âàëèí, ëåéöèí, òðèïòîôàí, èçîëåéöèí, òðåîíèí.
Источник
Прежде чем рассказать о важнейших физических и химических свойствах белка, нужно знать из чего он состоит, какая у него структура. Белки – это важный природный биополимер, фундаментом для него служат аминокислоты.

Что такое аминокислоты
Это органические соединения, в состав которых входят карбоксильная и аминная группы. Благодаря первой группе у них есть углерод, кислород и водород, а другой – азот и водород. Самыми важными считаются альфа-аминокислоты, потому что они нужны для образования белков.
Существуют незаменимые аминокислоты, которые называются протеиногенные. Вот они и отвечают за появление белков. Их имеется всего 20, а белковых соединений они могут образовывать бесчисленное множество. При этом ни один из них не будет полностью идентичным другому. Это возможно благодаря комбинациям элементов, которые есть в этих аминокислотах.
Их синтез не происходит в организме. Поэтому туда они попадают вместе с продуктами питания. Если человек получает их в недостаточном количестве, то возможно нарушение нормального функционирования различных систем. Белки образуются благодаря реакции поликонденсации.

Белки и их структура
Прежде чем перейти к физическим свойствам белков, стоит дать более точное определение этому органическому соединению. Белки – это одни из наиболее значимых биоорганических соединений, которые образуются благодаря аминокислотам и принимают участие во многих процессах, происходящих в организме.
Структура этих соединений зависит от того, в каком порядке чередуются остатки аминокислот. В результате этого она бывает следующая:
- первичная (линейная);
- вторичная (спиралевидная);
- третичная (глобулярная).

Их классификация
Из-за огромного разнообразия белковых соединений и различной степени сложности их состава и разной структуры, для удобства существуют классификации, которые опираются на эти признаки.
По своему составу они бывают следующими:
- простые;
- сложные, которые подразделяются в свою очередь на:
- соединение белка и углеводов;
- соединение белков и жиров;
- соединение белковых молекул и нуклеиновых кислот.
По растворимости:
- водорастворимые;
- жирорастворимые.
Небольшая характеристика белковых соединений
Прежде чем перейти к физическим и химическим свойствам белков, будет полезно дать им небольшую характеристику. Конечно, их свойства имеют важное значение для нормального функционирования живого организма. По своему изначальному состоянию это твердые вещества, которые либо растворяются в различных жидкостях, либо нет.
Если говорить кратко о физических свойствах белков, то они обуславливают многие важнейшие биологические процессы в организме. Например, такие как транспортировка веществ, строительная функция и др. Физические свойства белков зависят от того, являются они растворимыми или нет. Вот как раз об этих особенностях и будет написано дальше.
Физические свойства белков
Выше уже написано об их агрегатном состоянии и растворимости. Поэтому переходим к следующим свойствам:
- У них имеется большая молекулярная масса, которая зависит от определенных условий среды.
- Их растворимость имеет большой диапазон, вследствие чего становится возможным электрофорез – метод, с помощью которого выделяются белки из смесей.
Химические свойства белковых соединений
Читатели теперь знают, какими физическими свойствами обладают белки. Теперь нужно рассказать о не менее важных, химических. Они перечислены ниже:
- Денатурация. Свертывание белка под воздействием высоких температур, сильных кислот или щелочей. При денатурации сохраняется только первичная структура, а все биологические свойства белков теряются.
- Гидролиз. В результате его образуются простые белки и аминокислоты, потому что происходит разрушение первичной структуры. Он является основой процесса пищеварения.
- Качественные реакции на определение белка. Их всего две, а третья нужна для того, чтобы обнаружить серу в данных соединениях.
- Биуретовая реакция. На белки воздействуют осадком гидроксида меди. В итоге происходит окрашивание в фиолетовый цвет.
- Ксантопротеиновая реакция. Воздействие осуществляется при помощи концентрированной азотной кислоты. В результате этой реакции получается белый осадок, который при нагревании становится желтым. А если добавить водный аммиачный раствор, то появляется оранжевый цвет.
- Определение серы в белках. Когда происходит горение белков, то начинает ощущаться запах “жженого рога”. Это явление объясняется тем, что в них содержится сера.

Итак, это были все физические и химические свойства белков. Но, конечно, не только из-за них они считаются важнейшими компонентами живого организма. Они обусловливают важнейшие биологические функции.
Биологические свойства белков
Нами были рассмотрены физические свойства белков в химии. Но стоит также обязательно рассказать о том, какое влияние они оказывают на организм и почему без них он не будет полноценно функционировать. Ниже перечислены функции белков:
- ферментативная. Большинство реакций в организме протекает с участием ферментов, которые имеют белковое происхождение;
- транспортная. Данные элементы осуществляют доставку других важных молекул в ткани и органы. Одним из самых значимых транспортных белков является гемоглобин;
- структурная. Белки являются главным строительным материалом для многих тканей (мышечной, покровной, опорной);
- защитная. Антитела и антитоксины представляют собой особый вид белковых соединений, которые составляют основу иммунитета;
- сигнальная. Рецепторы, которые отвечают за работу органов чувств, тоже имеют в своей структуре белки;
- запасающая. Данную функцию выполняют особые белки, которые могут быть строительным материалом и являться источниками дополнительной энергии во время развития новых организмов.
Белки способны превращаться в жиры и углеводы. А вот они не смогут стать белками. Поэтому недостаток именно этих соединений особенно опасен для живого организма. Выделяемая при усвоении белков энергия невелика и уступает в этом отношении жирам и углеводам. Однако именно они являются источником незаменимых аминокислот в организме.

Как понять, что в организме не хватает белка? У человека ухудшается самочувствие, наступает быстрая истощаемость и утомляемость. Прекрасными источниками белка являются различные сорта пшеницы, мясные и рыбные продукты, молочные, яйца и некоторые виды зернобобовых культур.
Важно знать не только физические свойства белков, но и химические, а также то, какое значение они имеют для организма с биологической точки зрения. Белковые соединения уникальны тем, что являются источниками незаменимых аминокислот, которые нужны для нормального функционирования человеческого организма.
Источник
Определение, состав и строение белка
Белки являются биополимерами, мономерами которых являются остатки альфа-аминокислот, соединенные между собой посредством пептидных связей. Аминокислотная последовательность каждого белка строго определена, в живых организмах она зашифрована посредством генетического кода, на основе считывания которого и происходит биосинтез белковых молекул. В построении белков участвует 20 аминокислот.
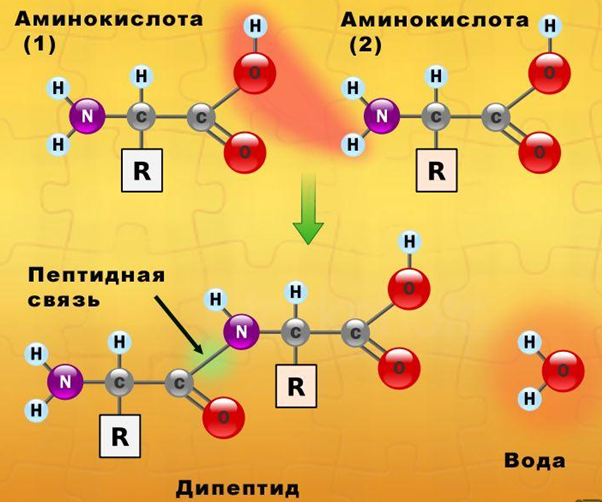
Рис. 1. Схема образования молекулы белка (дипептида).
Различают следующие виды структуры белковых молекул:
- Первичная. Представляет собой аминокислотную последовательность в линейной цепи.
- Вторичная. Это более компактная укладка полипептидных цепей при помощи формирования водородных связей между пептидными группами. Есть два варианта вторичной структуры – альфа-спираль и бета-складчатость.
- Третичная. Представляет собой укладку полипептидной цепочки в глобулу. При этом формируются водородные, дисульфидные связи, также стабилизация молекулы реализуется благодаря гидрофобным и ионным взаимодействиям аминокислотных остатков.
- Четвертичная. Белок состоит из нескольких полипептидных цепей, которые взаимодействуют между собой посредством нековалентных связей.
Таким образом, соединенные в определенной последовательности аминокислоты образуют полипептидную цепь, отдельные части которой сворачиваются в спираль или формируют складки. Такие элементы вторичной структур образуют глобулы, формируя третичную структуру белка. Отдельные глобулы взаимодействуют между собой, образуя сложные белковые комплексы с четвертичной структурой.
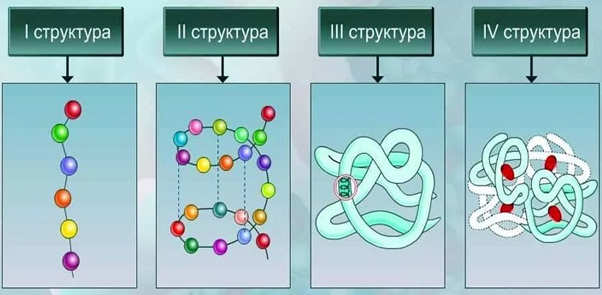
Рис. 2. Структурная организация белков.
Классификация белков
Существует несколько критериев, по которым можно классифицировать белковые соединения. По составу различают простые и сложные белки. Сложные белковые вещества содержат в своем составе неаминокислотные группы, химическая природа которых может быть различной. В зависимости от этого выделяют:
- гликопротеины;
- липопротеины;
- нуклеопротеины;
- металлопротеиды;
- фосфопротеины;
- хромопротеиды.
Также существует классификация по общему типу строения:
- фибриллярные;
- глобулярные;
- мембранные.
Протеинами называют простые (однокомпонентные) белки, состоящие лишь из остатков аминокислот. В зависимости от растворимости они делятся на следующие группы:
Подобная классификация не совсем точна, ведь согласно последним исследованиям многие простые белки связаны с минимальным количеством небелковых соединений. Так, в состав некоторых протеинов входят пигменты, углеводы, иногда липиды, что делает их больше похожими на сложные белковые молекулы.
Физико-химические свойства белка
Физико-химические свойства белков обусловлены составом и количеством входящих в их молекулы остатков аминокислот. Молекулярные массы полипептидов сильно колеблются: от нескольких тысяч до миллиона и более. Химические свойства белковых молекул разнообразны, включают в себя амфотерность, растворимость, а также способность к денатурации.
Амфотерность
Поскольку в состав белков входят и кислые, и основные аминокислоты, то всегда в составе молекулы будут свободные кислые и свободные основные группы (СОО- и NН3+ соответственно). Заряд определяется соотношением основных и кислых аминокислотных групп. По этой причине белки заряжены “+”, если уменьшается рН, и наоборот, “-”, если рН увеличивается. В случае, когда рН соответствует изоэлектрической точке, белковая молекула будет иметь нулевой заряд. Амфотерность важна для осуществления биологических функций, одной из которых является поддержание уровня рН в крови.
Растворимость
Классификация белков по свойству растворимости уже была приведена выше. Растворимость белковых веществ в воде объясняется двумя факторами:
- заряд и взаимное отталкивание белковых молекул;
- формирование гидратной оболочки вокруг белка – диполи воды взаимодействуют с заряженными группами на внешней части глобулы.
Денатурация
Физико-химическое свойство денатурации представляет собой процесс разрушения вторичной, третичной структуры белковой молекулы под влиянием ряда факторов: температуры, действии спиртов, солей тяжелых металлов, кислот и других химических агентов.
Важно! Первичная структура при денатурации не разрушается.

Рис. 3. Процесс денатурации белка.
Химические свойства белков, качественные реакции, уравнения реакций
Химические свойства белков можно рассмотреть на примере реакций их качественного обнаружения. Качественные реакции позволяют определить наличие пептидной группы в соединении:
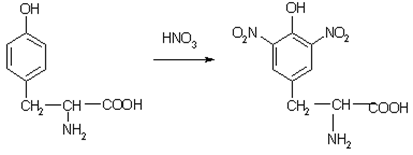
1. Ксантопротеиновая. При действии на белок азотной кислоты высокой концентрации образуется осадок, который при нагревании приобретает желтый цвет.
2. Биуретовая. При действии на слабощелочной раствор белка сульфата меди образуются комплексные соединения между ионами меди и полипептидами, что сопровождается окрашиванием раствора в фиолетово-синий цвет. Реакция используется в клинической практике для определения концентрации белка в сыворотке крови и других биологических жидкостях.
Еще одним важнейшим химическим свойством является обнаружение серы в белковых соединениях. С этой целью щелочной раствор белка нагревают с солями свинца. При этом получают черный осадок, содержащий сульфид свинца.
Биологическое значение белка
Рис. 4. Структура фермента аланинаминотрансферазы
Благодаря своим физическим и химическим свойствам белки выполняют большое количество биологических функций, в перечень которых входят:
- каталитическая (белки-ферменты);
- транспортная (гемоглобин);
- структурная (кератин, эластин);
- сократительная (актин, миозин);
- защитная (иммуноглобулины);
- сигнальная (рецепторные молекулы);
- гормональная (инсулин);
- энергетическая.
Белки важны для организма человека, поскольку участвуют в образовании клеток, обеспечивают сокращение мышц у животных, вместе с сывороткой крови переносят многие химические соединения. Помимо этого, белковые молекулы являются источником незаменимых аминокислот и осуществляют защитную функцию, участвуя в выработке антител и формировании иммунитета.
ТОП-10 малоизвестных фактов о белке

Интересный факт! Первый белок выделили из муки
- Белки начали изучать с 1728 года, именно тогда итальянец Якопо Бартоломео Беккари выделил белок из муки.
- Сейчас широкое распространение получили рекомбинантные белки. Их синтезируют путем модификации генома бактерий. В частности, таким способом получают инсулин, факторы роста и другие белковые соединения, которые используют в медицине.
- У антарктических рыб были обнаружены белковые молекулы, предотвращающие замерзание крови.
- Белок резилин отличается идеальной эластичностью и является основой мест крепления крыльев насекомых.
- В организме есть уникальные белки шапероны, которые способны восстанавливать корректную нативную третичную или четвертичную структуру других белковых соединений.
- В ядре клетки присутствуют гистоны – белки, которые принимают участие в компактизации хроматина.
- Молекулярную природу антител – особых защитных белков (иммуноглобулинов) – начали активно изучать с 1937 года. Тиселиус и Кабат применяли электрофорез и доказали, что у иммунизированных животных увеличена гамма-фракция, а после абсорбции сыворотки провоцирующим антигеном, распределение белков по фракциям возвращалось к картине интактного животного.
- Яичный белок – яркий пример реализации белковыми молекулами резервной функции.
- В молекуле коллагена каждый третий аминокислотный остаток образован глицином.
- В составе гликопротеинов 15-20% составляют углеводы, а в составе протеогликанов их доля – 80-85%.
Заключение
Белки – сложнейшие соединения, без которых сложно представить жизнедеятельность любого организма. Выделено более 5000 белковых молекул, но каждый индивидуум обладает собственным набором белков и этим отличается от других особей своего вида.
Источник
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | локальное упорядочивание фрагмента полипептидной цепи в спирали | |
| третичная | пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити) |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Все белки способны вступать в реакцию гидролиза. В случае полного гидролиза белков образуется смесь из α-аминокислот:
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Биологические функции белков
| каталитическая | ускоряют различные химические реакции в живых организмах | ферменты |
| структурная | строительный материал клеток | коллаген, белки клеточных мембран |
| защитная | защищают организм от инфекций | иммуноглобулины, интерферон |
| регуляторная | регулируют обменные процессы | гормоны |
| транспортная | перенос жизненно-необходимых веществ от одних частей организма к другим | гемоглобин переносит кислород |
| энергетическая | снабжают организм энергией | 1 грамм белка может обеспечить организм энергией в количестве 17,6 Дж |
| моторная (двигательная) | любые двигательные функции организма | миозин (мышечный белок) |
Источник


