Какими физическими свойствами обладает уксусная кислота

Обычная бутылка пищевого уксуса, которую можно найти на кухне у любой домохозяйки, имеет в составе множество других кислот и витаминов. Добавление пары капель продукта в приготовленную пищу, салаты вызывает естественное усиление вкуса. Но мало кто из нас всерьез задумывался о свойствах и реальных масштабах применения основного компонента – уксусной кислоты.
Что это за вещество?
Формула уксусной кислоты СН3СООН, что относит ее к ряду жирных карбоновых кислот. Присутствие одной карбоксильной группы (СООН) относит ее к одноосновным кислотам. Вещество встречается на земном шаре в органическом виде и получается синтетическим путем в лабораториях. Кислота является самым простым, но не менее важным представителем своего ряда. Легко растворяется в воде, гигроскопична.
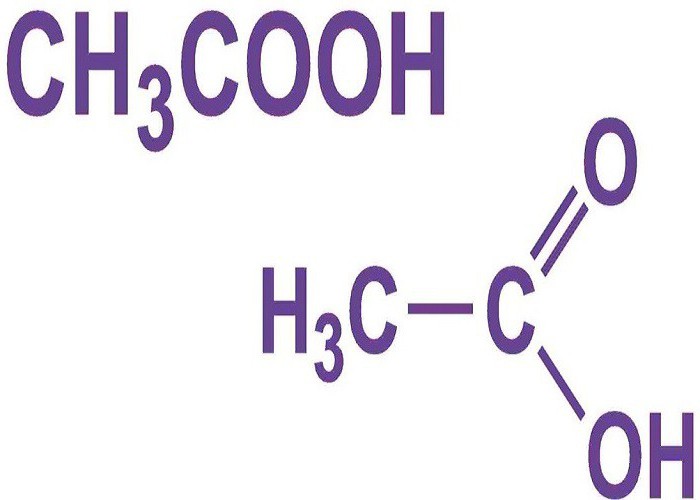
Физические свойства уксусной кислоты и плотность меняются в зависимости от температурного режима. При комнатной температуре в 20оС кислота находится в жидком состоянии, обладает плотностью 1,05 г/см3. Имеет специфический запах и кисловата на вкус. Раствор вещества без примесей твердеет и переходит в кристаллы на температуре ниже 17оС. Процесс кипения уксусной кислоты начинается при температуре свыше 117оС. Метиловая группа (СН3) формулы уксусной кислоты получается при взаимодействии спиртов с кислородом: брожение спиртовых веществ и углеводов, скисание вин.
Немного истории
Открытие уксуса было одним из первых в ряду кислот и совершалось поэтапно. Вначале уксусную кислоту стали добывать путем перегонки арабские ученые 8-го века. Однако еще в древнем Риме это вещество, полученное из скисшего вина, использовалось в качестве универсального соуса. Само название с древнегреческого переводится как “кислый”. В 17 веке ученым Европы удалось добыть чистую субстанцию вещества. На тот момент они вывели формулу и обнаружили необычную способность – уксусная кислота в парообразном состоянии воспламенялась голубым огнем.
Вплоть до 19-го века ученые находили присутствие уксусной кислоты только в органическом виде – как часть соединений солей и эфиров. В составе растений и их плодов: яблок, винограда. В организме людей и животных: потовые выделения, желчь. В начале 20-го века русские ученые случайным образом добыли уксусный альдегид из реакции ацетилена с окисью ртути. На сегодня потребление уксусной кислоты на столько велико, что ее основная добыча происходит только синтетическим способом в огромных масштабах.
Способы добычи
Будет ли уксусная кислота чистого вида или с наличием примесей в растворе зависит от метода добычи. Пищевая уксусная кислота получается биохимическим методом в процессе брожения этанола. В промышленности выделяют несколько способов добычи кислоты. Как правило, реакции сопровождаются высокой температурой и наличием катализаторов:
- Метанол в реакции с углеродом (карбонилирование).
- Окислением фракции нефти кислородом.
- Пиролизом древесины.
- Окислением ацетальдегида кислородом.

Промышленный способ эффективнее и экономичнее биохимического. Благодаря промышленному способу, объем производства уксусной кислоты в 20-м и 21-м столетии вырос в сотни раз, по сравнению с 19-м веком. На сегодня синтез уксусной кислоты карбонилированием метанола дает боле 50% от всего производимого объема.
Физические свойства уксусной кислоты и влияние ее на индикатор
В жидком состоянии уксусная кислота бесцветна. Уровень кислотности pH 2,4 легко проверяется лакмусовой бумажкой. Уксусная кислота при попадании на индикатор окрашивает его в красный цвет. Физические свойства уксусной кислоты меняются визуально. Когда температура опускается ниже 16оС, вещество принимает твердую форму и напоминает мелкие кристаллы льда. Она легко растворяется в воде и взаимодействует с широким спектром растворителей, кроме сероводорода. Уксусная кислота снижает общий объем жидкости при разбавлении ее водой. Самостоятельно опишите физические свойства уксусной кислоты, ее цвет и консистенцию, которые вы наблюдаете на следующем изображении.

Вещество воспламеняется при температуре от 455оС с выделением теплоты в 876 кДж/моль. Молярная масса составляет 60,05 г/моль. Физические свойства уксусной кислоты как электролита в реакциях проявляются слабо. Диэлектрическая проницаемость равна 6,15 при комнатной температуре. Давление, как и плотность, – переменная величина физического свойства уксусной кислоты. При давлении 40 мм. рт. ст. и температуре 42оС начнется процесс кипения. Но уже при давлении в 100 мм. рт. ст. кипение произойдет только при 62оС.
Химические свойства
Вступая в реакцию с металлами и оксидами, вещество проявляет свои кислотные свойства. Прекрасно растворяя в себе более сложные соединения, кислота образует соли, которые называются ацетаты: магния, свинца, калия и др. Значение pK кислоты составляет 4,75.

При взаимодействии с газами уксус вступает в реакцию замещения с последующим вытеснением и образованием более сложных кислот: хлоруксусной, йодоуксусной. Растворяясь в воде, кислота диссоциирует с выделением ацетат-ионов и протонов водорода. Степень диссоциации равна 0,4 процента.
Физические и химические свойства молекул уксусной кислоты в кристаллическом виде создают диамеры на водородных связях. Также ее свойства необходимы при создании более сложных жирных кислот, стероидов и биосинтезе стеринов.
Лабораторные испытания
Обнаружить уксусную кислоту в растворе можно за счет выявления ее физических свойств, например запаха. Достаточно добавить в раствор более сильную кислоту, которая начнет вытеснять соли уксуса с выделением ее паров. Путем лабораторной перегонки CH3COONa и H2SO4 возможно получить уксусную кислоту в сухом виде.
Проведем опыт из школьной программы по химии 8 класса. Физические свойства уксусной кислоты ярко демонстрирует химическая реакция расстворения. Достаточно добавить в раствор к веществу оксид меди и слегка нагреть его. Оксид полностью растворяется, делая раствор голубоватого цвета.
Производные вещества
Качественные реакции вещества со многими растворами образуют: эфиры, амиды и соли. Однако во время производства других веществ, требования к физическим свойствам уксусной кислоты остаются высокими. Она всегда должна иметь высокую степень растворения, а значит, не иметь сторонних примесей.
В зависимости от концентрации уксусной кислоты водного раствора выделяют ряд ее производных. Концентрация вещества более 96% имеет название – ледяная уксусная кислота. Уксусную кислоту в 70-80% можно приобрести в продуктовых магазинах, там она будет называться – уксусная эссенция. Столовый уксус имеет концентрацию 3-9 %.

Уксусная кислота и повседневная жизнь
Помимо пищевых особенностей, уксусная кислота обладает рядом физических свойств, которым человечество нашло свое применение в быту. Раствор вещества невысокой концентрации легко удаляет налет с металлических изделий, поверхности зеркал и окон. Способность впитывать влагу также играет на пользу. Уксус хорошо устраняет запахи в затхлых помещениях, удаляет пятна от овощей и фруктов на одежде.
Как выяснилось, физическое свойство уксусной кислоты – устранять жир с поверхности – может найти применение в народной медицине и косметологии. Слабым раствором пищевого уксуса обрабатывают волосы для придания им блеска. Вещество широко применяется для лечения простудных заболеваний, удаления бородавок и кожных грибков. Набирает темп использование уксуса в составе косметических обертываний для борьбы с целлюлитом.
Использование в производстве
В соединениях солей и других сложных веществ уксусная кислота выступает незаменимым элементом:
- Фармацевтическая отрасль. Для создания: аспирина, антисептических и антибактериальных мазей, фенацетина.
- Производство синтетических волокон. Негорючие пленки, ацетилцеллюлоза.
- Пищевая отрасль. Для успешной консервации, приготовления маринадов и соусов, в качестве пищевой добавки E260.
- Текстильная отрасль. Входит в состав красителей.
- Производство косметики и средств гигиены. Ароматические масла, крема для улучшения тонуса кожи.
- Изготовление протрав. Используется как инсектицид и протрава от сорняков.
- Производство лаков. Технические растворители, производство ацетона.

Ежегодно производство уксусной кислоты увеличивается. На сегодня его объем в мире составляет более 400 тысяч тонн в месяц. Транспортировка кислоты осуществляется в прочных цистернах из стали. Хранение в пластиковой таре на многих производствах в связи с высокой физической и химической активностью уксусной кислоты запрещено либо ограничено сроком до нескольких месяцев.
Безопасность
Уксусная кислота высокой концентрации имеет третью степень воспламенения и выделяет токсичные пары. Рекомендуется надевать специальные противогазы и другие средства индивидуальной защиты в процессе работы с кислотой. Смертельная доза для человеческого организма от 20 мл. В момент попадания вещества внутрь кислота в первую очередь обжигает слизистую оболочку, а затем поражает остальные органы. В таких случаях нужна немедленная госпитализация.
После попадания кислоты на открытые участки кожи рекомендуется сразу промыть их проточной водой. Поверхностный ожог кислотой может вызвать некроз тканей, что также требует госпитализации.
Интересные факты
Ученые физиологии выяснили, что человеку вовсе не обязателен прием уксусной кислоты – без пищевых добавок можно обойтись. Зато людям с непереносимостью кислоты, а также с проблемами желудка, вещество противопоказано.

Уксусная кислота используется в книгопечатании.
Вещество в небольшом количестве было найдено в меде, бананах и пшенице.
Охладив уксусную кислоту и резко взболтав с ней емкость, можно наблюдать ее резкое застывание.
Небольшая концентрация уксусной кислоты может снизить болевой симптом от укуса насекомых, а также мелких ожогов.
Прием в пищу продуктов с малым содержанием уксусной кислоты снижает уровень холестерина в организме. Вещество хорошо стабилизирует уровень сахара у диабетиков.
Употребление белковой и углеводной пищи вместе с небольшим количеством уксусной кислоты повышает их усвояемость организмом.
Если еда пересолена, достаточно добавить пару капель уксуса, чтобы сгладить солоноватость.
Напоследок
Тысячелетия использования уксусной кислоты привели к тому, что ее физические и химические свойства находят свое применение на каждом шагу. Сотни возможных реакций, тысячи полезных веществ, благодаря которым человечество идет дальше. Главное знать все особенности уксусной кислоты, ее положительные и отрицательные качества.
Не стоит забывать о пользе, но всегда надо помнить какой вред может причинить неосторожное обращение с уксусной кислотой высокой концентрации. По своей опасности она стоит рядом с соляной и серной кислотой. Всегда помните о технике безопасности при использовании кислоты. Правильно и осторожно разбавляйте эссенцию водой.
Источник
Этановая или уксусная кислота – это слабая карбоновая кислота, которая широко применяется в промышленности. Химические свойства уксусной кислоты определяет карбоксильная группа COOH.

Физические свойства
Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
По физическим свойствам уксусная кислота – бесцветная жидкость с кислым вкусом и резким запахом. Попадание жидкости на слизистые оболочки вызывает химический ожог. Уксусная кислота обладает гигроскопичностью, т.е. способна поглощать водяные пары. Хорошо растворима в воде.

Рис. 1. Уксусная кислота.
Основные физические свойства уксуса:
- температура плавления – 16,75°C;
- плотность – 1,0492 г/см3;
- температура кипения – 118,1°C;
- молярная масса – 60,05 г/моль;
- теплота сгорания – 876,1 кДж/моль.
В уксусе растворяются неорганические вещества и газы, например, бескислородные кислоты – HF, HCl, HBr.
Получение
Способы получения уксусной кислоты:
- из ацетальдегида путём окисления атмосферным кислородом в присутствии катализатора Mn(CH3COO)2 и высокой температуре (50-60°С) – 2CH3CHO + O2 → 2CH3COOH;
- из метанола и угарного газа в присутствии катализаторов (Rh или Ir) – CH3OH + CO → CH3COOH;
- из н-бутана путём окисления в присутствии катализатора при давлении 50 атм и температуре 200°C – 2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O.
Рис. 2. Графическая формула уксусной кислоты.
Уравнение брожения выглядит следующим образом – СН3СН2ОН + О2 → СН3СООН + Н2О. В качестве сырья используется сок или вино, кислород и ферменты бактерий или дрожжей.
Химические свойства
Уксусная кислота проявляет слабые кислотные свойства. Основные реакции уксусной кислоты с различными веществами описаны в таблице.
Взаимодействие | Что образуется | Пример |
С металлами | Соль, водород | Mg + 2CH3COOH → (CH3COO)2Mg + H2 |
С оксидами | Соль, вода | CaO + 2CH3COOH → (CH3COO)2Ca + H2O |
С основаниями | Соль, вода | CH3COOH + NaOH → CH3COONa + H2O |
С солью | Соль, углекислый газ, вода | 2CH3COOH + K2CO3 → 2CH3COOK + CO2 + H2O |
С неметаллами (реакция замещения) | Органическая и неорганическая кислоты | – CH3COOH + Cl2 → CH2ClCOOH (хлоруксусная кислота) + HCl; – CH3COOH + F2 → CH2FCOOH (фторуксусная кислота) + HF; – CH3COOH + I2 → CH2ICOOH (иодуксусная кислота) + HI |
С кислородом (реакция окисления) | Углекислый газ и вода | CH3COOH + 2O2 → 2CO2 + 2H2O |
Эфиры и соли, которые образует уксусная кислота, называются ацетатами.
Применение
Уксусная кислота широко применяется в различных отраслях:
- в фармацевтике – входит в состав лекарственных препаратов;
- в химической промышленности – используется для производства ацетона, красителей, ацетилцеллюлозы;
- в пищевой промышленности – применяется для консервации и вкуса;
- в лёгкой промышленности – используется для закрепления краски на ткани.
Уксусная кислота является пищевой добавкой под маркировкой Е260.

Рис. 3. Использование уксусной кислоты.
Что мы узнали?
CH3COOH – уксусная кислота, получаемая из ацетальдегида, метанола, н-бутана. Это бесцветная жидкость с кислым вкусом и резким запахом. Из разбавленной уксусной кислоты производят уксус. Кислота обладает слабыми кислотными свойствами и реагирует с металлами, неметаллами, оксидами, основаниями, солями, кислородом. Уксусная кислота широко применяется в фармацевтике, пищевой, химической и лёгкой промышленности.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Александр Балабан
5/5
Елизавета Маркова
5/5
Оценка доклада
Средняя оценка: 4.2. Всего получено оценок: 376.
Источник
| Уксусная кислота | |
|---|---|
 | |
 | |
| Систематическое наименование | Этановая кислота |
| Традиционные названия | Уксусная кислота |
| Хим. формула | C2H4O2 |
| Рац. формула | CH3COOH |
| Состояние | Жидкость |
| Молярная масса | 60,05 г/моль |
| Плотность | 1,0492 г/см³ |
| Поверхностное натяжение | 27,1 ± 0,01 мН/м, 24,61 ± 0,01 мН/м и 22,13 ± 0,01 мН/м |
| Динамическая вязкость | 1,056 мПа·с, 0,786 мПа·с, 0,599 мПа·с и 0,464 мПа·с |
| Энергия ионизации | 10,66 ± 0,01 эВ |
| Т. плав. | 16,75 °C |
| Т. кип. | 118,1 °C |
| Т. всп. | 103 ± 1 градус Фаренгейта и 39 ± 6 градус Цельсия |
| Т. свспл. | 427 ± 1 градус Цельсия |
| Пр. взрв. | 4 ± 0,1 об.% |
| Кр. точка | 321,6 °C, 5,79 МПа |
| Мол. теплоёмк. | 123,4 Дж/(моль·К) |
| Энтальпия образования | −487 кДж/моль |
| Давление пара | 11 ± 1 мм рт.ст., 10 ± 1 кПа и 100 ± 1 кПа |
| pKa | 4,76 (Ka=1,75*10-5) |
| Показатель преломления | 1,372 |
| Дипольный момент | 1,74 Д |
| ГОСТ | ГОСТ 61-75 ГОСТ 6968-76 ГОСТ 19814-74 ГОСТ 18270-72 |
| Рег. номер CAS | 64-19-7 |
| PubChem | 176 |
| Рег. номер EINECS | 200-580-7 |
| SMILES | CC(=O)O |
| InChI | 1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4) QTBSBXVTEAMEQO-UHFFFAOYSA-N |
| Кодекс Алиментариус | E260 |
| RTECS | AF1225000 |
| ChEBI | 15366 |
| Номер ООН | 2789 |
| ChemSpider | 171 |
| Токсичность | |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Уксусная кислота (этановая кислота) CH3COOH — органическое соединение, слабая, предельная одноосновная карбоновая кислота. Соли и сложные эфиры уксусной кислоты называются ацетатами.
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к III веку до н. э. Греческий учёный Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения свинцовых белил, а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». Сапа содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют свинцовым сахаром или сахаром Сатурна. Высокая популярность сапы была причиной хронического отравления свинцом, распространённого среди римской аристократии.
В VIII веке арабский алхимик Джабир ибн Хайян впервые изложил способы получения уксуса.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины XX века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреасом Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Огюстом Аде (фр. Pierre Auguste Adet).
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту.
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тысяч тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго.
Физические свойства

Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров.
Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу.
- Давление паров (в мм. рт. ст.):
- 10 (+17,1 °C)
- 40 (+42,4 °C)
- 100 (+62,2 °C)
- 400 (+98,1 °C)
- 560 (+109 °C)
- 1520 (+143,5 °C)
- 3800 (+180,3 °C)
- Относительная диэлектрическая проницаемость: 6,15 (+20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (+25,2 °C); 0,79 (+50 °C)
- Поверхностное натяжение: 27,8 мН/м (+20 °C)
- Удельная теплоёмкость при постоянном давлении: 2,01 Дж/г·K (+17 °C)
- Стандартная энергия Гиббса образования ΔfG0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfS0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: +38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| Вещество | tкип, °C | массовая доля уксусной кислоты |
|---|---|---|
| четырёххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип +88 °C);
- с водой и бутилацетатом (tкип +89 °C).
Получение
В промышленности
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана.
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 % при температуре +50—+60 °С.
2CH3CHO + O2 ⟶ 2CH3COOH
Окисление н-бутана проводилось при 150 атм. Катализатором этого процесса являлся ацетат кобальта.
2C4H10 + 5O2 ⟶ 4CH3COOH + 2H2O
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола.
Каталитическое карбонилирование метанола

Каталитическая схема процесса фирмы Monsanto
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода, которое происходит по формальному уравнению:
CH3OH + CO ⟶ CH3COOH
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом. Катализатором превращения служил йодид кобальта. Метод заключался в барботаже монооксида углерода при температуре 180 °С и давлениях 200—700 атм через смесь реагентов. Выход уксусной кислоты составляет 90 % по метанолу и 70 % по СО. Одна из установок была построена в Гейсмаре (шт. Луизиана) и долго оставалась единственным процессом BASF в США.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году. Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO).
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты.
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства
При биохимическом производстве уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта.
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольдегидрогеназы. Это сложный многоступенчатый процесс, который описывается формальным уравнением:
CH3CH2OH + O2 → CH3COOH + H2O
Гидратация ацетилена в присутствии ртути и двухвалентных солей ртути
C2H2 + H2O → Hg2 + CH3CHO — Реакция Кучерова
CH3CHO →CrO3,H2SO4 CH3COOH

Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот, и иногда рассматривается как их наиболее типичный представитель (в отличие от муравьиной кислоты, которая обладает некоторыми свойствами альдегидов). Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1,0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
На слабой диссоциации уксусной кислоты в водном растворе основана качественная реакция на наличие солей уксусной кислоты: к раствору добавляется сильная кислота (например, серная), если появляется запах уксусной кислоты, значит, соль уксусной кислоты в растворе присутствует (кислотные остатки уксусной кислоты, образовавшиеся из соли, связались с катионами водорода от сильной кислоты и получилось большое количество молекул уксусной кислоты).

Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями.
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты:
Mg + 2CH3COOH → (CH3COO)2Mg + H2↑
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота:
CH3COOH + Cl2 → CH2ClCOOH + HCl

Этим путём могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
Уксусная кислота может быть восстановлена до этанола действием алюмогидрида лития. Она также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусной кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана и карбоната натрия.
Применение
Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70—80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3—15 % — уксусом. Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании и для избавления от накипи. Однако количество уксусной кислоты, используемой в качестве уксуса, очень мало, по сравнению с количеством уксусной кислоты, используемой в крупнотоннажном химическом производстве.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Безопасность
Безводная уксусная кислота — едкое вещество. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л. Предельно допустимая концентрация в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³.
Действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %. Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины.
Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена. Смертельная доза составляет примерно 20 мл.
Последствиями приёма концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; последствия всасывания уксусной эссенции — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
При приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог. Показано промывание желудка через зонд. Необходима немедленная госпитализация.

Одноосновные предельные карбоновые кислоты | |
|---|---|
| С1 — С6 | Муравьиная (С1) · Уксусная (С2) · Пропионовая (С3) · Масляная (С4) · Валериановая (С5) · Капроновая (С6) |
| С7 — С12 | Энантовая (С7) · Каприловая (С8) · Пеларгоновая (С9) · Каприновая (С10) · Ундециловая (С11) · Лауриновая (С12) |
| С13 — С18 | Тридекановая (С13) · Миристиновая (С14) · Пентадекановая (С15) · Пальмитиновая (С16) · Маргариновая (С17) · Стеариновая (С18) |
| С19 — С24 | Нонадекановая (С19) · Арахиновая (С20) · Генэйкозановая (С21) · Бегеновая (С22) · Трикозановая (С23) · Лигноцериновая (С24) |
| С25 — С30 | Пентакозановая (С25) · Церотиновая (С26) · Гептакозановая (С27) · Монтановая (С28) · Нонакозановая (С29) · Мелиссовая (С30) |
| С31 — С36 | Гентриаконтановая (С31) · Лацериновая (С32) · Псилластеариновая (С33) · Геддовая (С34) · Церопластовая (С35) · Гексатриаконтановая (С36) |
Источник

