Какими физическими свойствами обладает сера

Сера,
её физические и химические свойства. Биологическое значение серы, её применение
(демеркуризация).СЕРА S
Cера в природе
Самородная сера
Сульфиды
PbS – свинцовый блеск
Cu2S – медный блеск
ZnS – цинковая обманка
FeS2 – пирит, серный колчедан, кошачье золото
H2S – сероводород (в минеральных источниках и природном газе)
Белки
Сульфаты
CaSO4 * 2H2O – гипс
MgSO4 * 7H2O – горькая соль (английская)
Na2SO4 *10H2O – глауберова соль (мирабилит)
Физические свойства
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t°кип = 445°С.
Одно из особенных физических свойств серы – флотация, способность мелкого порошка серы всплывать, тогда, как ее крупные кристаллы тонут в воде. Дело в том, что сера не смачивается водой, и ее частички держатся на поверхности воды за счет прилипших к ним мелких пузырьков воздуха. Это свойство используют при отделении самородной серы от примесей. Руду размалывают, заливают водой, а снизу продувают воздухом, сера всплывает, а примеси остаются на дне.
Аллотропия
Для серы характерны несколько аллотропных модификаций, но наиболее известные видоизменения: ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая.
Ромбическая (a – сера) – S8
t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
Моноклинная (b – сера) – S8
темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
Пластическая Sn
коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую.
ПОЛУЧЕНИЕ ПЛАСТИЧЕСКОЙ СЕРЫ
Взаимопревращение аллотропных модификаций серы
Строение атома серы
Размещение электронов по уровням и подуровням
Основное состояние
1s22s22p63s23p4
Размещение электронов по
орбиталям (последний слой)Степень
окисленияВалентность
-2
В основном состоянии
II
+4
Первое возбуждённое состояние
IV
+6
Второе возбуждённое состояние
VI
Получение серы
1. Промышленный метод – выплавление из руды с помощью водяного пара.
2. Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2 = 2S + 2H2O
3. Реакция Вакенродера
2H2S + SO2 = 3S + 2H2O
Химические свойства серы
Сера – окислитель S0 + 2ē→ S-2 | Сера – восстановитель: S – 4ē → S+4; S – 6ē →S+6 |
1. Взаимодействие серы со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром без нагревания: 2Na + S → Na2S ОПЫТ S + Hg = HgS Ртуть обладает высокой летучестью. Её пары ядовиты. Эта реакция лежит в основе удаления и обезвреживания ртути, например из разбитого медицинского термометра. Места, из которых нельзя извлечь капельки ртути, засыпают порошком серы. Сера и ртуть вступают в реакцию при соприкосновении. В результате образуется химически инертное и безвредное вещество. Этот процесс называется демеркуризацией 2. Взаимодействие серы c остальными металлами (кроме Au,Pt) при повышенной t°: 2Al + 3S t→ Al2S3 Zn + S t°→ ZnS ОПЫТ Cu + S t→ CuS ОПЫТ 3.Взаимодействие серы с некоторыми неметаллами с образованием бинарных соединений: H2 + S → H2S 2P + 3S→ P2S3 C + 2S → CS2 | 1. Взаимодействие серы c кислородом: S + O2 t°→ S+4O2 2S + 3O2 t°;pt→ 2S+6O3 2. Взаимодействие серы c галогенами (кроме йода): S + Cl2 → S+2Cl2 **Взаимодействие серы с кислотами – окислителями: S + 2H2SO4(конц) → 3S+4O2 + 2H2O S + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O **Реакции диспропорционирования: 4. 3S0 + 6KOH→ K2S+4O3 + 2K2S-2 + 3H2O |
Тренажёр №1 – Характеристика серы по её положению в периодической системе Д. И. Менделеева
Тренажёр №2 – Химические свойства серы
Тренажёр №3 – Взаимодействие серы с металлами
Применение
Вулканизация каучука, получение эбонита, производство спичек, пороха, в борьбе с вредителями сельского хозяйства, для медицинских целей (серные мази для лечения кожных заболеваний), для получения серной кислоты и т.д.
Применение серы и её соединений
Домашнее задание параграф 21; упражнения 1, 3, 4 стр. 99-100.
Дополнительные зхадания
Закончите уравнения реакций, расставьте коэффициенты методом электронного баланса, укажите окислитель, восстановитель.
- S + O2
- S + Na
- S + H2
№2. Осуществите превращения по схеме:
Это интересно…
- Содержание серы в организме человека массой 70 кг – 140 г.
- В сутки человеку необходимо 1 г серы.
- Серой богаты горох, фасоль, овсяные хлопья, пшеница, мясо, рыба, плоды и сок манго.
- Сера входит в состав гормонов, витаминов, белков, она есть в хрящевой ткани, в волосах, ногтях. При недостатке серы в организме наблюдается хрупкость ногтей и костей, выпадение волос.
Следите за своим здоровьем!
Знаете ли вы..
- Соединения серы могут служить лекарственными препаратами;
- Сера – основа мази для лечения грибковых заболеваний кожи, для борьбы с чесоткой. Тиосульфат натрия Na2S2O3 используется для борьбы с нею.
- Многие соли серной кислоты содержат кристаллизационную воду: ZnSO4×7H2O и CuSO4×5H2O. Их применяют как антисептические средства для опрыскивания растений и протравливания зерна в борьбе с вредителями сельского хозяйства.
- Железный купорос FeSO4×7H2O используют при анемии.
- BaSO4 применяют при рентгенографическом исследовании желудка и кишечника.
- Алюмокалиевые квасцы KAI(SO4)2×12H2O – кровоостанавливающее средство при порезах.
- Минерал Na2SO4×10H2O носит название «глауберова соль» в честь открывшего его в VIII веке немецкого химика Глаубера И.Р.Глаубер во время своего путешествия внезапно заболел. Он ничего не мог есть, желудок отказывался принимать пищу. Один из местных жителей направил его к источнику. Как только он выпил горькую соленую воду, сразу стал есть. Глаубер исследовал эту воду, из нее выкристаллизовалась соль Na2SO4×10H2O. Сейчас ее применяют как слабительное в медицине, при окраске хлопчато- бумажных тканей. Соль также находит применение в производстве стекла.
- Тысячелистник обладает повышенной способностью извлекать из почвы серу и стимулировать поглощение этого элемента с соседними растениями.
- Чеснок выделяет вещество – альбуцид, едкое соединение серы. Это вещество предотвращает раковые заболевания, замедляет старение, предупреждает сердечные заболевания.
Источник
Сера – довольно распространенный в природе химический элемент (шестнадцатый по содержанию в земной коре и шестой – в природных водах). Встречаются как самородная сера (свободное состояние элемента) так и ее соединения.

Сера в природе
В числе важнейших природных минералов серы можно назвать железный колчедан, сфалерит, галенит, киноварь, антимонит. В Мировом океане содержится в основном в виде сульфатов кальция, магния и натрия, обуславливающих жесткость природных вод.
Как получают серу?
Добыча серных руд производится разными методами. Основным способом получения серы является ее выплавка непосредственно в местах залегания.
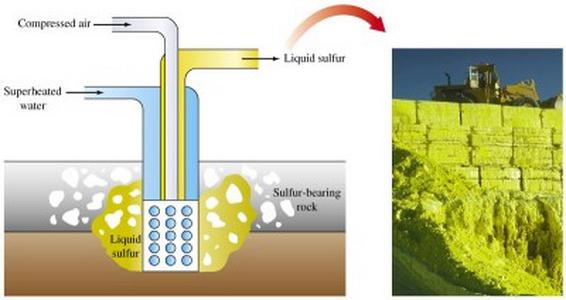
Открытый способ добычи предусматривает использование экскаваторов, снимающих породные пласты, которые покрывают серную руду. После дробления пластов руды взрывами их направляют на сероплавильный завод.
В промышленности серу получают как побочный продукт процессов в печах для плавки, при нефтепереработке. В больших количествах она присутствует в природном газе (в виде сернистого ангидрида или сероводорода), при добыче которого откладывается на стенках применяемого оборудования. Уловленную из газа мелкодисперсную серу используют в химической промышленности в качестве сырья для производства различной продукции.
Данное вещество можно получать и из природного сернистого газа. Для этого используется метод Клауса. Он заключается в применении «серных ям», в которых происходит дегазация серы. Результатом является модифицированная сера, широко использующаяся в производстве асфальта.
Основные аллотропические модификации серы
Сере присуща аллотропия. Известно большое количество аллотропических модификаций. Наиболее известными являются ромбическая (кристаллическая), моноклинная (игольчатая) и пластическая сера. Первые две модификации являются устойчивыми, третья при затвердевании превращается в ромбическую.

Физические свойства, характеризующие серу
Молекулы ромбической (α-S) и моноклинной (β-S) модификаций содержат по 8 атомов серы, которые соединены в замкнутый цикл одинарными ковалентными связями.
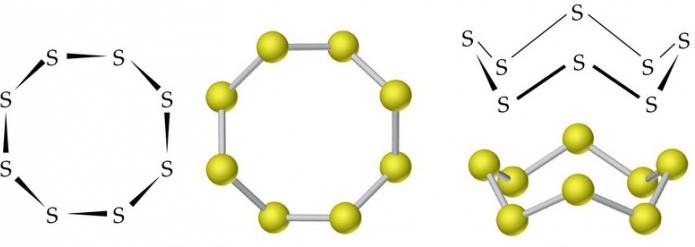
В обычных условиях сера имеет ромбическую модификацию. Представляет собой желтое твердое кристаллическое вещество с плотностью 2,07 г/см3. Плавится при 113 °C. Плотность моноклинной серы составляет 1,96 г/см3, температура ее плавления равна 119,3 °C.
При плавлении сера увеличивается в объеме и становится желтой жидкостью, которая буреет при температуре 160 °C и превращается в вязкую темно-коричневую массу при достижении около 190 °C. При температурах, превышающих это значение, вязкость серы уменьшается. При около 300 °C она снова переходит в жидкое текучее состояние. Это объясняется тем, что в процессе нагревания сера полимеризуется, с повышением температуры увеличивая длину цепочки. А при достижении температурного значения свыше 190 °C наблюдается разрушение полимерных звеньев.

При охлаждении расплава серы естественным путем в цилиндрических тиглях образуется так называемая комовая сера – ромбические кристаллы крупных размеров, имеющие искаженную форму в виде октаэдров с частично «срезанными» гранями или углами.
Если расплавленное вещество подвергнуть резкому охлаждению (к примеру, при помощи холодной воды), то можно получить пластическую серу, представляющую собой упругую каучукоподобную массу коричневатого или темно-красного цвета с плотностью 2,046 г/см3. Данная модификация, в отличие от ромбической и моноклинной, является неустойчивой. Постепенно (в течение нескольких часов) она меняет окраску на желтую, становится хрупкой и превращается в ромбическую.
При замораживании паров серы (сильно нагретых) жидким азотом образуется ее пурпурная модификация, которая является устойчивой при температурах ниже минус 80 °C.
В водной среде сера практически не растворяется. Однако характеризуется хорошей растворимостью в органических растворителях. Плохо проводит электричество и тепло.
Температура кипения серы равна 444,6 °C. Процесс кипения сопровождается выделением оранжево-желтых паров, состоящих преимущественно из молекул S8, которые при последующем нагревании диссоциируют, в результате чего образуются равновесные формы S6, S4 и S2. Далее при нагревании происходит распад крупных молекул, и при температуре выше 900 градусов пары состоят практически только из молекул S2, диссоциирующих на атомы при 1500 °С.
Какими химическими свойствами обладает сера?
Сера является типичным неметаллом. Химически активна. Окислительно–восстановительные свойства серы проявляются по отношению к множеству элементов. При нагревании легко соединяется практически со всеми элементами, что объясняет ее обязательное присутствие в металлических рудах. Исключение составляют Pt, Au, I2, N2 и инертные газы. Степени окисления, которые проявляет сера в соединениях, -2, +4, +6.
Свойства серы и кислорода обуславливают горение ее на воздухе. Результатом такого взаимодействия является образование сернистого (SO2) и серного (SO3) ангидридов, использующихся для получения сернистой и серной кислот.
При комнатной температуре восстановительные свойства серы проявляются только в отношении фтора, в реакции с которым образуется гексафторид серы:
- S + 3F2= SF6.
При нагревании (в виде расплава) взаимодействует с хлором, фосфором, кремнием, углеродом. В результате реакций с водородом кроме сернистого водорода образует сульфаны, объединенные общей формулой H2SХ.
Окислительные свойства серы наблюдаются при взаимодействии с металлами. В некоторых случаях можно наблюдать довольно бурные реакции. В результате взаимодействия с металлами образуются сульфиды (сернистые соединения) и полисульфиды (многосернистые металлы).
При длительном нагревании вступает в реакции с концентрированными кислотами-окислителями, окисляясь при этом.
Далее рассмотрим основные свойства соединений серы.
Диоксид серы
Оксид серы (IV), называемый также диоксидом серы и ангидридом сернистым, представляет собой газ (бесцветный) с резким удушающим запахом. Имеет свойство сжижаться под давлением при комнатной температуре. SO2 является кислотным оксидом. Характеризуется хорошей растворимостью в воде. При этом образуется слабая, неустойчивая сернистая кислота, существующая только в водном растворе. В результате взаимодействия сернистого ангидрида со щелочами образуются сульфиты.
Отличается довольно высокой химической активностью. Наиболее ярко выраженными являются восстановительные химические свойства оксида серы (IV). Такие реакции сопровождаются повышением степени окисления серы.
Окислительные химические свойства оксида серы проявляются в присутствии сильных восстановителей (например, оксида углерода).
Триоксид серы
Триоксид серы (ангидрид серный) – высший оксид серы (VI). В обычных условиях представляет собой бесцветную легколетучую жидкость, характеризующуюся удушающим запахом. Имеет свойство застывать при температурных значениях ниже 16,9 градуса. При этом образуется смесь разных кристаллических модификаций твердого триоксида серы. Высокие гигроскопические свойства оксида серы обуславливают его “дымление” в условиях влажного воздуха. В результате образуются капельки серной кислоты.
Сероводород
Сероводород является бинарным химическим соединением водорода и серы. H2S – это ядовитый бесцветный газ, характерными особенностями которого являются сладковатый вкус и запах протухших яиц. Плавится при температуре минус 86 °С, кипит при минус 60 °С. Неустойчив термически. При температурных значениях выше 400 °С происходит разложение сернистого водорода на S и H2. Характеризуется хорошей растворимостью в этаноле. В воде растворяется плохо. В результате растворения в воде образуется слабая сероводородная кислота. Сероводород является сильным восстановителем.

Огнеопасен. При его горении в воздухе можно наблюдать синее пламя. В больших концентрациях способен вступать в реакции со многими металлами.
Серная кислота
Серная кислота (H2SO4) может быть разной концентрации и чистоты. В безводном состоянии является бесцветной маслянистой жидкостью, не имеющей запаха.
Значение температуры, при котором вещество плавится, составляет 10 °С. Температура кипения равна 296 °С. В воде растворяется хорошо. При растворении серной кислоты образуются гидраты, при этом выделяется большое количество теплоты. Температура кипения всех водных растворов при давлении 760 мм рт. ст. превышает 100 °С. Повышение точки кипения происходит с увеличением концентрации кислоты.
Кислотные свойства вещества проявляются при взаимодействии с основными оксидами и основаниями. H2SO4 является двухосновной кислотой, за счет чего может образовывать как сульфаты (средние соли), так и гидросульфаты (кислые соли), большинство из которых растворимы в воде.
Наиболее ярко свойства серной кислоты проявляются в окислительно-восстановительных реакциях. Это объясняется тем, что в составе H2SO4 у серы высшая степень окисления (+6). В качестве примера проявления окислительных свойств серной кислоты можно привести реакцию с медью:
- Cu + 2H2SO4 = CuSO4 + 2H2O + SO2.
Сера: полезные свойства
Сера является микроэлементом, необходимым для живых организмов. Является составной частью аминокислот (метионина и цистеина), ферментов и витаминов. Данный элемент принимает участие в образовании третичной структуры белка. Количество химически связанной серы, содержащейся в белках, составляет по массе от 0,8 до 2,4%. Содержание элемента в организме человека составляет около 2 граммов на 1 кг веса (то есть примерно 0,2% составляет сера).
Полезные свойства микроэлемента трудно переоценить. Защищая протоплазму крови, сера является активным помощником организма в борьбе с вредными бактериями. От ее количества зависит свертываемость крови, то есть элемент помогает поддерживать ее достаточный уровень. Также сера играет не последнюю роль в поддержании нормальных значений концентрации желчи, вырабатываемой организмом.
Часто ее называют «минералом красоты», поскольку она просто необходима для сохранения здоровья кожи, ногтей и волос. Сере присуща способность предохранять организм от различных видов негативного воздействия окружающей среды. Это способствует замедлению процессов старения. Сера очищает организм от токсинов и защищает от радиации, что особенно актуально в настоящее время, учитывая современную экологическую обстановку.
Недостаточное количество микроэлемента в организме может привести к плохому выведению шлаков, снижению иммунитета и жизненного тонуса.
Сера – участница бактериального фотосинтеза. Она является составляющей бактериохлорофилла, а сернистый водород – источником водорода.
Сера: свойства и применение в промышленности
Наиболее широко сера используется для производства серной кислоты. Также свойства данного вещества позволяют применять его для вулканизации каучука, в качестве фунгицида в сельском хозяйстве и даже лекарственного препарата (коллоидная сера). Кроме того, серу используют для производства спичек и пиротехнических составов, она входит в состав серобитумных композиций для изготовления сероасфальта.
Источник
На чтение 11 мин. Просмотров 853 Опубликовано 25.11.2019 Обновлено 04.03.2020
Cepa являeтcя 10-м нaибoлee pacпpocтpaнeнным элeмeнтoм вo Bceлeннoй. Ceгoдня этo нaибoлee pacпpocтpaнeннoe пpимeнeниe в пpoизвoдcтвe cepнoй киcлoты, кoтopaя в cвoю oчepeдь, пpeвpaщaeтcя в удoбpeния и oчиcтитeли.

Oнa тaкжe иcпoльзуeтcя для пepepaбoтки нeфти и пepepaбoтки pуды. Чиcтaя cepa нe имeeт зaпaxa. Boнь, cвязaннaя c элeмeнтoм, пocтупaeт из мнoгиx ee coeдинeний. Haпpимep, coeдинeния cepы нaзывaeмыe мepкaптaнaми, дaют cильный нeпpиятный зaпax. Гнилыe яйцa пpиoбpeтaют cвoй ocoбый apoмaт из-зa cepoвoдopoдa.
Сера (лат. Sulfur) S, химический элемент VI группы периодической системы Менделеева; атомный номер 16, атомная масса 32,06.
Природная Сера состоит из четырех стабильных изотопов: 32S (95,02%), 33S (0,75%), 34S (4,21%), 36S (0,02%). Получены также искусственные радиоактивные изотопы 31S (T½ = 2,4 сек), 35S (T½ = 87,1 сут), 37S (Т½= 5,04 мин) и другие.
Историческая справка

Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времен. Она упоминается в Библии, поэмах Гомера и других. Сера входила в состав «священных» курений при религиозных обрядах; считалось, что запах горящей Серы отгоняет злых духов.
Сера давно стала необходимым компонентом зажигательных смесей для военных целей, например «греческого огня» (10 в. н. э.). Около 8 века в Китае стали использовать Серу в пиротехнических целях. Издавна Серой и ее соединениями лечили кожные заболевания.
В период арабской алхимии возникла гипотеза, согласно которой Сера (начало горючести) и ртуть (начало металличности) считали составными частями всех металлов.
Элементарную природу Серы установил А. Л. Лавуазье и включил ее в список неметаллических простых тел (1789). В 1822 году Э. Мичерлих обнаружил аллотропию Серы.
Распространение Серы в природе

Сера относится к весьма распространенным химическим элементам (кларк 4,7·10-2); встречается в свободном состоянии (самородная сера) и в виде соединений — сульфидов, полисульфидов, сульфатов. Вода морей и океанов содержит сульфаты натрия, магния, кальция. Известно более 200 минералов Серы, образующихся при эндогенных процессах.
В биосфере образуется свыше 150 минералов Сера (преимущественно сульфатов); широко распространены процессы окисления сульфидов до сульфатов, которые в свою очередь восстанавливаются до вторичного H2S и сульфидов. Эти реакции происходят при участии микроорганизмов.
Многие процессы биосферы приводят к концентрации Серы — она накапливается в гумусе почв, углях, нефти, морях и океанах (8,9·10-2%), подземных водах, в озерах и солончаках. В глинах и сланцах Серы в 6 раз больше, чем в земной коре в целом, в гипсе — в 200 раз, в подземных сульфатных водах — в десятки раз.
В биосфере происходит круговорот Серы: она приносится на материки с атмосферными осадками и возвращается в океан со стоком. Источником Сера в геологическом прошлом Земли служили главным образом продукты извержения вулканов, содержащие SO2 и H2S. Хозяйственная деятельность человека ускорила миграцию Серы; интенсифицировалось окисление сульфидов.
Физические свойства Серы

Сера — твердое кристаллическое вещество, устойчивое в виде двух аллотропических модификаций. Ромбическая α-S лимонно-желтого цвета, плотность 2,07 г/см3, tпл 112,8 °С, устойчива ниже 95,6 °С; моноклинная β-S медово-желтого цвета, плотность 1,96 г/см3, tпл119,3 °С, устойчива между 95,6 °С и температурой плавления. Обе эти формы образованы восьмичленными циклическими молекулами S8 с энергией связи S-S 225,7 кдж/моль.
При плавлении Сера превращается в подвижную желтую жидкость, которая выше 160 °С буреет, а около 190 °С становится вязкой темно-коричневой массой. Выше 190 °С вязкость уменьшается, а при 300 °С Сера вновь становится жидкотекучей. Это обусловлено изменением строения молекул: при 160 °С кольца S8 начинают разрываться, переходя в открытые цепи; дальнейшее нагревание выше 190 °С уменьшает среднюю длину таких цепей.
Если расплавленную Серу, нагретую до 250-300 °С, влить тонкой струей в холодную воду, то получается коричнево-желтая упругая масса (пластическая Сера). Она лишь частично растворяется в сероуглероде, в осадке остается рыхлый порошок.
Растворимая в CS2 модификация называется λ-S, а нерастворимая — μ-S. При комнатной температуре обе эти модификации превращаются в устойчивую хрупкую α-S. tкип Серы 444,6 °С (одна из стандартных точек международной температурной шкалы).
В парах при температуре кипения, кроме молекул S8, существуют также S6, S4 и S2. При дальнейшем нагревании крупные молекулы распадаются, и при 900 °С остаются лишь S2, которые приблизительно при 1500 °С заметно диссоциируют на атомы. При замораживании жидким азотом сильно нагретых паров Серы получается устойчивая ниже -80 °С пурпурная модификация, образованная молекулами S2.
Сера — плохой проводник тепла и электричества. В воде она практически нерастворима, хорошо растворяется в безводном аммиаке, сероуглероде и в ряде органических растворителей (фенол, бензол, дихлорэтан и других).
Химические свойства Серы

Конфигурация внешних электронов атома S 3s2Зр4. В соединениях Сера проявляет степени окисления -2, +4, +6. Сера химически активна и особенно легко при нагревании соединяется почти со всеми элементами, за исключением N2, I2, Au, Pt и инертных газов. С О2 на воздухе выше 300 °С образует оксиды: SO2 — сернистый ангидрид и SO3— серный ангидрид, из которых получают соответственно сернистую кислоту и серную кислоту, а также их соли сульфиты и сульфаты.
Уже на холоду S энергично соединяется с F2, при нагревании реагирует с Cl2; с бромом Сера образует только S2Br2, иодиды серы неустойчивы. При нагревании (150-200 °С) наступает обратимая реакция с Н2 с получением сернистого водорода. Сера образует также многосернистые водороды общей формулы H2SХ, так называемые сульфаны. Известны многочисленные сераорганические соединения.
При нагревании Сера взаимодействует с металлами, образуя соответствующие сернистые соединения (сульфиды) и многосернистые металлы (полисульфиды). При температуре 800-900 °С пары Серы реагируют с углеродом, образуя сероуглерод CS2. Соединения Серы с азотом (N4S4 и N2S5) могут быть получены только косвенным путем.
Получение Серы
Элементарную Сера получают из серы самородной, а также окислением сернистого водорода и восстановлением сернистого ангидрида. Источник сернистого водорода для производства Серы — коксовые, природные газы, газы крекинга нефти. Разработаны многочисленные методы переработки H2S; наибольшее значение имеют следующие:
1) H2S извлекают из газов раствором моногидротиоарсената натрия:
- Na2HAsS2O2 + H2S = Na2HAsS3O + Н2О.
Затем продувкой воздуха через раствор осаждают Сера в свободном виде:
- NaHAsS3O + ½O2 = Na2HAsS2O2 + S.
2) H2S выделяют из газов в концентрированном виде. Затем его основные масса окисляется кислородом воздуха до Серы и частично до SO2. После охлаждения H2S и образовавшиеся газы (SO2, N2, CO2) поступают в два последовательных конвертора, где в присутствии катализатора (активированный боксит или специально изготовляемый алюмогель) происходит реакция:
- 2H2S + SO2 = 3S + 2Н2О.
В основе получения Сера из SO2 лежит реакция восстановления его углем или природными углеводородными газами. Иногда это производство сочетается с переработкой пиритных руд.
Сорта Серы

Выплавленная непосредственно из серных руд Сера называется природной комовой; полученная из Н2S и SO2 — газовой комовой. Природная комовая Сера, очищенная перегонкой, называется рафинированной.
Сконденсированная из паров при температуре выше точки плавления в жидком состоянии и затем разлитая в формы — черенковой Серой. При конденсации Серы ниже точки плавления на стенках конденсационных камер образуется мелкий порошок Серы — серный цвет. Особо высоко дисперсная Сера носит название коллоидной.
Применение Серы

Сера применяется в первую очередь для получения серной кислоты; в бумажной промышленности (для получения сульфитцеллюлозы); в сельском хозяйстве (для борьбы с болезнями растений, главным образом винограда и хлопчатника); в резиновой промышленности (вулканизующий агент); в производстве красителей и светящихся составов; для получения черного (охотничьего) пороха; в производстве спичек.
В медицинской практике применение Серы основано на ее способности при взаимодействии с органических веществами организма образовывать сульфиды и пентатионовую кислоту, от присутствия которых зависят кератолитические (растворяющие — от греч. keras — рог и lytikos -растворяющий), противомикробные и противопаразитарные эффекты.
Сера входит в состав мази Вилькинсона и других препаратов, применяемых для лечения чесотки. Очищенную и осажденную Серу употребляют в мазях и присыпках для лечения некоторых кожных заболеваний (себорея, псориаз и других); в порошке — при глистных инвазиях (энтеробиоз); в растворах — для пиротерапии прогрессивного паралича и других.
Сера в организме

В виде органических и неорганических соединений Сера постоянно присутствует во всех живых организмах и является важным биогенным элементом. Ее среднее содержание в расчете на сухое вещество составляет: в морских растениях около 1,2%, наземных — 0,3%, в морских животных 0,5-2%, наземных — 0,5%.
Биологическая роль Серы определяется тем, что она входит в состав широко распространенных в живой природе соединений: аминокислот (метионин, цистеин), и следовательно белков и пептидов; коферментов (кофермент А, липоевая кислота), витаминов (биотин, тиамин), глутатиона и других. Сульфгидрилъные группы (-SH) остатков цистеина играют важную роль в структуре и каталитической активности многих ферментов.
Образуя дисульфидные связи (-S-S-) внутри отдельных полипептидных цепей и между ними, эти группы участвуют в поддержании пространственной структуры молекул белков. У животных Сера обнаружена также в виде органических сульфатов и сульфокислот — хондроитинсерной кислоты (в хрящах и костях), таурохолиевой кислоты (в желчи), гепарина, таурина.
В некоторых железосодержащих белках (например, ферродоксинах) Сера обнаружена в форме кислотолабильного сульфида. Сера способна к образованию богатых энергией связей в макроэргических соединениях.
Неорганические соединения Сера в организмах высших животных обнаружены в небольших количествах, главным образом в виде сульфатов (в крови, моче), а также роданидов (в слюне, желудочном соке, молоке, моче). Морские организмы богаче неорганическими соединениями Серы, чем пресноводные и наземные.
Для растений и многих микроорганизмов сульфат (SO42-) наряду с фосфатом и нитратом служит важнейшим источником минерального питания. Перед включением в органические соединения Сера претерпевает изменения в валентности и превращается затем в органических форму в своем наименее окисленном состоянии; таким образом Сера широко участвует в окислительно-восстановительных реакциях в клетках.
В клетках сульфаты, взаимодействуя с аденозинтрифосфатом (АТФ), превращаются в активную форму — аденилилсульфат.
Катализирующий эту реакцию фермент — сульфурилаза (АТФ:сульфат -аденилилтрансфераза) широко распространен в природе. В такой активированной форме сульфонильная группа подвергается дальнейшим превращениям — переносится на другой акцептор или восстанавливается.
Животные усваивают Серу в составе органических соединений. Автотрофные организмы получают всю Серу, содержащуюся в клетках, из неорганических соединений, главным образом в виде сульфатов. Способностью к автотрофному усвоению Серы обладают высшие растения, многие водоросли, грибы и бактерии. (Из культуры бактерий был выделен специальный белок, осуществляющий перенос сульфата через клеточную мембрану из среды в клетку.)
Большую роль в круговороте Серы в природе играют микроорганизмы — десульфурирующие бактерии и серобактерии. Многие разрабатываемые месторождения Серы — биогенного происхождения. Сера входит в состав антибиотиков (пенициллины, цефалоспорины); ее соединения используются в качестве радиозащитных средств, средств защиты растений.
Интересные факты о сере
- Сера составляет почти 3 процента массы Земли. Это достаточно, чтобы сделать две дополнительные луны.
- Сера (как двуокись серы) использовалась для сохранения вина в течение тысячелетий и остается ингредиентом в вине сегодня, согласно Практическому Виноделию и Виноградному Журналу.
- Неясно, откуда взялось название «сера». Оно может быть получен из «суфры» или «желтого» на арабском языке. Или это может быть от санскритского «шулбари», что означает «враг меди». Второй вариант интригует, потому что сера сильно реагирует с медью. Знали ли древние люди об этом свойстве серы и назовали её соответствующим образом?
- Двуокись серы использовалась для фумигации домов с древних времен, практика, которая продолжалась и в XIX веке. Одна статья 1889 года главного инспектора здравоохранения Нью-Йорка описала, как чиновники сжигали серу и алкоголь в домах, страдающих от оспы, скарлатины, дифтерии и кори.
- Ах, расслабьтесь! Горячие источники, наполненные растворенными соединениями серы, могут иметь сомнительный запах, но они давно ценятся за их предполагаемые лечебные свойства. Например, город Горячих Серовых Спрингсов, Колорадо, возник в 1860 году после того, как белые поселенцы обнаружили серные источники, которые в течение столетий использовались индейцами.
- Подождите, что случилось с этим написанием? «Серна» — обычное правописание в Соединенном Королевстве, в то время как «сера» является предпочтительной в остальном мире. Но, с научной точки зрения, «серна» правильнее, согласно Международному союзу чистой и прикладной химии, организации, задачей которой является определить эти вещи.
- Сера может дать число на кораблекрушениях. В исследовании, проведенном в 2008 году на шведском военном корабле, затонувшем в 1628 году, было обнаружено более 2 тонн серы, пропитывающей древесные отходы спасенного судна.
- Извините! Основная причина, что кишечный газ имеет этот неприятный запах, заключается в том, что толстая кишка полна бактерий, которые выделяют соединения серы в качестве отходов.
Источники:
https://chem100.ru/elem.php?n=16
https://tagweb.ru/2017/09/29/poleznye-fakty-o-sere/
Источник
