Какими физическими свойствами обладает этилен

Формула – С2Н4 (СН2 = СН2). Молекулярная масса (масса одного моль) – 28 г/моль.
Углеводородный радикал, образованный от этилена называется винил (-CH = CH2). Атомы углерода в молекуле этилена находятся в sp2-гибридизации.
Химические свойства этилена
Для этилена характерны реакции, протекающщие по механизму электрофильного, присоединения, реакции радикального замещения, окисления, восстановления, полимеризации.
Галогенирование
(электрофильное присоединение) — взаимодействие этилена с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды:
CH2 = CH2 + Br2 = Br-CH2-CH2Br.
Галогенирование этилена возможно также при нагревании (300![]() С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
С), в этом случае разрыва двойной связи не происходит – реакция протекает по механизму радикального замещения:
CH2 = CH2 + Cl2 → CH2 = CH-Cl + HCl.
Гидрогалогенирование
— взаимодействие этилена с галогенводородами (HCl, HBr) с образование галогенпроизводных алканов:
CH2 = CH2 + HCl → CH3-CH2-Cl.
Гидратация
— взаимодействие этилена с водой в присутствии минеральных кислот (серной, фосфорной) с образованием предельного одноатомного спирта – этанола:
CH2 = CH2 + H2О → CH3-CH2-ОН.
Среди реакций электрофильного присоединения выделяют присоединение хлорноватистой кислоты (1), реакции гидрокси- и алкоксимеркурирования (2, 3) (получение ртутьорганических соединений) и гидроборирование (4):
CH2 = CH2 + HClO → CH2(OH)-CH2-Cl (1);
CH2 = CH2 + (CH3COO)2Hg + H2O → CH2(OH)-CH2-Hg-OCOCH3 + CH3COOH (2);
CH2 = CH2 + (CH3COO)2Hg + R-OH → R-CH2(OCH3)-CH2-Hg-OCOCH3 + CH3COOH (3);
CH2 = CH2 + BH3 → CH3-CH2-BH2 (4).
Реакции нуклеофильного присоединения характерны для производных этилена, содержащих электроноакцепторные заместители. Среди реакций нуклеофильного присоединения особое место занимают реакции присоединения циановодородной кислоты, аммиака, этанола. Например,
2ON-CH = CH2 + HCN →2ON-CH2-CH2-CN.
В ходе реакций окисления этилена возможно образование различных продуктов, причем состав определяется условиями проведения окисления. Так, при окислении этилена в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомного спирта — этиленгликоля:
3CH2 = CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH.
При жестком окислении этилена кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием муравьиной кислоты и углекислого газа:
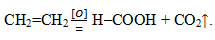
Окисление
этилена кислородом при 200![]() С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2 = CH2 +1/2O2 = CH3-CH = O.
При восстановлении этилена происходит образование этана, представителя класса алканов. Реакция восстановления (реакция гидрирования) этилена протекает по радикальному механизму. Условием протекания реакции является наличие катализаторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2 = CH2 + H2 = CH3-CH3.
Этилен вступает в реакцию полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация этилена происходит под действием кислот
(катионный механизм) или радикалов (радикальный механизм):
n CH2 = CH2 = -(-CH2-CH2-)n-.
Физические свойства этилена
Этилен – бесцветный газ со слабым запахом, малорастворимый в воде, растворим в спирте, хорошо растворим в диэтиловом эфире. При смешении с воздухом образует взрывоопасную смесь
Получение этилена
Основные способы получения этилена:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-Br + KOH → CH2 = CH2 + KBr + H2O;
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
Сl-CH2-CH2-Cl + Zn → ZnCl2 + CH2 = CH2;
— дегидратация этилена при его нагревании с серной кислотой (t >150![]() C) или пропускании его паров над катализатором
C) или пропускании его паров над катализатором
CH3-CH2-OH → CH2 = CH2 + H2O;
— дегидрирование этана при нагревании (500![]() С) в присутствии катализатора (Ni, Pt, Pd)
С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH3 → CH2 = CH2 + H2↑.
Применение этилена
Этилен является одним из важнейших соединений, производимых в огромных промышленных масштабах. Его используют в качестве сырья для производства целого спектра различных органических соединений (этанол, этиленгликоль, уксусная кислота и т.д.). Этилен служит исходным сырьем для производства полимеров
(полиэтилен и др.). Его применяют в качестве вещества, ускоряющего рост и созревание овощей и фруктов.
Примеры решения задач
Источник
Яркий представитель непредельных углеводородов — этен (этилен). Физические свойства: бесцветный горючий газ, взрывоопасный в смеси с кислородом и воздухом. В значительных количествах этилен получают из нефти для последующего синтеза ценных органических веществ (одноатомных и двухатомных спиртов, полимеров, уксусной кислоты и других соединений).
Гомологический ряд этилена, sp2-гибридизация
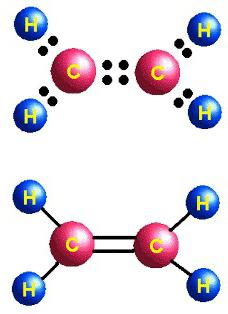
Углеводороды, сходные по строению и свойствам с этеном, называются алкенами. Исторически закрепился еще один термин для этой группы — олефины. Общая формула CnH2n отражает состав всего класса веществ. Первый его представитель — этилен, в молекуле которого атомы углерода образуют не три, а всего две õ-связи с водородом. Алкены — непредельные или ненасыщенные соединения, их формула C2H4. Смешиваются по форме и энергии только 2 p- и 1 s-электронное облако атома углерода, всего формируются три õ-связи. Это состояние называется sp2-гибридизацией. Четвертая валентность углерода сохраняется, в молекуле возникает π-связь. В структурной формуле особенность строения находит отражение. Но символы для обозначения разных типов связи на схемах обычно используются одинаковые — черточки или точки. Строение этилена определяет его активное взаимодействие с веществами разных классов. Присоединение воды и других частиц происходит благодаря разрыву непрочной π-связи. Освободившиеся валентности насыщаются за счет электронов кислорода, водорода, галогенов.
Этилен: физические свойства вещества
Этен при обычных условиях (нормальном атмосферном давлении и температуре 18°C) — бесцветный газ. Он обладает сладким (эфирным) запахом, его вдыхание оказывает наркотическое действие на человека. Затвердевает при –169,5°C, плавится при таких же температурных условиях. Кипит этен при –103,8°C. Воспламеняется при нагревании до 540°C. Газ хорошо горит, пламя светящееся, со слабой копотью. Этилен растворяется в эфире и ацетоне, значительно меньше — в воде и спирте. Округленная молярная масса вещества — 28 г/моль. Третий и четвертый представители гомологического ряда этена — тоже газообразные вещества. Физические свойства пятого и следующих алкенов отличаются, они являются жидкостями и твердыми телами.
Получение и свойства этилена
Немецкий химик Иоган Бехер случайно использовал этиловый спирт в опытах с концентрированной серной кислотой. Так впервые был получен этен в лабораторных условиях (1680 год). В середине XIX века А.М. Бутлеров дал соединению название этилен. Физические свойства и химические реакции также были описаны известным русским химиком. Бутлеров предложил структурную формулу, отражающую строение вещества. Способы его получения в лаборатории:
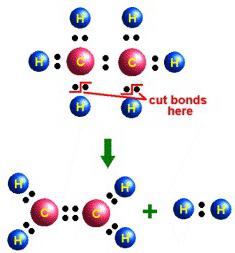
- Каталитическое гидрирование ацетилена.
- Дегидрогалогенирование хлорэтана в реакции с концентрированным спиртовым раствором сильного основания (щелочи) при нагревании.
- Отщепление воды от молекул этилового спирта (дегидратация). Проходит реакция в присутствии серной кислоты. Ее уравнение: Н2С–СН2–OH → Н2С=СН2 + Н2О
Промышленное получение:
- переработка нефти — крекинг и пиролиз углеводородного сырья;
- дегидрирование этана в присутствии катализатора. H3C–CH3 → H2C=CH2 + H2
Строение этилена объясняет его типичные химические реакции — присоединение частиц атомами C, которые находятся при кратной связи:
- Галогенирование и гидрогалогенирование. Продуктами этих реакций являются галогенопроизводные.
- Гидрирование (насыщение водородом), получение этана.
- Окисление до двухатомного спирта этиленгликоля. Его формула: OH–H2C–CH2–OH.
- Полимеризация по схеме: n(H2C=CH2) → n(-H2C–CH2-).
Области применения этилена
При фракционной перегонке нефти в больших объемах получают этилен. Физические свойства, строение, химическая природа вещества позволяют использовать его в производстве этилового спирта, галогенопроизводных, спиртов, оксида, уксусной кислоты и других соединений. Этен — мономер полиэтилена, а также исходное соединение для полистирола.
Дихлорэтан, который получают из этена и хлора, является хорошим растворителем, используется в производстве поливинилхлорида (ПВХ). Из полиэтилена низкого и высокого давления изготавливают пленку, трубы, посуду, из полистирола — футляры для CD-дисков и другие детали. ПВХ — это основа линолеума, непромокаемых плащей. В сельском хозяйстве этеном обрабатываются плоды перед уборкой урожая для ускорения созревания.
Источник
АЛКЕНЫ
Углеводородами ряда этилена, или
этиленовыми углеводородами (олефинами
или алкенами) называют ненасыщенные углеводороды, строение которых отличается наличием в их молекулах одной
двойной связи между углеродными атомами, т.е. – группировки
>C=C<.
Этиленовые углеводороды образуют
гомологический ряд, состав каждого члена которого выражается общей эмпирической
формулой CnH2n.
Родоначальником этого ряда является углеводород этилен состава С2Н4,
строение которого может быть представлено следующей структурной и упрощенной
структурной формулами:

Гомологический
рядалкенов
СnH2n алкен | Названия, |
C2Н4 | этен, этилен |
C3H6 | пропен |
C4H8 | бутен |
C5H10 | пентен |
C6H12 | гексен |
Тренажёр – Гомологический ряд этилена
Физические
свойства
С2 – С4 (газы)
С5 – С18 (жидкости)
С19 … – (твёрдые)
- Алкены не
растворяются в воде, растворимы в органических растворителях (бензин,
бензол и др.) - Легче воды
- С увеличением Mr температуры плавления и кипения
увеличиваются - ЭТИЛЕН – в природе этилен
практически не встречается. Это бесцветный горючий газ со слабым запахом.
Химические
свойства
В отличие от насыщенных углеводородов
для углеводородов ряда этилена характерны разнообразные реакции присоединения по месту двойной связи; при этом они
значительно легче вступают во взаимодействие с различными реагентами.

Благодаря двойной связи
молекулы алкенов могут соединяться между собой, т.е. полимеризоваться.
Как и предельные
углеводороды, алкены горят на воздухе:
C2H4 + 3O2 t→ 2CO2 + 2H2O + Q (пламя
ярко светящее)
Применение
Этилен является
одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек
синтеза. Основное направление использования этилена — в качестве мономера
при получении полиэтилена

Этилен – исходное соединение для получения полиэтилена
высокого и низкого давления и олигомеров этилена, являющихся основой ряда
синтетических смазочных масел.

Этилен применяют
как исходный материал для производства ацетальдегида и синтетического
этилового спирта. Также он используется для синтеза этилацетата, стирола,
винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого
этила.

Этилен
используют для ускорения созревания плодов — например, помидоров, дынь,
апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения
предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к
материнским растениям, что облегчает механизированную уборку урожая.

АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ
(АЛКИНЫ)
Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные)
углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2.
Родоначальником гомологического ряда этих углеводородов является ацетилен H-C≡C-H.
Алкины – это
непредельные углеводороды с одной тройной углерод-углеродной связью в цепи и
общей формулой СnH2n-2
Физические
свойства
С2Н2 – газ без
цвета и почти без запаха, технический ацетилен обладает неприятным запахом,
легче воздуха, мало растворим в воде
Свойства гомологов изменяются аналогично
алкенам.
Получение в лаборатории: из карбида
кальция гидролизом (взаимодействие с водой)
CaC2 + 2H2O →
Ca(OH)2 + H-C≡C-H
Получение в промышленности:термическим разложением метана (пиролиз)
2CH4 1500˚С→ HC≡CH + 3H2
Применение
Из всех ацетиленовых углеводородов
серьёзное промышленное значение имеет только ацетилен, который является
важнейшим химическим сырьём. При горении ацетилена выделяется много
тепла, что используется для резки и сварки металлов в ацетилен-кислородной
сварке (расходуется до 30 % всего производимого ацетилена).
В конце 19-го — начале 20-го века
широкой популярностью пользовались многочисленные ацетиленовые светильники
(источником ацетилена служил дешевый карбид кальция), используемые на
железнодорожном и водном транспорте, для освещения улиц, в быту. Несмотря на
то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их
выпуск и потребление не прекратились. Они производятся в небольших количествах
как походное снаряжение
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКАДИЕНЫ)
Диеновые углеводороды или алкадиены – это
непредельные углеводороды, содержащие две двойные углерод – углеродные связи.
Общая формула алкадиенов CnH2n-2.Наибольший интерес представляют
углеводороды с сопряженными двойными связями, их используют для производства
синтетических каучуков.
Бутадиен -1,3 – легко сжижающийся газ, с неприятным
запахом

Изопрен – легкокипящая жидкость

Наиболее массовое применение
каучуков — это производство резин для автомобильных, авиационных и
велосипедных шин.
Из каучуков изготавливаются специальные
резины огромного разнообразия уплотнений для целей тепло- звуко- воздухо-
гидроизоляции разъёмных элементов зданий, в санитарной и вентиляционной
технике, в гидравлической, пневматической и вакуумной технике.


Каучуки применяют для электроизоляции,
производства медицинских приборов.
ЦИКЛОАЛКАНЫ
(ЦИКЛОПАРАФИНЫ)
В отличие от предельных углеводородов,
характеризующихся наличием открытых углеродных цепей, существуют углеводороды с
замкнутыми цепями (циклами). По своим свойствам они напоминают обычные
предельные углеводороды алканы (парафины), отсюда и произошло их название –
циклоалканы (циклопарафины). Общая формула гомологического ряда циклоалканов CnH2n,
то есть циклоалканы изомерны этиленовым углеводородам. В природе встречаются в
составе нефти.
Представителями этого ряда соединений
являются циклопропан, циклопентан, циклогексан.
Наибольшее практическое значение имеют
циклогексан, этилциклогексан. Циклогексан используется в химическом синтезе, а
также в качестве растворителя. Циклопропан используется в медицинской практике
в качестве ингаляционного анестезирующего средства.
АРОМАТИЧЕСКИЕ
УГЛЕВОДОРОДЫ (АРЕНЫ)
Типичными представителями ароматических
углеводородов являются производные бензола, т.е. такие карбоциклические
соединения, в молекулах которых имеется особая циклическая группировка из шести
атомов углерода, называемая бензольным или ароматическим ядром.
Общая формула ароматических
углеводородов CnH2n-6.
·
С6H6 – бензол, родоначальник гомологического ряда
аренов

·
С6H5 – CH3– толуол (метилбензол)

·
С6H5 – CH=СH2 – стирол (винилбензол)
Физические
свойства:
1. Бензол – легкокипящая (tкип = 80,1°С), бесцветная жидкость, не
растворяется в воде
2. Внимание! Бензол – яд, действует на
почки, изменяет формулу крови (при длительном воздействии), может нарушать
структуру хромосом.
3. Большинство
ароматических углеводородов опасны для жизни, токсичны.
Применение
Ароматические
углеводороды являются важным сырьем для производства различных синтетических
материалов, красителей, физиологически активных веществ. Так, бензол – продукт
для получения красителей, медикаментов, средств защиты растений и др. Толуол
используется как сырье в производстве взрывчатых веществ, фармацевтических
препаратов, а также в качестве растворителя. Винилбензол (стирол) применяется
для получения полимерного материала – полистирола.
Применение УГЛЕВОДОРОДОВ
Природные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха от загрязнения
Источник
В природе этот газ практически не встречается: он образуется в незначительных количествах в тканях растений и животных как промежуточный продукт обмена веществ. Попутно это — самое производимое органическое соединение в мире. Газ этилен служит сырьем для получения полиэтилена.
Свойства этилена
Этилен (другое название — этен) — химическое соединение, описываемое формулой С2H4. В природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен является простейшим алкеном (олефином). Содержит двойную связь и поэтому относится к ненасыщенным соединениям. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном.
Сырье для полиэтилена и не только
Этилен — самое производимое органическое соединение в мире; общее мировое производство этилена в 2005 году составило 107 миллионов тонн и продолжает расти на 4–6% в год. Источником промышленного получения этилена является пиролиз различного углеводородного сырья, например, этана, пропана, бутана, содержащихся в попутных газах нефтедобычи; из жидких углеводородов — низкооктановые фракции прямой перегонки нефти. Выход этилена – около 30%. Одновременно образуется пропилен и ряд жидких продуктов (в том числе ароматических углеводородов).
При хлорировании этилена получается 1,2-дихлорэтан, гидратация приводит к этиловому спирту, взаимодействие с HCl – к этилхлориду. При окислении этилена кислородом воздуха в присутствии катализатора образуется окись этилена. При жидкофазном каталитическом окислении кислородом получается ацетальдегид, в тех же условиях в присутствии уксусной кислоты – винилацетат. Этилен является алкилирующим агентом , например, в условиях реакции Фриделя-Крафтса способен алкилировать бензол и другие ароматические соединения. Этилен способен полимеризоваться в присутствии катализаторов как самостоятельно, так и выступать в роли сомономера, образуя обширный ряд полимеров с различными свойствами.
Применение
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена (наиболее крупнотоннажный полимер в мировом производстве). В зависимости от условий полимеризации получают полиэтилены низкого давления и полиэтилены высокого давления.
Также полиэтилен применяют для производства ряда сополимеров, в том числе с пропиленом, стиролом, винилацетатом и другими. Этилен является сырьем для производства окиси этилена; как алкилирующий агент – при производстве этилбензола, диэтилбензола, триэтилбензола.
Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта. Также он используется для синтеза этилацетата, стирола, винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого этила.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
В высоких концентрациях этилен оказывает на человека и животных наркотическое действие.
Источник
