Какими физическими свойствами должны обладать белки эластины
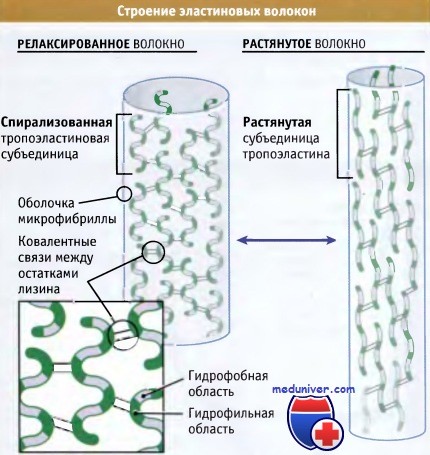
Строение и функции эластина (эластиновых волокон)• Основная функция эластина состоит в обеспечении эластических свойств тканей • Мономеры эластина (известные как тропоэластиновые субъединицы) организованы в волокна, настолько прочные и устойчивые, что функционируют в течение всей жизни организмов • Прочность этих волокон обусловлена образованием ковалентных сшивок между боковыми цепями лизина, находящегося в соседних мономерах эластина • Эластичность волокон связана с наличием гидрофобных областей, которые при приложении силы растягиваются, а при снятии нагрузки спонтанно сокращаются • Сборка волокон тропоэластина происходит во внеклеточном пространстве и находится под контролем трехступенчатого процесса • Мутации в гене эластина являются причиной развития разнообразных патологических состояний, начиная от образования морщин на коже и заканчивая ранней детской смертностью Как следует из названия, эластин представляет собой белок внеклеточного матрикса, главным образом, обеспечивающий эластические свойства тканей. Благодаря эластину, ткань может растягиваться и возвращаться к исходному размеру, дополнительно не расходуя энергию. Эластина особенного много в таких тканях, как кровеносные сосуды, кожа и легкие, где эластичность является критическим фактором, обеспечивающим правильное функционирование органа. Например, эластичность кровеносных сосудов играет важную роль в поддержании надлежащего уровня кровяного давления, а эластичность легких с каждым вдохом обеспечивает их заполнение воздухом и последующее опорожнение.
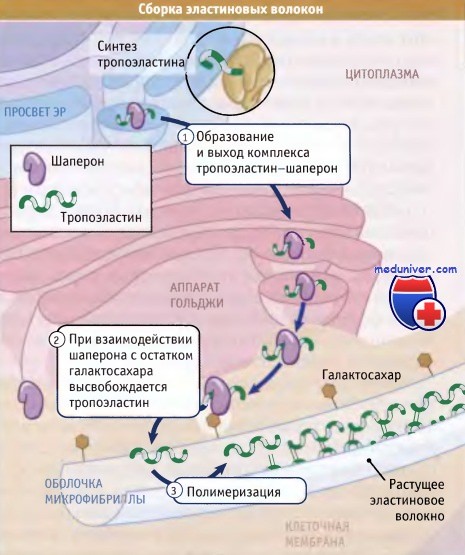
Эластин синтезируется и секретируется фибробластами, представляющими собой один из наиболее распространенных типов клеток у животных, а также клетками гладкой мускулатуры. Эти клетки также секретируют коллагены, которые противостоят растяжению. В результате внеклеточный матрикс каждого органа характеризуется комбинацией свойств эластичности и прочности. Изменяя соотношение эластина и коллагена во внеклеточном матриксе, клетки могут регулировать эластические свойства органов. Как следует из рисунка ниже, эластин организован в волокна, которые состоят из основной области эластиновых белков, окруженной оболочкой микрофибриллярных белков диаметром 10-12 нм. Основным компонентом этой оболочки является гликопротеин, связанный с микрофибриллами, который ассоциирован с мономером эластина и способствует его включению в более крупные эластиновые волокна. Эти волокна настолько прочны и стабильны, что функционируют на протяжении всей жизни организмов (т. е. не деградируя и не замещаясь). Присутствующий в этих волокнах эластин является наименее растворимым белком позвоночных. Каким образом, эластин, обладая высокой прочностью и стабильностью, тем не менее, проявляет высокую эластичность? Ответ лежит в особенностях его структуры. Ген эластина содержит 36 экзонов, которые кодируют две совершенно разных последовательности аминокислот: некоторые из них проявляют гидрофильные свойства и содержат много остатков лизина, в то время, как другие обогащены гидрофобными аминокислотами, особенно глицином, пролином, аланином и валином. Гидрофобные последовательности вкраплены среди гидрофильных областей, что обусловливает существование большого по размеру белка, обладающего двумя различными свойствами. Прочность эластиновых волокон, в основном определяется ковалентными связями, возникающими между боковыми цепями лизина в примыкающих друг к другу белках, подобно тому как это имеет место в коллагене. Наоборот, гидрофобные области обеспечивают эластичность за счет сворачивания молекулы в спираль в нерастянутом состоянии, и ее растяжения при приложении силы. При снятии напряжения эти области снова спонтанно сворачиваются. Даже после многолетних исследований биологи не пришли к заключению о точной конформации эластиновых белков в волокнах. Сборка таких нерастворимых белков ставит перед клеткой особые проблемы. Если эти белки, до момента их секреции из клетки, спонтанно агрегируют, они могут повлиять на секрецию других белков, «закупоривая» секреторные пути, а также вызывать разрыв органелл или плазматической мембраны. Клетки синтезируют и секретируют эластиновые белки в виде мономеров, однако собирают волокна только во внеклеточном пространстве, после того как белки вышли из клетки, не нарушив ее внутреннюю среду. Как иллюстрирует рисунок ниже, образование эластина включает три основных этапа: • Вскоре после образования эластиновых мономеров (известных под названием тропоэластина) они связываются в ЭПР с белком-шапероном мол. массы 67 кДа. В течение всего процесса секреции этот шаперон остается связанным с тропоэластином и предотвращает агрегацию эластина в клетке. • После завершения секреции комплекс с помощью шаперона удерживается на поверхности клетки до тех пор, пока он не вступит в контакт с оболочкой эластинового волокна. После этого вновь секрети-рованный тропоэластин встраивается в эластиновое волокно с участием сахарных компонентов его оболочки, которые замещают шапероны. • Большая часть боковых цепей лизина, присутствующего в мономере тропоэластина, дезаминируется при действии фермента лизилоксидазы. При этом образуются аллизины, которые ковалентно связываются с аллизинами или немодифицированными лизинами, присутствующими в других эластиновых белках волокна. Название зрелый эластин используют для обозначения эластиновых белков, которые были модифицированы лизилоксидазой и образовали полимер. Таким образом, трехэтапный метод обеспечивает полную сборку эластина только в тех местах клетки, где это является необходимым. Как можно ожидать, изменения, наступающие в процессе сборки или функционировании эластина и эластиновых волокон, могут иметь серьезные последствия для клетки. Дряблость кожи, заболевание, которое выражается в утрате эластиновых волокон в коже и соединительной ткани, по тяжести проявления может варьировать от незначительного разрушения волокон и возникновения морщин до практически полной утраты волокон. У больных, в клетках которых мало эластиновых волокон или они вообще отсутствуют, не поддерживается целостность тканей, и они умирают в раннем детстве. У больных с синдромом Вильямса образуются укороченные формы эластина, в которых отсутствуют некоторые домены связывания, и нарушен процесс организации в волокна. У этих больных развивается сильное сужение крупных артерий, по-видимому, обусловленное аномальным ростом вокруг артерий клеток гладкой мускулатуры. Это служит компенсаторной реакцией в ответ на утрату эластиновых волокон, обычно присутствующих в стенке артерий.
– Также рекомендуем “Строение и функции ламининов” Оглавление темы “Цитология”:
|
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 июля 2019;
проверки требуют 6 правок.
Эласти́н — белок соединительной ткани, обладающий эластичностью.
Состав[править | править код]
Эластин, выделенный из стенки аорты коровы
Эластин является фибриллярным белком с молекулярной массой около 68 кДа[1]. Эластин содержит около 27 % глицина, 19 % аланина, 10 % валина, 4,7 % лейцина. Наличие большого количества гидрофобных радикалов препятствует созданию стабильной глобулы, в результате полипептидные цепи эластина не формируют регулярные вторичную и третичную структуры[2].
Синтез[править | править код]
Эластин у млекопитающих кодируется геном ELN[1][3] и синтезируется фибробластами. Синтез эластина начинается в фибробластах с образования предшественника эластина — белка тропоэластина. Тропоэластин – растворимый мономер, гидрофильные участки которого обогащены остатками лизина. В межклеточном матриксе при участии медьзависимой лизилоксидазы остатки лизина окисляются до аллизина, которые формируют поперечные сшивки, стабилизирующие молекулу эластина. В результате других посттрансляционных модификаций остатков лизина в составе молекул эластина также появляются нетипичные аминокислоты десмозин и изодесмозин, способные входить в состав нескольких пептидных цепей одновременно. За счет этого эластиновые нити объединяются в сетку прочными ковалентными связями[2].
Расщепление[править | править код]
Для эластина характерны нерастворимость, высокая стабильность и низкая скорость метаболизма. Большинство протеиназ неспособны расщеплять эластин. В расщеплении эластина при перестройках соединительной ткани участвует эластаза полиморфноядерных лейкоцитов, эндопептидаза, которая преимущественно расщепляет связи, образованные карбоксильными группами алифатических аминокислот. Она активна в слабощелочной среде (рН 7,5-8,5) и гидролизует во внеклеточном пространстве не только эластин, но и другие белки — протеогликаны, гемоглобин, коллаген, иммуноглобулины. Активность эластазы ингибирует белок α1-антитрипсин (α1-АТ). Наибольшее количество α1-АТ синтезируется печенью и находится в крови. В тканях α1-АТ синтезируется макрофагами.[2]
При переваривании мясной пищи эластин гидролизуется ферментом поджелудочной железы панкреатической эластазой.
Функции в организме[править | править код]
Эластин наряду с коллагеном и некоторыми другими фибриллярными белками находится в межклеточном веществе (матриксе) соединительной ткани, формируя трехмерную сеть белковых волокон. Эта сеть не только важна для механической прочности ткани, но также обеспечивает контакты между клетками, формирует пути миграции клеток, вдоль которых они могут перемещаться (например, при эмбриональном развитии), изолирует разные клетки и ткани друг от друга (например, обеспечивает скольжение в суставах)[4].
Эластин выполняет важные функции в органах, подверженных постоянному растяжению и сжатию, например, в артериях, легких, коже, сухожилиях, различных сфинктерах[5]. Эластиновые и коллагеновые волокна помогают органам восстанавливать исходные размеры после растяжения, например, при защемлении кожи или после опустошения мочевого пузыря[6].
При снижении образования десмозинов (или их отсутствии) поперечные сшивки между волокнами эластина образуются в недостаточном количестве или не образуются вообще. Вследствие этого у эластических тканей снижается предел прочности на разрыв и появляются такие нарушения, как истончённость, вялость, растяжимость, то есть утрачиваются их резиноподобные свойства. Клинически такие нарушения могут проявляться кардиоваскулярными изменениями (аневризмы и разрывы аорты, дефекты клапанов сердца), частыми пневмониями и эмфиземой лёгких[7]. При нарушении синтеза эластина в организме в результате мутации гена ELN развивается наследственное заболевание артерий — суправульвулярный аортальный стеноз (supravalvular aortic stenosis, SVAS)[3].
Примечания[править | править код]
- ↑ 1 2 Эластин человека в базе данных по белкам Uniprot
- ↑ 1 2 3 Биохимия тканей и жидкостей полостей рта: учебное пособие / Вавилова Т. П. — 2-е изд., испр. и доп. — 2008. — 208 с. : ил.
- ↑ 1 2 Curran, Mark E.; Atkinson, Donald L.; Ewart, Amanda K.; Morris, Colleen A.; Leppert, Mark F.; Keating, Mark T. The elastin gene is disrupted by a translocation associated with supravalvular aortic stenosis (англ.) // Cell : journal. — Cell Press (англ.)русск., 1993. — 9 April (vol. 73, no. 1). — P. 159—168. — doi:10.1016/0092-8674(93)90168-P.
- ↑ Я.Кольман, К.-Г. Рём. Наглядная биохимия
- ↑ Урология : учебник / Б. К. Комяков. — 2012. — 464 с.: ил.
- ↑ Многофотонная микроскопия в изучении морфологических особенностей радиационно-индуцированных повреждений мочевого пузыря. С. С. Кузнецов, В. В. Дуденкова, М. В. Кочуева, Е. Б. Киселева, Н. Ю. Игнатьева, О. Л. Захаркина, Е. А. Сергеева, К. В. Бабак, А. В. Масленникова. Современные технологии в медицине, 2016, том 8, номер 2, стр. 31-39.
- ↑ Биохимия: Учеб. для вузов, Под ред. Е.С. Северина., 2003. 779 с. ISBN 5-9231-0254-4 (недоступная ссылка). Дата обращения 27 августа 2016. Архивировано 4 сентября 2016 года.
Источник
Для того, чтобы сохранять красоту и молодость, нужно знать про эластин – что это такое, в чем содержится, из чего состоит и какие функции выполняет в организме человека. Кожа состоит из множества слоев и клеток. С возрастом клетки перестают слаженно работать, им становится сложнее сопротивляться возрастным изменениям и защищаться от внешних негативных факторов. Причина в замедлении клеточного метаболизма и снижении выработки эластина. Если не озаботиться восполнением запасов эластина, то внутренние перемены станут заметными внешне.
Недостаток эластина приводит к снижению тонуса кожи, от этого образуются морщины. Этот белок присутствует не только в коже, но и во всех соединительных тканях – связках, стенках сосудов кровеносной системы, легких. Он может сильно растягиваться, а затем возвращаться в прежнюю форму без признаков растяжения. Необычные свойства объясняются тем, из чего состоит эластин, в составе данного соединения присутствуют особые аминокислоты неполярного типа. Они регулируют производство кожного жира.
Кожа на лице ежедневно выдерживает высокие нагрузки, мимическая мускулатура под ней постоянно двигается. Кожа растягивается и вновь сжимается, когда мы улыбаемся и хмуримся, она подвергается воздействию даже при непроизвольных движениях во сне. При снижении тонуса мимические испытания перестают проходить бесследно, смех отпечатывается в гусиных лапках вокруг глаз, угрюмое настроение – в складках на лбу.
Над поддержанием упругости работает не только эластин, но и коллаген. Он тоже поддерживает эластичность эпидермиса и противостоит образованию морщин. Считается, что эластин и коллаген – это важнейшие слагаемые для сохранения красоты и продления молодости человека, но их резервы не бесконечны. Истощению ресурса способствует не только возраст, но и солнечный ультрафиолет, другие негативные факторы из окружающей среды. Для поддержания эластиновых волокон нужно знать, что стимулирует выработку коллагена и эластина, какое питание соответствует данной цели. Восполнить запасы помогут не только продукты питания, но и косметические средства.
Например, составы на основе гидролизата белка превосходно выполняют антивозрастную функцию.
Почему это настолько важно?
Белки не только обеспечивают растяжение и сжатие кожи без заметных последствий, их функции намного обширнее:
- создание незаметного для глаз пептидного слоя для защиты кожи от обезвоживания. Этот барьер не позволяет терять воду, чтобы кожа дольше оставалась подтянутой;
- поддержание функционирования липидного барьера, он выполняет защитные функции, а также поддерживает тургор;
- регуляция производства кожного жира, если его будет слишком много, то появится жирный блеск, если недостаточно – возникает сухость;
- заживление порезов, ожогов, ссадин и любых других повреждений целостности кожного покрова, это строительные материалы для восстановления;
- противодействие старению и увяданию всех слоев.
Выходит, роль эластина не ограничивается профилактикой и замедлением старения, он нужен поддержания водного баланса. Поэтому он обязательно должен присутствовать в косметике для увлажнения независимо от возраста, на который она рассчитана. Если в средстве содержатся эластин и коллаген, оно точно поможет восстановить водный баланс.
Разновидности
Эластин может быть натуральным или искусственным. Натуральный вырабатывается в организме человека и животных, его функции изложены выше. В косметической промышленности распространен искусственный, он обладает аналогичными свойствами, но вырабатывается в лабораторной среде вне живого организма. Белок искусственного происхождения способен создать пептидную пленку на поверхности кожи, но он не проникнет в глубокие слои.
Для разрешения вопроса доставки белка в глубокие слои был создан третий вид – гидролизованный. Его получают при гидролизе белков, в результате готовый продукт легко распадается на аминокислоты и преодолевает эпидермальный барьер. Подход считается инновационным, он работает лучше, чем искусственные волокна. Аминокислоты попадают в глубокие слои и поддерживают имеющиеся в них натуральные волокна. Но при этом они не будут стимулировать производство собственного белка, это сложная задача для косметологии. Для того, чтобы активировать собственный синтез, нужно принимать белки в виде добавок, средства часто содержат дополнительные компоненты – растительные жиры, экстракты растений.
Как восполнить недостаток?
Плазмолифтинг
Зная, что это за материал и к чему приводит недостаток, хочется исправить ситуацию. Кремы для домашнего использования лишь создают барьер на поверхности, но не проникают глубоко. Стимулировать производство собственных эластина и коллагена поможет плазмолифтинг. Так в косметологии называют процедуру с использованием собственной крови.
В ходе процедуры у пациента берут кровь для извлечения из нее плазмы. В этой субстанции много тромбоцитов, ее подкожное введение в проблемные зоны оказывает прямое воздействие на производство собственных белков. При регулярном применении курсов плазмолифтинга способность кожного покрова к регенерации возрастает, усиливается питание, ускоряются обменные процессы в глубоких слоях.
Филлеры
Также косметология предлагает филлеры – специальные составы для инъекционного введения, они заполняют морщины, устраняют провисания. Состав филлеров часто включают белки животного происхождения, которые при таком использовании могут спровоцировать аллергические реакции. Если не возникнет аллергии, то положительный результат будет заметным сразу. К сожалению, это временное решение, эффект от филлеров будет эстетическим и продлится до нескольких месяцев.
Косметика
Кремы и прочие средства не повлияют на производство собственных коллагена и эластина, так как в их составе совсем другие аминокислоты и цепочки пептидов. При этом они оберегают кожу от обезвоживания, что тоже очень важно. Выбирай продукты, в которых содержится гидролизованный вид протеинов, форма выпуска не имеет значения.
Прием добавок
Для взаимного усиления эффекта прием добавок лучше сочетать с косметологическими процедурами. Добавки, нацеленные на укрепление собственных коллагеновых волокон, следует принимать не менее месяца, точная продолжительность курса указывается в инструкции к препарату. Такие добавки не считаются лекарственными средствами, но у них есть противопоказания. Перед приемом нужно внимательно изучить состав, при наличии проблем со здоровьем – проконсультироваться со специалистом.
О питании
Первое, что способствует достаточной выработке белков, это питание. При недостатке в рационе питательных веществ косметические продукты и процедуры не помогут сохранить молодость и красоту. Запомни список, в каких продуктах содержится коллаген и эластин, и съедай хотя бы по одному из них каждый день.
- Рыбий жир – можно получить из скумбрии, сельди, лосося и других рыб жирных пород. Если по каким-то причинам ты не можешь есть рыбу, то обязательно дополни рацион рыбьим жиром в виде добавок. Присутствующие в нем омега-3 кислоты не только омолодят увядающую кожу, но и оздоровят проблемную.
- Цельные молочные продукты и яичный желток. Обезжиренные виды не подойдут, для кожи, волос и ногтей важны именно цельные жиры.
- Растительные масла – будут полезны не только при употреблении внутрь, но и в качестве масок для лица. Большое количество ценных растительных жиров содержится в орехах.
- Фрукты и ягоды, особенно рябина, черная смородина, черника, облепиха. Для стимуляции естественных процессов нужны витамины и антиоксиданты.
- Овощи, особенно красный болгарский перец, помидоры и капуста брокколи, зелень, особенно шпинат и петрушка. В них тоже содержится множество ценных элементов.
Чем раньше придет понимание того, что эластин – это молодость и красота, тем больше шансов отложить возрастные изменения. Используя силу натуральных жиров из питания, косметических продуктов и косметологических процедур, можно решить проблему обезвоживания и снижение тонуса кожи.
Источник