Каким в указанных ответах свойством не обладает метан

1. Простейший по составу предельный углеводород, бесцветный газ (в нормальных условиях) без запаха:
а) метан +
б) пропан
в) бутан
2. Метан в воде:
а) растворим полностью
б) малорастворим +
в) не растворим
3. Метан:
а) не встречается в воздухе
б) тяжелее воздуха
в) легче воздуха +
4. Имеются данные, что метан относится к токсическим веществам, действующим на:
а) центральную нервную систему +
б) мозг
в) сердце
5. Накапливаясь в закрытом помещении, метан становится:
а) тяжелее воздуха помещения
б) токсичен
в) взрывоопасен +
6. Взрывоопасен при концентрации в воздухе от 4,4 % до:
а) 27 %
б) 17 % +
в) 7 %
7. Наиболее взрывоопасная концентрация:
а) 10,5 %
б) 14,5 %
в) 9,5 % +
8. Метан – такой по значимости (4 – 9 %) парниковый газ в атмосфере Земли:
а) третий +
б) первый
в) второй
9. В ноябре этого года итальянский физик Алессандро Вольта обнаружил метан в болотах озера Лаго-Маджоре на границе Италии и Швейцарии:
а) 1806
б) 1876
в) 1776 +
10. Современное название «метан» в этом году газу дал немецкий химик Август Вильгельм фон Гофман:
а) 1800
б) 1866 +
в) 1766
11. Большие запасы метана сосредоточены в … на дне морей и в зоне вечной мерзлоты
а) метаногидратах +
б) гидратах
в) метаногидрантах
12. В промышленности образуется при:
а) расщиплении углеводородов
б) коксовании каменного угля +
в) гидрировании углеродов
13. В промышленности образуется при:
а) гидрировании угля +
б) гидрировании углеродов
в) гидрировании марганца
14. В промышленности образуется при:
а) расщиплении углеводородов
б) генолизе углеводородов
в) гидрогенолизе углеводородов +
15. В промышленности образуется в:
а) реакциях каталитического риформинга +
б) реакциях ионолитического риформинга
в) реакциях катионалитического риформинга
16. Образован в результате химических реакций неорганических соединений, например, при взаимодействии карбидов металлов с водой:
а) термогенный
б) абиогенный +
в) биогенный
17. Образован как результат химических превращений органических веществ:
а) бактериальный
б) абиогенный
в) биогенный +
18. Образован в результате жизнедеятельности бактерий (микроорганизмов):
а) биогенный
б) бактериальный (микробный) +
в) абиогенный
19. Образован в ходе термохимических процессов:
а) абиогенный
б) абиогенный
в) термогенный +
20. В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и кальция) или безводного гидроксида натрия с:
а) ледяной соляной кислотой
б) ледяной уксусной кислотой +
в) ледяной серной кислотой
21. Возможно получение метана сплавлением ацетата натрия с:
а) гидроксидом натрия +
б) гидроксидом фтора
в) гидроксидом магния
22. Метан – такой член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям:
а) второй
б) первый +
в) третий
23. Подобно другим алканам вступает в такие реакции:
а) голагенирования
б) галореагирования
в) галогенирования +
24. Подобно другим алканам вступает в такие реакции:
а) сульфтолорирования
б) сульфохлорирования +
в) сульфобромирования
25. Подобно другим алканам вступает в такие реакции:
а) нитраторирования
б) натрования
в) нитрования +
26. Горит в воздухе таким пламенем:
а) зеленоватым
б) голубоватым +
в) красноватым
27. Вступает с галогенами в реакции:
а) замещения +
б) расщепления
в) окисления
28. Метан является самым физиологически безвредным газом в гомологическом ряду таких углеводородов:
а) ненасыщенных
б) карбоциклических
в) парафиновых +
29. Метан является таким газом:
а) парниковым +
б) углекислым
в) натуральным
30. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность того же молярного объёма метана составит:
а) 1-5 единиц
б) 21-25 единиц +
в) 11-15 единиц
Источник
Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
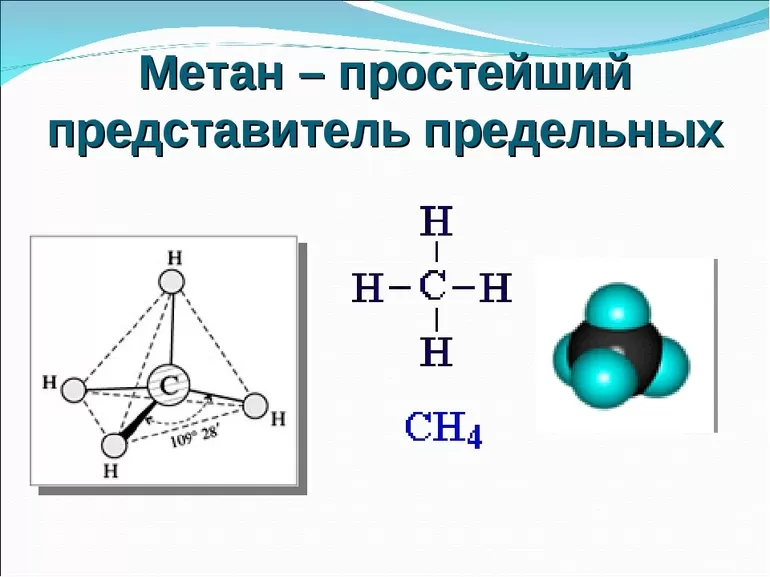
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp3:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:

Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода

Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
CH4 + HNO3 = CH3NO2 + H2O
2. Реакции разложения метана (дегидрирование, пиролиз)
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
3. Окисление метана
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя.
2. Водный или кислотный гидролиз карбида алюминия
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Al4C3 + 12HCl = 4AlCl3 + 3CH4
Этот способ получения используется в лаборатории для получения метана.
3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:
4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (3n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
Синтезом Фишера-Тропша можно получить метан:
CO + 4H2 = CH4 + 2H2O
5. Получение метана в промышленности
В промышленности метан получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Источник
9 интересных фактов о метане и природном газе.
Каждый из нас, знаком с таким веществом как метан, из школьного курса органической химии. Даже если вы не учились в 10 классе, где начинается органика, вы можете помнить о метане из 9 класса, где он озвучивается, как летучее водородное соединение углерода.
Если кто-то забыл основы, напоминаю. Метан (CH4) – это простейший представитель гомологического ряда алканов, которые в свою очередь являются предельными углеводородами с общей формулой CnH2n+2.
В больших количествах, метан содержится в природном газе.
Природный газ – это смесь газообразных углеводородов, с небольшой молекулярной массой. В зависимости от месторождения, его состав может сильно варьироваться, но несмотря на это, метан является основным его компонентом. Как правило, доля метана в нем составляет от 75 до 99% по объёму.
Как природный газ, так и метан в частности являются важнейшим видом топлива и сырья для химической промышленности. Это связано с рядом преимуществ:
- Во первых, это самый дешёвый вид топлива.
- Он легко транспортируется по газопроводам.
- Является экологически более чистым видом топлива чем другие.
- Обладает высокой теплотворной способностью.
Перечислим и наиболее популярные области применения метана отдельно:
- Наиболее широко он используется как топливо для печей, котлов, автомобилей и т.д.
- Жидкий метан, в сочетание с жидким кислородом используется в качестве ракетного топлива.
- В некоторых странах метан применяется при производстве электроэнергии.
- Во многих городах он до сих пор подается в дома для отопления и приготовления пищи.
Насколько полезны метан и природный газ, я думаю, все уже поняли.
Ну а теперь, как и было обещано, интересные факты о метане и природном газе, которых вы возможно могли и не знать:
1. Впервые метан обнаружил физик Алессандро Вольта в 1776 году в болотах озера Лаго-Маджоре на границе Италии и Швейцарии. На изучение метана его вдохновила статья Бенджамина Франклина о «горючем воздухе». Вольта собирал газ, выделяемый со дна болота, и в 1778 году выделил чистый метан. В связи с тем, что впервые метан был обнаружен в болотной местности, он получил свое тривиальное название – «болотный газ».
Алессандро Вольта.
2. Метан является парниковым газом, более сильным в этом отношение, чем углекислый газ.
Парниковые газы — это газы с высокой степенью прозрачности, присутствие которых в атмосфере планеты приводит к парниковому эффекту. Основными парниковыми газами Земли являются водяной пар, углекислый газ, метан и озон.
3. Согласно расчетам ученых, под толщей льда Антарктиды находится несколько миллиардов тонн метана. Колоссальные запасы были созданы на большой глубине микроорганизмами, которые питаются остатками древних деревьев. Если вдруг такое количество метана прорвется через разломы во льду и попадет в атмосферу, это грозит катастрофическими изменениями климата.
9 интересных фактов о метане и природном газе.
4. Вода в трубопроводе может замерзнуть при температуре + 20 градусов Цельсия, если в этой воде присутствует достаточное количество метана. Молекулы метана «расталкивают» молекулы воды, так как занимают больший объём. Это приводит к понижению внутреннего давления воды и повышению температуры замерзания.
5. В Венесуэле в месте впадения реки Кататумбо в озеро Маракайбо по ночам можно почти непрерывно наблюдать каскады молний. Феномен случается приблизительно 150 раз в году, а каждый «сеанс» длится до 10 часов с периодичностью до 280 молний в час и не сопровождается никакими звуками. Явление объясняется приходящими с Анд ветрами, которые вызывают грозы, а также болотистыми почвами, из которых высвобождается газ метан, подпитывающий разряды молний.
9 интересных фактов о метане и природном газе.
6. Метан, является третьим по распространённости веществом во Вселенной, после Водорода и Гелия.
7. Первое в мире место по добыче Природного Газа держат Россия и США. На них приходится около 30% от всей мировой газовой отрасли. А во всем мире, ежегодно из недр Земли извлекается более 3,5 триллионов кубометров природного газа.
8. Согласно историческим справкам, люди научились использовать природный газ в своих целях уже давно. Например, около 2000 лет назад один из правителей Древней Персии приказал построить кухню на том месте, где из земли выходила его струя. Её подожгли, и огонь на кухне горел, не переставая.
9. В Туркмении с 1971 года непрерывно полыхает газовый кратер Дарваза, который местные жители назвали «Врата преисподней». Тогда геологи решили поджечь природный газ, но ошиблись в расчётах, думая, что он скоро сгорит и потухнет. Огонь там полыхает до сих пор.
9 интересных фактов о метане и природном газе.
9 интересных фактов о метане и природном газе.
9 интересных фактов о метане и природном газе.
Очень надеюсь, что данная подборка фактов вам понравилась, и вы узнали что-то новое для себя!
Источник
Краткая характеристика
Природный метан образуется при гниении останков живых организмов. В переводе с английского «methane» означает «болотный газ», так как чаще всего его обнаруживают в болотах и каменноугольных шахтах.
Почти 95% реагента появляется в результате биологических процессов. Пятая часть годовых выбросов газа в атмосферу приходится на коз и коров, в желудках которых живут бактерии, вырабатывающие метан. В атмосферу он попадает, когда рогатый скот выводит из организма продукты своей жизнедеятельности.
Другими источниками вещества являются:
- термиты;
- рис-сырец;
- болотистые водоёмы;
- фильтрация природного газа;
- фотосинтез растений;
- вулканы;
- давно погибшие организмы.
Поскольку вещество обычно связано с живыми организмами, то учёные полагают, что его присутствие на планете указывает на наличие жизни. Так, когда этот газ был обнаружен в атмосферах Марса, специалисты начали тщательное изучение планеты именно на предмет существования живых организмов. Но дальнейшие исследования показали, что на удалённых планетах Солнечной системы метана значительно больше, хотя там он появился в результате химических реакций.
На Земле вещество просачивается через трещины в земной коре, находящиеся на океанском дне, в больших количествах выделяется во время горных разработок и при лесных пожарах. Кроме того, недавно учёными был обнаружен новый источник газа, который никогда ранее в таком ключе не рассматривался.
Физические качества
Метан представляет собой самый простой углеводород. Считается, что он имеет специфический запах, но это распространённое заблуждение. Чистый газ не имеет запаха, характерный аромат он приобретает благодаря специальным добавкам, которые добавляют в вещество для предупреждения о его утечке, ведь цвета химическое соединение также не имеет.
Кроме того, к физическим свойствам метана относятся:

- Горение голубым пламенем.
- Сгорание без выделения вредных продуктов.
- Плохая растворимость в воде.
- Он легче воздуха.
- Основная составляющая природных, попутных нефтяных, рудничного и болотного газов.
- Кипение при температуре -161 °C.
- Замерзание при температуре -183 °C.
- Молярная масса составляет 16,044 г/моль.
- Плотность — 0,656 кг/м³.
- При соединении с воздухом образуются взрывоопасные смеси.
- В жидком виде представляет собой бесцветную жидкость без запаха.
Наиболее опасен метан, который выделяется во время подземных разработок полезных ископаемых, а также на фабриках, занимающихся переработкой и обогащением угля. Когда количество газа в воздухе достигает 5−6%, то он начинает гореть рядом с источниками тепла.

Если уровень вещества поднимается до 14−16%, то может произойти взрыв. При увеличении концентрации вещество горит при постоянном поступлении кислорода. Если же в этот момент количество метана начнёт снижаться, то результатом также может стать взрыв. При взрыве огонь, подпитываемый газом, движется со скоростью от 500 до 700 м/сек. Давление же вещества в этот момент в замкнутом пространстве составляет 1 Мн/м2.
При соприкосновении с источником тепла метан воспламеняется с небольшой задержкой. Это свойство вещества применяется при изготовлении предохранительных взрывчатых веществ и электрооборудования, безопасного при взрывах. На всех объектах, где существует опасность выброса метана, действуют правила техники безопасности «газовый режим».
Химические свойства
В химии формула метана — CH4. Соединение плохо вступает в химические связи.
В обычных условиях оно не реагирует со следующими веществами:
- концентрированные кислоты;
- расплавленные и концентрированные щелочи;
- щелочные металлические реагенты;
- галогены;
- перманганат калия;
- дихромат калия в кислой среде.

При температуре около 200 °C и давлении от 30 до 90 атмосфер болотный газ окисляется, преобразуясь в муравьиную кислоту. Вещество образует соединения, называемые газовыми гидратами, которые часто встречаются в природе.
По своим химическим свойствам метан схож с другими реагентами, относящимися к алканам. А потому он вступает в такие химические реакции, как:

- Конверсия в синтез-газ. Синтез-газ, который образуется в результате указанной реакции, используется для получения метанола, углеводородов и так далее.
- Галогенирование. Такая реакция является цепной. При ней молекула брома или йода подвергается воздействию света и распадается на радикалы, которое затем атакуют молекулы метана. В результате от соединения отрывается атом водорода, а газ становится свободным метилом CH3. Получившееся вещество сталкивается с молекулами брома или йода, которые разрушаются, образуя новые радикалы этих реагентов.
- Нитрование.
- Окисление или горение. Эта реакция происходит при избытке кислорода и описывается следующим уравнением: CH4 + 2O2 → CO2 + 2H2O. В этом случае пламя имеет голубой цвет. Если кислорода недостаточно, то результатом реакции становится выработка не углекислого газа, а оксида углерода. Если же кислорода ещё меньше, то взаимодействие веществ приведёт к выделению мелкодисперсного углерода.
- Сульфохлорирование.
- Сульфоокисление.
- Разложение.
- Дегидрирование.
- Каталитическое окисление. В подобных реакциях из болотного газа образуются карбоновые кислоты, спирты, альдегиды.
Получение в промышленности и лаборатории
В промышленных условиях вещество получают посредством нагревания углерода и водорода или синтеза водяного газа. Для того чтобы реакция протекала успешно, используют катализатор, обычно в этом качестве применяется никель. В США для добычи простейшего углеводорода используется специальная система, способная извлекать соединение из природного угля. Но также метан выделяется в виде подобного продукта при термической переработке нефти и нефтепродуктов, коксовании и гидрировании каменного угля.
В лаборатории для получения вещества применяются следующие методы:
- Реакция гидроксида натрия с ацетатом натрия.
- Взаимодействие карбида алюминия.
- Нагревание натристой извести с уксусной кислотой. Для этой реакции необходима безводная среда, а потому в ней применяется гидроксид натрия, который является наименее гигроскопичным.
Болотный газ самый термически устойчивый углеводород, а потому он широко применяется и в быту, и в промышленности. Хлорирование вещества даёт возможность получения метилхлорида, метиленхлорида, хлороформа, четырёххлористого углерода. Результатом его неполного сгорания является сажа, Если метан каталитически окисляется, то получается формальдегид. А его реакция с серой приводит к образованию сероуглерода.
К важным методам получения ацетилена из простейшего углеводорода относятся:
- термоокислительный крекинг,
- электрокрекинг.
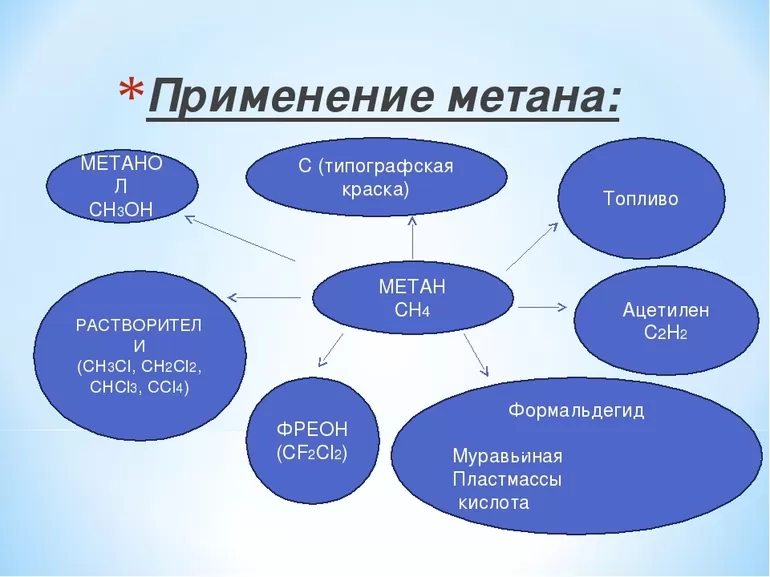
Газ также применяется для производства синильной кислоты. Кроме того, он даёт водород, необходимый для выработки водяного газа, который, в свою очередь, применяется для создания углеводородов, альдегидов и тому подобного. Кроме того, метан необходим при производстве нитрометана.
В настоящее время газ стал часто использоваться в качестве автомобильного топлива. Но его плотность в 1000 раз меньше плотности бензина, а потому, чтобы заправить автомобиль метаном на тот же объём, что и бензином, при равном давлении необходим соответствующий бак. В таком случае для обычной поездки потребовалось бы возить прицеп с топливом.
Учёные решили эту проблему, увеличив плотность газа до 200−250 атмосфер. Сжатое вещество закачивается в специальные баллоны, установленные на автомобилях особой конструкции.
Парниковый эффект

Метан является одним из газов, создающих на планете парниковый эффект. Чтобы измерить уровень его парниковой активности, необходимо принять за единицу меру воздействия на климат нашей планеты диоксида углерода. При таком соотношении влияние метана будет равно 23. Специалисты в области изучения парникового эффекта отмечают, что количество указанного газа в земной атмосфере значительно выросло за последние два столетия.
Объём метана в современной атмосфере в среднем составляет 1,8 части на миллион. Это количество в 200 раз меньше того же показателя углекислого газа. Необходимо отметить, что молекулы соединения рассеивают и удерживают теплоту, которую излучает нагретая солнцем планета, гораздо лучше, чем молекулы углекислого газа. И также необходимо отметить, что углеводород поглощает земное излучение в тех спектральных областях, которые свободно проходят через другие газовые соединения, создающие эффект парника.
Но тем не менее такие газы планете необходимы. Без двуокиси углерода, водяных паров, метана и других составляющих атмосферы температура на поверхности Земли была бы значительно ниже средних 15 градусов тепла.
Влияние на организм человека

Человек может отравиться, надышавшись метаном при аварии на производстве или из-за неправильного обращения с приборами, работающими на этом газе. Возможна такая ситуация и при длительном нахождении на болоте, в шахте. Если концентрация вещества в воздухе составляет 20 и более процентов, то отравление может быть очень тяжёлым, вплоть до летального исхода.
Работники химических производств, рудников и шахт подвержены другому способу отравления углеводородом. Зачастую эти люди на протяжении длительного времени регулярно вдыхают небольшие дозы вещества.
Кроме того, хроническая интоксикация может наступить из-за заболеваний кишечника, например, дисбактериоза. В таких случаях в организме больного метан образуется в повышенном количестве. Этот газ не станет причиной серьёзной интоксикации, но всё же он может вызвать в организме разные нарушения, привести к желудочно-кишечному дискомфорту и общему ухудшению самочувствия.
Отличить острое отравление метаном можно по следующим признакам:


- головокружение;
- шум в ушах;
- сонливость;
- общая слабость;
- потеря координации;
- нарушение речи;
- резь в глазах;
- слезотечение;
- удушье;
- усиленное сердцебиение;
- понижение артериального давления;
- тошнота;
- приступы рвоты;
- синюшность кожных покровов и слизистых оболочек.
Если отравление тяжёлое, то человек теряет сознание, у него начинаются судороги, за которыми следует кома. А также возможна остановка дыхания и сердцебиения.
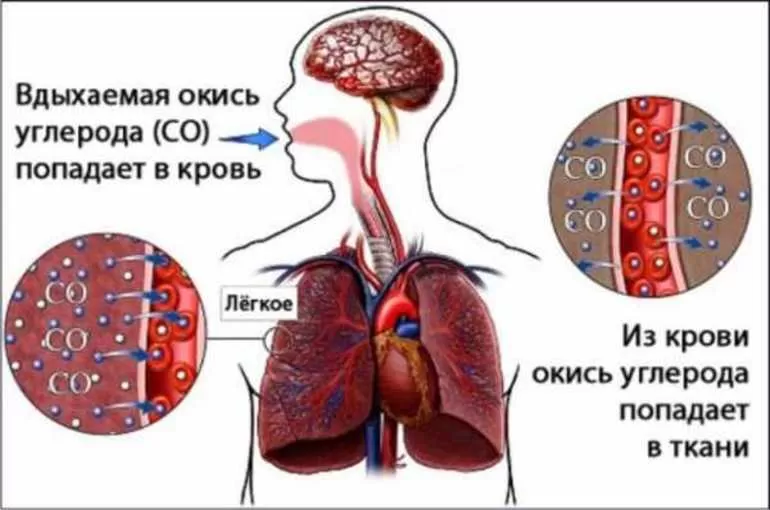
Если отравление метаном является хроническим, то пострадавший страдает от частых головных болей, общего недомогания, низкого артериального давления и снижения работоспособности. Человек становится бледным и вялым, испытывает упадок сил. Гипотония может вызывать обмороки. И также возможно истощение нервной системы, которое выражается в повышенной раздражительности, нервозности и тому подобном.
Метан известен, как один из самых опасных газов. Он токсичен, горюч и взрывоопасен. Вещество не имеет ни цвета, ни запаха, а потому обнаружить его в воздухе крайне сложно. Чтобы не подвергать своё здоровье и жизнь опасности, следует внимательно относится к технике безопасности и соблюдать осторожность при работе или бытовом использовании метана.
Источник
