Каким свойством обладает оксид фосфора
Оксид
фосфора (V) – фосфорный ангидрид
Физические свойства: Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду),
следует хранить в плотно закрытых сосудах.
Получение: Получается при горении фосфора в избытке воздуха или
кислорода
4P + 5O2 = 2P2O5
Применение:
Оксид фосфора (V) очень
энергично соединяется с водой, а также отнимает воду от других соединений. Применяется
как осушитель газов и жидкостей.
Химические
свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим
кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид
особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания),
образует в первую очередь метафосфорную кислоту НРО3:
P2O5 + H2O = HPO3
при нагревании образуется ортофосфорная кислота H3PO4:
P2O5 + 3H2O = 2H3PO4 (t˚C)
При нагревании H3PO4
можно получить пирофосфорнуюкислоту H4P2O7:
2H3PO4 = H2O + H4P2O7 (t˚C)
Ортофосфорная
кислота
Наибольшее
практическое значение имеет ортофосфорная кислота Н3РO4.
Строение
молекулы: В молекуле фосфорной
кислоты атомы водорода соединены с атомами кислорода:
Физические
свойства: Фосфорная кислота
представляет собой бесцветное, гигроскопичное твердое вещество, хорошо
растворимое в воде.
Получение:
1) Взаимодействие
оксида фосфора (V) с водой при нагревании:
P2O5 + 3H2O = 2H3PO4 (t˚C)
2) Взаимодействие
природной соли – ортофосфата кальция с
серной кислотой при нагревании:
Сa3(PO4)2
+ 3H2SO4 = 3CaSO4 + 2H3PO4 (t˚C)
3) При
взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO3+
2H2O = 3H3PO4+
5NO
Химические
свойства:
Свойства, общие с другими кислотами | Специфические |
1. Водный раствор кислоты изменяет окраску индикаторов Ортофосфорная кислота диссоциирует H3PO4 H2PO4- ↔ H+ + HPO42- (гидроортофосфат-ион) HPO42- ↔ H+ + PO43- (ортофосфат-ион) 2. Взаимодействует металл+ H3PO4=соль+Н2↑ 3. оксид металла + H3PO4 = соль + Н2О 4. основание + H3PO4 = соль + Н2О если H3PO4(изб) + NaOH = NaH2PO4 + H2O или H3PO4(изб) + 2NaOH = Na2HPO4 + 2H2O 5. H3PO4 H3PO4 H3PO4 + 3NH3 = (NH3)3PO4 6. 2H3PO4+3Na2CO3 = 2Na3PO4 | 1. При 2H3PO4 (t˚C) →H2O + H4P2O7 H4P2O7 (t˚C)→H2O + 2HPO3 2. Качественная реакция на PO43- – фосфат Отличительной реакцией ортофосфорной Н3РО4 3. Играет |
Применение:
В основном для
производства минеральных удобрений.
А также, используется
при пайке, для очищения от ржавчины металлических поверхностей. Также
применяется в составе фреонов, в промышленных морозильных установках как
связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой
добавки E338. Применяется как регулятор кислотности в газированных напитках.
Фосфорные удобрения
Фосфор – элемент важнейшего
органического соединения для любого организма аденозинтрифосфорной кислоты –
АТФ. Эта кислота служит аккумулятором энергии в живой клетке. Фосфор входит в
состав нуклеиновых кислот – ДНК и РНК, а без них невозможно хранение и
воспроизведение генетической информации, содержащейся в клетке. Фосфор
принимает активное участие в восстановлении и и распаде углеводов, оказывая
большое влияние на рост растения, его цветение и плодоношение.
Растения усваивают фосфор из почвы
главным образом в виде фосфат – иона (РО4-3). Как известно,
фосфорная кислота образует три типа солей: орто-, гидро- и дигидрофосфаты. Для
усвоения растением удобрение должно быть растворимо в воде, из средних фосфатов
растворимы только соли щелочных металлов, гидрофосфаты растворимы лучше, зато
дигидрофосфаты растворимы все без исключения.
Однако, и нерастворимая фосфоритная
мука Са3(РО4)2 и труднорастворимый преципитат
СаНРО4 прекрасно усваиваются некоторыми культурами (люпин,
горох, горчица, гречиха…). Дело в том, что корневые волоски этих растений
выделяют органические кислоты, растворяющие неподатливые в воде соли.
Одно из первых фосфорных удобрений
– это простой суперфосфат CaSO4. Ca(H2PO4)2.
Массовая доля оксида фосфора в нем не превышает 20% (это немного), кроме того,
большую часть этого удобрения составляет балласт – сульфат кальция. Однако,
пользоваться им будут еще долго, из-за легкости его получения:
Са3(РО4)2 +
2Н2SO4 =
2Ca SO4 + Ca(H2PO4)2
В другом фосфорном удобрении –
двойном суперфосфате Са(Н2РО4)∙Н2О – в отличие
от простого нет балласта – неусваиваемого растениями гипса. Производство этого
удобрения связано с применением фосфорной кислоты вместо серной, сырьем может
служить как фосфорит (ортофосфат кальция), так и известняк (карбонат кальция):
Са3(РО4)2 +
4Н3РО4+ 3Н2О = 3Са (Н2РО4)2∙Н2О
СаСО3 + 2Н3РО4 =
Са(Н2РО4)2∙Н2О + СО2
На основе фосфорной кислоты также
можно получить еще одно фосфорное удобрение – преципитат СаНРО4,
содержащий 27–42 % фосфорного ангидрида:
2Н3РО4 +
Са(ОН)2 = Са(Н2РО4)2 + 2Н2О
Са(Н2РО4)2+
Са(ОН)2 = 2СаНРО4 + 2Н2О
А если заменить в этих удобрениях
довольно безразличный для растений кальций на ион аммония? Нейтрализацией
фосфорной кислоты газообразным аммиаком получают высокоэффективные удобрения –
аммофосы:
NH3 + H3PO4 =
NH4H2PO4
или
2NH3 + H3PO4 =
(NH4)2HPO4
ТРЕНАЖЁРЫ
Тренажёр №1. “Свойства фосфора и его соединений”
Тренажёр №2. Тестовые задания по теме: “Азот и фосфор, их соединения”
№1. Составьте уравнения реакций оксида фосфора (V) с
1. Na2O
2. NaOH
3. H2O при нагревании
4. H2O без нагревания
Для 2 реакции запишите полное и краткое ионное уравнение.
№2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:
1. калием
2. оксидом калия
3. гидроксидом калия
4. сульфитом калия
№3. Осуществите превращения по схеме:
Сa3(PO4)2 -> P -> PH3 -> P2O5 -> H3PO4 -> Ca3(PO4)2
Назовите вещества
№4. Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или
преципитат богаче фосфором? Химические формулы удобрений найдите в схеме
самостоятельно.
Источник
Обзор кислородных соединений
При горении твёрдого фосфора образуется ряд веществ, на состав которых влияет концентрация кислорода в окружающем воздухе. Теоретически существует вероятность ряда метастабильных оксидов с общей формулой P4On, где коэффициент n лежит в интервале от 6 до 9. При диссоциации таких веществ образуются молекулы PO, которые в составе паров обнаруживаются только спектроскопическими методами анализа.
Список номенклатуры соединений, которые индивидуально выделяются, но не имеют широкого практического применения, выглядит так:
- Монооксид тетрафосфора P4O. Образуется при сжигании фосфора в недостатке воздуха или кислорода. Имеет вид красно-бурых кристаллов с плотностью 1,891 грамм/куб. сантиметр, не растворяется в воде. Воспламеняется при 280 °C, при нагревании в атмосфере инертного газа разлагается на P и P2O5.
- Диоксид тетрафосфора P4O2 (P2O) существует в виде димера. Получается продуванием подогретого до 60 °C воздуха или чистого кислорода через раствор легковоспламеняющегося белого фосфора в тетрахлорметане CCl4. Его жёлто-красные кристаллы при атмосферном давлении устойчивы до 100 °C, а в условиях вакуума — до 135 °C. При нагревании разлагается и выделяет P, не растворяется в H2O (воде), C2H5OH (этаноле) и C3H6O (ацетоне), на воздухе окисляется до H3PO3. Высокие восстановительные способности по отношению к ионам Fe3+, Cu2+, Ag+ используются для очистки от примесей железа в экстракционном способе получения H3PO4.
- Октаоксид тетрафосфора P4O8. Образуется при низкотемпературном горении фосфора в ограниченном количестве воздуха как белые хлопья или кристаллы. В газообразном состоянии имеет вид димеров P8O16, в твёрдой фазе присутствуют агрегаты — от мономеров до тримеров. Вещество сохраняет устойчивость при температурах до 100 °C, возгоняется при 180 °C, при нагревании выше 400 °C в чистом кислороде окисляется до P4O10. Кристаллы расплываются на воздухе, хорошо растворяются в воде, но стойки к органическим растворителям. Водные растворы содержат равное количество молей H3PO3 и HPO3 и с трудом окисляются до H3PO4.
- Триоксид (пероксид) фосфора PO3. Некоторые данные сообщают о существовании форм P2O6 или P4O11. Твёрдое вещество имеет фиолетовый цвет, обусловленный примесями. Образуется из паров P4O10 в условиях вакуума при воздействии электрического разряда и сохраняет стабильность до 150 часов при отсутствии влажности и нормальной температуре. Разлагается с выделением O2 при 127 °C, при гидратации даёт пероксофосфорную или пероксопирофосфорную кислоту, вступает в реакции с оксидами многих металлов с образованием солей — пероксофосфатов.
Наиболее устойчивы, даже в парах остаются димерами и имеют для нужд химии практическую ценность Р2О3 — трёхвалентный оксид фосфора и Р2O5 — пятивалентный оксид фосфора. Физические свойства и основные характеристики приведены в таблице:
| Наименование систематическое | Традиционное название | Химическая формула | Молярная масса, грамм/моль | Плотность, грамм/куб. см | Состояние |
| оксид фосфора (III) | фосфористый ангидрид или гексаоксид тетрафосфора | P2O3 | 219,89 | 2,135 | белые хлопья или кристаллы |
| оксид фосфора (V) | фосфорный ангидрид или пентаоксид фосфора | P2O5 | 141,94 | 2.39 | белый порошок |
Фосфористый ангидрид
Относится к бинарным неорганическим соединениям, имеет формулу P2O3 и представлен в виде димеров Р4О6. В основе молекулярной структуры лежит тетраэдр, где парные атомы фосфора разделяются атомом кислорода. Получение оксида фосфора (III) происходит при медленном окислении или горении элементарного фосфора в условиях дефицита воздуха или кислорода. Реакция записывается следующими формулами:
4P + 3О2 = 2P2О3

При нормальной температуре, влажности и давлении вещество имеет вид белой воскообразной массы, плавящейся уже при 23,8 °C и легко возгоняющейся. Оно обладает неприятным запахом и очень ядовито, без труда растворяется в воде и органических растворителях, на свету неустойчиво и со временем приобретает сначала жёлтый, а затем красный цвет.
Как типичный представитель класса кислотных оксидов, при растворении в холодной воде даёт фосфористую кислоту. Реакция такова:
Р2О3 + 3H2О =2H3PO3
При взаимодействии с горячей водой диспропорционирование протекает довольно интенсивно, образуются соединения фосфора с разными степенями окисления:
2Р2О3 + 6Н2О = PH3 + 3H3PO4.
Реакция термического разложения в вакууме при температурах от 210 до 250 °C позволяет получить октаоксид тетрафосфора и красный фосфор:
4P4O6 = 3P4O8 + 4P.
Гидроксиды металлов (щёлочи) реагируют с фосфористым ангидридом и образуют соли фосфористой кислоты:
Р2О3 + 4KOH = 2K2HPO3 + Н2О.
При взаимодействии с кислородом воздуха и галогенами выступает в роли восстановителя. В первом случае образуется фосфорный ангидрид:
Р2О3 + O2 = Р2О5,
во втором — галогеноводород и ортофосфорная кислота:
Р2О3 + 2F2 + 5Н2О = 4HF + 2H3PO4.
Малоактивные металлы при помощи фосфористого ангидрида легко восстанавливаются из растворов их соединений:
2P2O3 + 4HgCl2 + 10H2O = 4H3PO4 + 4Hg + 8HCl.
Оксид фосфора (III) нашёл применение в лабораторной практике в качестве осушающего средства.
Фосфорный ангидрид

Эмпирическая формула высшего оксида фосфора P2O5 свидетельствует о том, что в этом соединении элемент проявляет максимальную валентность, равную пяти. Структурная (графическая) формула более наглядна и показывает межатомные связи внутри молекулы.
В составе паров обнаруживаются димеры декаоксида тетрафосфора Р4О10. Твёрдое вещество обладает полиморфизмом и встречается как в аморфном стекловидном, так и в кристаллическом состоянии. Для последнего известны гексагональные и орторомбические модификации, переходящие из одной формы в другую при повышении температуры до 300 °C. В их молекулярной структуре группы PO4 образуют тетраэдры или кольца, что служит определяющим фактором для химических свойств соединения, влияет на лёгкость возгонки и активность взаимодействия с водой.
Фосфорный ангидрид синтезируется при сжигании фосфора в условиях избытка воздуха или чистого кислорода. Процесс проводится в специальных камерах и состоит из окисления элементарного P осушенным воздухом, осаждение смеси разных форм оксидов и очистку отходящих газов возгонкой:
4P + 5О2 = 2P2О5.
При нормальных условиях это белая масса, напоминающая снег и не имеющая запаха. На воздухе быстро расплывается и образует сиропообразную жидкость — метафосфорную кислоту HPO3. Р2О5 — самый эффективный дегидратирующий (водоотнимающий) агент, иногда даже со взрывом поглощает воду и широко применяется для осушения нелетучих и газообразных веществ.
Как типичный кислотный оксид фосфорный ангидрид ведёт себя, взаимодействуя с водой, щелочами и основными оксидами. В результате гидратации при нагревании образуется ряд кислот: метафосфорная, дифосфорная (пирофосфорная) и ортофосфорная. Это записывается уравнениями:
- Р2О5 + Н2О = 2HPO3.
- Р2О5 + 2Н2О = Н4Р2О7.
- Р2О5 + 3H2О = 2H3PO4.

Последний продукт имеет наибольшее практическое применение для получения минеральных удобрений, незаменим при пайке и очистке металлов от ржавчины, промышленные морозильные установки используют его как компонент фреонов. Как пищевая добавка E338 фосфорная кислота служит недорогим регулятором кислотности в продуктах питания и шипучих напитках.
Щёлочи образуют в результате взаимодействия с пентаоксидом фосфора средних и кислых солей — ортофосфатов, гидрофосфатов и дигидрофосфатов. Это иллюстрируется уравнениями, приведёнными ниже:
- Р2О5 + 6KOH = 2K3PO4 + ЗН2О.
- Р2О5 + 4KOH = 2K2HPO4 + Н2О.
- Р2О5 + 2KOH = 2KH2PO4 + Н2О.
Сплавление с основными оксидами даёт твёрдые соли ортофосфорной кислоты, на природу которых существенно влияют условия реакции:
Р2О5 + ЗCaO = Cа3 (PO4)2.
Чрезвычайно сильные дегидратирующие свойства позволяют P2O5 отнимать не только влагу, поглощённую веществами из воздуха (гигроскопическую), но и связанную химически:
Р2О5 + 2HNO3 = 2HPO3 + N2О5.
Такому водоотнимающему агенту покоряются даже оксикарбоновые кислоты, что с успехом применяется для получения их ангидридов. Спирты, эфиры, фенолы и другие органические растворители разрывают фосфор — кислородные связи в молекуле Р2О5 — и образуют фосфорорганические соединения. Реакции с аммиаком и галогеноводородами приводят к получению фосфатов аммония:
P2O5 + NH3 + H2O = (NH4)3PO4
и оксигалогенидов фосфора:
P4O10 + 12HCL = 4POCL3 + 6H2O.
Фосфорный ангидрид нашёл применение при осушении жидких и газовых сред. В термическом способе получения ортофосфорной кислоты он является одним из промежуточных продуктов, а органический синтез широко использует его плюсы при дегидратации и конденсации.
Источник
| Оксид фосфора | |
|---|---|
 | |
 | |
| Систематическое наименование | Оксид фосфора (V) |
| Хим. формула | P2O5 |
| Состояние | белый порошок |
| Молярная масса | 141,94 г/моль |
| Плотность | 2.39 г/см³ |
| Т. плав. | 420оС(Н-форма),569 (О-форма) |
| Т. кип. | возгоняется при 359 (Н-форма) °C |
| Энтальпия образования | -3010,1 кДж/моль |
| Растворимость в воде | реагирует |
| Рег. номер CAS | [1314-56-3] (P2O5) [16752-60-6] (P4O10) |
| PubChem | 14812 |
| SMILES | O=P12OP3(=O)OP(=O)(O1)OP(=O)(O2)O3 |
| InChI | 1S/O10P4/c1-11-5-12(2)8-13(3,6-11)10-14(4,7-11)9-12 DLYUQMMRRRQYAE-UHFFFAOYSA-N |
| RTECS | TH3945000 |
| ChEBI | 37376 |
| ChemSpider | 14128 и 21428497 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Пентаоксид фосфора, также оксид фосфора (V) (фосфорный ангидрид, пятиокись фосфора) — неорганическое химическое соединение класса кислотных оксидов с формулами P4O10 и P2O5
Строение
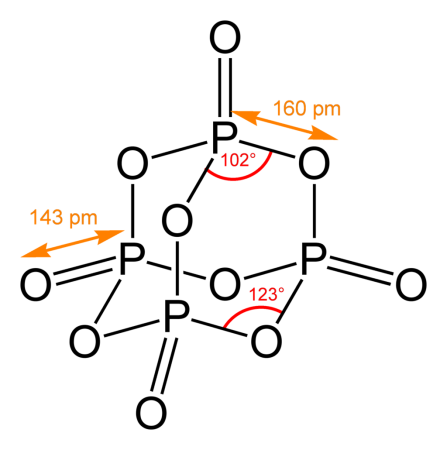
Пары оксида фосфора(V) имеют состав P4O10. Твердый оксид склонен к полиморфизму. Существует в аморфном стекловидном состоянии и кристаллическом. Для кристаллического состояния известны две метастабильные модификации пентаоксида фосфора — гексагональная Н-форма (а = 0,744 нм, = 87°, пространств, гр. R3С) и орторомбическая О-форма (а = 0,923 нм, b = 0,718 нм, с = 0,494 нм, пространств, гр. Рпат), а также одна стабильная орторомбическая О-форма (а =1,63 нм, b= 0,814 нм, с =0,526 нм, пространств. гр. Fdd2). Молекулы P4O10 (Н-форма) построены из 4 групп PO4 в виде тетраэдра, вершины которого занимают атомы фосфора, 6 атомов кислорода располагаются вдоль ребер, а 4 — по оси третьего порядка тетраэдра. Эта модификация легко возгоняется (360°С) и активно взаимодействует с водой. Другие модификации имеют слоистую полимерную структуру из тетраэдров PO4, объединенные в 10-членные (О-форма) и 6-членные (О’-форма) кольца. Эти модификации имеют более высокую температуру возгонки (~580°С) и менее химически активны. H-форма переходит в О-форму при 300—360оC.

Свойства
P4O10 очень активно взаимодействует с водой (H-форма поглощает воду даже со взрывом), образуя смеси фосфорных кислот, состав которых зависит от количества воды и других условий:
P4O10 + 6H2O → 4H3PO4
При сильном нагревании распадается на:
P4O10 → P4O6 + 2O2
Он также способен извлекать воду из других соединений, представляя собой сильное дегидратирующее средство:
4HNO3 + P4O10 → 4HPO3 + 2N2O5 4HClO4 + P4O10 → (HPO3)4 + 2Cl2O7
Оксид фосфора(V) широко применяется в органическом синтезе. Он реагирует с амидами, превращая их в нитрилы:
P4O10 + RCONH2 → P4O9(OH)2 + RCN
Карбоновые кислоты переводит в соответствующие ангидриды:
P4O10 + 12RCOOH → 4H3PO4 + 6(RCO)2O
Оксид фосфора(V) также взаимодействует со спиртами, эфирами, фенолами и другими органическими соединениями. При этом происходит разрыв связей P—О—P и образуются фосфорорганические соединения. Реагирует с NH3 и с галогеноводородами, образуя фосфаты аммония и оксигалогениды фосфора:
P4O10 + 8PCl3 + O2 → 12POCl3
При сплавлении P4O10 с основными оксидами образует различные твёрдые фосфаты, природа которых зависит от условий реакции.
Получение
Оксид фосфора(V) получают сжиганием фосфора в избытке кислорода или воздуха. Технологический процесс происходит в камере сжигания и включает в себя окисление элементарного P предварительно осушенным воздухом, осаждение P4O10 и очистку отходящих газов. Очищают полученный пентаоксид возгонкой.
4P + 5O2 → P4O10
Технический продукт имеет вид белой снегообразной массы, состоящей из смеси разных форм P4O10.
Применение
P4O10 применяют как осушитель газов и жидкостей. Также он является промежуточным продуктом в производстве ортофосфорной кислоты H3PO4 термическим способом.
Широко используется в органическом синтезе в реакциях дегидратации и конденсации.
Неорганические соединения фосфора | |
|---|---|
| Оксиды |
|
| Фосфорные кислоты |
|
| Соли |
|
| Соединения фосфония |
|
| Прочее |
|
Источник
