Каким свойством обладает гелий

Гелий – инертный газ 18-й группы периодической таблицы. Это второй самый легкий элемент после водорода. Гелий – газ без цвета, запаха и вкуса, который становится жидким при температуре -268.9 °C. Точки кипения и замерзания его ниже, чем у любого другого известного вещества. Это единственный элемент, который не затвердевает при охлаждении при нормальном атмосферном давлении. Чтобы гелий перешел в твердое состояние, необходимо 25 атмосфер при температуре 1 К.
История открытия
Гелий был найден в газовой атмосфере, окружающей Солнце, французским астрономом Пьером Жансеном, который в 1868 году во время затмения обнаружил яркую желтую линию в спектре солнечной хромосферы. Первоначально предполагалось, что эта линия представляла элемент натрий. В том же году английский астроном Джозеф Норман Локьер наблюдал желтую линию в солнечном спектре, которая не соответствовала известным линиям натрия D1 и D2, и поэтому он назвал ее линией D3. Локьер пришел к выводу, что она была вызвана веществом на Солнце, неизвестном на Земле. Он и химик Эдуард Франкленд в названии элемента использовали греческое название Солнца «гелиос».
В 1895 году британский химик сэр Уильям Рамзай доказал существование гелия на Земле. Он получил образец ураноносного минерала клевеита, и после исследования газов, образовавшихся при его нагреве, он обнаружил, что ярко-желтая линия в спектре совпадает с линией D3, наблюдаемой в спектре Солнца. Таким образом, новый элемент был окончательно установлен. В 1903 году Рамзи и Фредерик Содду определили, что гелий является продуктом спонтанного распада радиоактивных веществ.

Распространение в природе
Масса гелия составляет около 23% всей массы Вселенной, и элемент является вторым по распространенности в космосе. Он сосредоточен в звездах, где образуется из водорода в результате термоядерного синтеза. Хотя в земной атмосфере гелий находится в концентрации 1 часть на 200 тыс. (5 промилле) и в небольших количествах содержится в радиоактивных минералах, метеоритном железе, а также в минеральных источниках, большие объемы элемента встречаются в Соединенных Штатах (особенно в Техасе, Нью-Мексико, Канзасе, Оклахоме, Аризоне и Юте) в качестве компонента (до 7,6%) природного газа. Небольшие его запасы были обнаружены в Австралии, Алжире, Польше, Катаре и России. В земной коре концентрация гелия равна лишь около 8 частей на миллиард.
Изотопы
Ядро каждого атома гелия содержит два протона, но, как и у других элементов, у него есть изотопы. Они содержат от одного до шести нейтронов, поэтому их массовые числа находятся в диапазоне от трех до восьми. Стабильными из них являются элементы, у которых масса гелия определяется атомными числами 3 (3He) и 4 (4He). Все остальные радиоактивны и очень быстро распадаются на другие вещества. Земной гелий не является изначальной составляющей планеты, он образовался в результате радиоактивного распада. Альфа-частицы, испускаемые ядрами тяжелых радиоактивных веществ, представляют собой ядра изотопа 4He. Гелий не накапливается в больших количествах в атмосфере, потому что гравитации Земли недостаточно, чтобы предотвратить его постепенную утечку в космос. Следы 3He на Земле объясняются отрицательным бета-распадом редкого элемента водорода-3 (трития). 4He является наиболее распространенным из стабильных изотопов: соотношение числа атомов 4He к 3He составляет около 700 тыс. к 1 в атмосфере и около 7 млн к 1 в некоторых гелийсодержащих минералах.
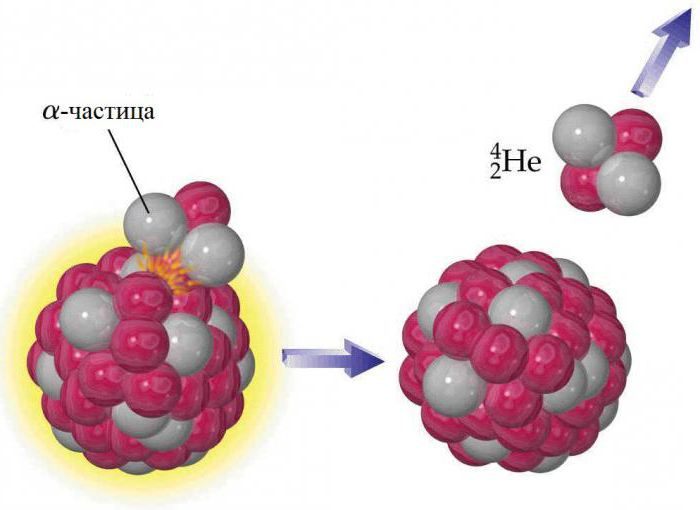
Физические свойства гелия
Температура кипения и плавления у этого элемента самые низкие. По этой причине гелий существует в виде газа, за исключением экстремальных условий. Газообразный He в воде растворяется меньше, чем какой-либо другой газ, а скорость диффузии через твердые тела в три раза больше, чем у воздуха. Его показатель преломления ближе всего приближается к 1.
Теплопроводность гелия уступает лишь теплопроводности водорода, а его удельная теплоемкость необычайно высокая. При обычных температурах при расширении он нагревается, а ниже 40 K – охлаждается. Поэтому при Т<40 K гелий можно превратить в жидкость путем расширения.
Элемент является диэлектриком, если не находится в ионизированном состоянии. Как и у других благородных газов, у гелия есть метастабильные энергетические уровни, которые позволяют ему оставаться ионизированным в электрическом разряде, когда напряжение остается ниже потенциала ионизации.
Гелий-4 уникален тем, что обладает двумя жидкими формами. Обычная называется гелий I и существует при температурах от точки кипения 4,21 К (-268,9 °C) до около 2,18 К (-271 °C). Ниже 2,18 K теплопроводность 4He становится в 1000 раз больше, чем у меди. Эта форма называется гелий II, чтобы отличить ее от обычной. Она обладает сверхтекучестью: вязкость настолько низкая, что не может быть измерена. Гелий II растекается в тонкую пленку на поверхности любого вещества, которого касается, и эта пленка течет без трения даже против силы тяжести.
Менее обильный гелий-3 образует три различные жидкие фазы, две из которых сверхтекучи. Сверхтекучесть в 4He была обнаружена советским физиком Петром Леонидовичем Капицей в середине 1930-х годов, и такое же явление в 3He было впервые замечено Дугласом Д. Ошеровым, Дэвидом М. Ли, и Робертом С. Ричардсоном из США в 1972 году.
Жидкая смесь двух изотопов гелия-3 и -4 при температурах ниже 0,8 К (-272.4 °C) разделяется на два слоя – практически чистого 3He и смеси 4He с 6% гелия-3. Растворение 3He в 4He сопровождается охлаждающим эффектом, который используется в конструкции криостатов, в которых температура гелия опускается ниже 0,01 К (-273,14 °C) и поддерживается такой в течение нескольких дней.

Соединения
В нормальных условиях гелий химически инертен. В экстремальных можно создать соединения элемента, которые при нормальных показателях температуры и давления не являются стабильными. Например, гелий может образовывать соединения с йодом, вольфрамом, фтором, фосфором и серой, когда он подвергается действию электрического тлеющего разряда при бомбардировке электронами или в состоянии плазмы. Таким образом, были созданы HeNe, HgHe10, WHe2 и молекулярные ионы Не2+, Не2++, HeH+ и HeD+. Эта техника также позволила получить нейтральные молекулы Не2 и HgHe.
Плазма
Во Вселенной преимущественно распространен ионизированный гелий, свойства которого существенно отличаются от молекулярного. Электроны и протоны его не связаны, и он обладает очень высокой электропроводностью даже в частично ионизированном состоянии. На заряженные частицы сильное воздействие оказывают магнитные и электрические поля. Например, в солнечном ветре ионы гелия вместе с ионизированным водородом взаимодействуют с магнитосферой Земли, вызывая северные сияния.

Открытие месторождений в США
После бурения скважины в 1903 году в Декстере, штат Канзас, был получен негорючий газ. Первоначально не было известно, что в нем содержится гелий. Какой газ был найден, определил геолог штата Эразмус Хаворт, который собрал его образцы и в университете Канзаса с помощью химиков Кэди Гамильтона и Дэвида Макфарланда обнаружил, что тот содержит 72% азота, 15% метана, 1% водорода и 12% не было идентифицировано. Проведя последующие анализы, ученые обнаружили, что 1,84% пробы составляет гелий. Так узнали о том, что данный химический элемент присутствует в огромных количествах в недрах Великих равнин, откуда его можно извлечь из природного газа.
Промышленное производство
Это сделало Соединенные Штаты лидером мирового производства гелия. По предложению сэра Ричарда Трельфалла, ВМС США профинансировали три небольших экспериментальных завода для получения этого вещества во время Первой мировой войны с целью обеспечить заградительные аэростаты легким негорючим подъемным газом. По данной программе были произведены в общей сложности 5700 м3 92-процентного He, хотя до этого были получены лишь менее 100 л газа. Часть этого объема была использована в первом в мире гелиевом дирижабле ВМФ США С-7, который совершил свой первый рейс из Хэмптон-Роудс (штат Вирджиния) в Боллинг-Филд (Вашингтон, округ Колумбия) 7 декабря 1921 года.
Хотя процесс низкотемпературного сжижения газа в то время не был достаточно разработан, чтобы оказаться существенным во время Первой мировой войны, производство продолжалось. Гелий в основном использовался в качестве подъемного газа в летательных аппаратах. Спрос на него вырос во время Второй мировой войны, когда его стали применять при экранированной дуговой сварке. Элемент также имел важное значение в проекте создания атомной бомбы «Манхэттен».

Национальный запас США
В 1925 году правительство Соединенных Штатов создало Национальный запас гелия в Амарилло, штат Техас, с целью обеспечения военных дирижаблей во время войны и коммерческих воздушных кораблей в мирное время. Использование газа после Второй мировой сократилось, но запас был увеличен в 1950-х годах для обеспечения, среди прочего, его поставок в качестве теплоносителя, применяемого в производстве кислородно-водородного ракетного топлива в период космической гонки и холодной войны. Использование гелия в США в 1965 году в восемь раз превысило пиковое потребление военного времени.
После принятия закона о гелии 1960 года Горное бюро подрядило 5 частных предприятий для извлечения элемента из природного газа. Для этой программы был построен 425-км газопровод, соединивший эти заводы с правительственным частично истощенным газовым месторождением неподалеку от Амарилло в Техасе. Гелий-азотная смесь закачивалась в подземное хранилище и оставалась там, пока в ней не возникала необходимость.
К 1995 году был собран запас объемом миллиард кубометров, а задолженность Национального резерва составила 1,4 млрд долларов, что побудило Конгресс США в 1996 г. поэтапно отказаться от него. После принятия в 1996 г. закона о приватизации гелия Министерство природных ресурсов приступило к ликвидации хранилища в 2005 году.

Чистота и объемы производства
Гелий, произведенный до 1945 года, имел чистоту около 98%, остальные 2% приходились на азот, что было достаточным для дирижаблей. В 1945 г. было произведено небольшое количество 99,9-процентного газа для использования в дуговой сварке. К 1949 г. чистота получаемого элемента достигла 99,995%.
На протяжении многих лет Соединенные Штаты производили более 90% мирового объема коммерческого гелия. Начиная с 2004 года, ежегодно его вырабатывалось 140 млн м3, 85% из которых приходится на США, 10% производилось в Алжире, а остальное – в России и Польше. Основными источниками гелия в мире являются газовые месторождения Техаса, Оклахомы и Канзаса.
Процесс получения
Гелий (чистотой 98,2%) выделяют из природного газа путем сжижения других компонентов при низких температурах и при высоких давлениях. Адсорбция других газов охлажденным активированным углем позволяет добиться чистоты 99,995%. Небольшой объем гелия производится при сжижении воздуха в больших масштабах. Из 900 т воздуха можно получить около 3,17 куб. м газа.

Сферы применения
Благородный газ нашел применение в разных областях.
- Гелий, свойства которого позволяют получать сверхнизкие температуры, используется как охлаждающий агент в Большом адронном коллайдере, сверхпроводящих магнитах аппаратов МРТ и спектрометров ядерного магнитного резонанса, спутниковой аппаратуры, а также для сжижения кислорода и водорода в ракетах «Аполлон».
- В качестве инертного газа для сварки алюминия и др. металлов, при производстве оптоволокна и полупроводников.
- Для создания давления в топливных баках ракетных двигателей, особенно тех, которые работают на жидком водороде, т. к. только гелий газообразный сохраняет свое агрегатное состояние, когда водород остается жидким);
- He-Ne газовые лазеры используются для сканирования штрих-кодов на кассах в супермаркетах.
- Гелий-ионный микроскоп позволяет получить лучшие изображения, чем электронный.
- Благодаря высокой проницаемости благородный газ используется для проверки утечек, например, в системах кондиционирования воздуха автомобилей, а также для быстрого наполнения подушек безопасности при столкновении.
- Низкая плотность позволяет наполнять декоративные шары с гелием. Инертный газ заменил взрывоопасный водород в дирижаблях и воздушных шарах. Например, в метеорологии, шары с гелием используются для подъема измерительных приборов.
- В криогенной технике служит теплоносителем, поскольку температура этого химического элемента в жидком состоянии минимально возможная.
- Гелий, свойства которого обеспечивают ему низкую реактивность и растворимость в воде (и крови), в смеси с кислородом нашел применение в дыхательных составах для подводного плавания с аквалангом и проведения кессонных работ.
- Метеориты и горные породы анализируются на содержание данного элемента для определения их возраста.
Гелий: свойства элемента
Основные физические свойства He следующие:
- Атомный номер: 2.
- Относительная масса атома гелия: 4,0026.
- Точка плавления: нет.
- Точка кипения: -268,9 °C.
- Плотность (1 атм, 0 °C): 0,1785 г/п.
- Состояния окисления: 0.
Источник

Основная информация об элементе
Уникальное в своем роде вещество считается одним из самых распространенных во всей Вселенной, уступая пальму первенства в своем объеме только водороду, ведь его доля составляет около 23 процентов от общей массы этого безграничного пространства. Близкие к рекордным показатели демонстрируют и другие физические свойства гелия, которые стоит рассмотреть более подробно.
Физические особенности
Химический элемент относят к практически полностью инертным газам, он не является токсичным и не имеет вкуса и запаха. Одиночное строение атома гелия остается таковым при любых условиях, чего не скажешь о других его характеристиках, зависящих от атмосферного давления, температурного режима и многих других параметров. Самый легкий идеальный газ после водорода, гелий обладает следующими физическими свойствами:
- Молярная масса атома газа составляет 4,002601 грамма на моль. Что касается молярного объема, то этот показатель равен 31,81 сантиметра кубических на моль, тогда как молярная теплоемкость составляет 20,79 Дж/Кмоль.
- Плотность вещества напрямую зависит от температурного режима, соответствуя 0,147 грамма на сантиметр кубический при падении столбика термометра ниже отметки в минус 270 градусов Цельсия и 0,000117846 градуса при нагревании до плюс 20 градусов и выше.
- Температура кипения у гелия является наиболее низкой, если сравнивать его с любым другим химическим элементом. Так, вещество имеет свойство закипать при температуре, равной 4,2152 Кельвина, что эквивалентно минус 268,94 градуса Цельсия.
- Температурный режим плавления соответствует 0,95 Кельвина или минус 272,2 градуса Цельсия при давлении, равном 2,5 МПа. При этом удельная теплота плавления составляет 0,0138 килоДжоуля на моль при удельной теплоте испарения 0, 0829 кДж/моль.
- Получение вещества в твердом виде становится возможным только при атмосферном давлении выше 25 атмосфер, тогда как при любых других показателях (даже нулевых) он не переходит в эту фазу.
- Гелий, найденный в природных условиях, всегда состоит из двух изотопов стабильного типа, один из которых имеет высокий процент распространения, близком к сотне, тогда как другой встречается гораздо реже, причем в совершенно разных естественных источниках (до 0,00014%). Помимо прочего, науке известны еще как минимум 6 радиоактивных гелиевых изотопов искусственного происхождения.
Стоит отметить, что для качественного определения вещества сегодня используется анализ эмиссионного спектра излучения, тогда как для количества применимым остается хроматографическое и масс-спектрометрическое тестирование. Кроме того, актуальными являются простейшие методы идентификации, подразумевающие измерение таких основных параметров, как плотность, молярная масса и теплопроводность.
Гелий в своем газообразном состоянии очень тяжело растворяется в воде (гораздо сложнее, чем любой другой газ). Так, в литре воды, температура которой составляет 20 градусов Цельсия, объем растворимого газа составляет не более 8,8 миллилитра из 100. Еще худшую растворимость можно наблюдать в этиловом спирте, так как ее показатель не превышает 2,8 мл/л при 15-градусной температуре и 3,2 мл при нагревании этанола до 25 градусов Цельсия.
А вот скорость диффузии гелия превышает актуальный для воздуха показатель в три раза, опережая даже водород, у которого коэффициент проникаемости ниже на 65%. Абсолютным рекордсменом гелий является и по коэффициенту преломления, максимально приближаясь к единице. Эффект Джоуля — Томсона у гелия имеет отрицательное значение в нормальной среде из-за его слишком быстрого охлаждения.
Что касается остывания в процессе дросселирования, то оно становится возможным только при 40 К и нормальном атмосферном давлении. Если же температура продолжит опускаться, то становится возможным переход гелия из газообразного в жидкое состояние, но только при условии применения охлаждения расширительного типа, обеспечить которое реально только с помощью специального преобразователя относительной потенциальной энергии в механическую.
Химические свойства
Гелий является наименее активным элементом из всех известных, относясь к 18-й группе периодической таблицы и имея общепринятое обозначение He. Такой же является и химическая формула гелия (электронная состоит из двух протонов и такого же количества нейтронов, дающих массовое число 4), который имеет в своей основе кристаллическую решетку гексагонального типа с параметрами 3,570 для показателя a и 5,84 для c, дающих соотношение 1,633. Что касается других химических характеристик вещества, то среди них стоит выделить:

- Величина ковалентного радиуса равна 28 пм при радиусе иона, соответствующем 93 пм.
- Уровень электроотрицательности по шкале Полинга соответствует 4,5 баллам.
- Электродный потенциал, как степени окисления, а следовательно, и валентность элемента имеют нулевые значения.
- Энергия ионизации первого электрона равна 2361,3 кДж/моль.
- Показатель теплопроводности элемента соответствует 300 К.
- Молекулярная ионная энергия равна 58 ккал/моль.
- Равновесное расстояние между ядрами химически связанных элементов соответствует 1,09 А.
Что касается соединений вещества, то сегодня известной является его связь LiHe. Сам элемент имеет свойство образовывать двухатомные молекулы фторида и хлорида, обозначение первого из которых HeF, а второго HeCl, притом что их получение становится возможным только при воздействии электрического разряда или УФ-излучения на смесь описываемого элемента с фтором или хлором, соответственно.
Совершенно другими свойствами обладает гелий в газообразном состоянии. Не последнюю роль в этом вопросе играет воздействие на газ различного рода физических и химических процессов. К примеру, если пропустить ток через трубочку с гелием, то можно наблюдать его радужное свечение, сила которого будет зависеть от создаваемого давления в закрытом пространстве. Если же не прибегать к подобным приемам, то останется один только желтый спектр, считающийся привычным для гелия в его нормальном состоянии.
Ввиду содержания в веществе нескольких линий спектра по мере уменьшения атмосферного давления происходит изменение его цветового излучения, которое начинает меняться от желтого к оранжевому, розовому и зеленому. Всего же учеными принято выделять два основных спектра — единичный и триплетный, первый из которых свойственен атомам в их нормальном состоянии. Что касается перехода в триплетное состояние, то он становится возможным только при использовании разряда в 19,77 эВ.

Вывести атом из его привычного состояния можно и другими методами воздействия, один из которых заключается в искусственно созданном столкновении с другими атомами вещества с последовательной передачей энергии между ними. А вот обратный переход из триплетного состояния в синглетное естественным путем практически невозможен. Такое состояние называется метастабильным и для того, чтобы перевести газ в стандартное положение вновь, приходится прибегать к различным методам внешнего воздействия.
Интересные факты о гелии
Название элемента происходит от греческого «Гелиос», что означает «Солнце» и латинского «гелиум», притом что второе наименование было выбрано отнюдь не случайно. Так, не секрет, что окончание «ум» применяется по отношению к металлам, к которым и относился гелий на момент своего открытия. И хотя на самом деле вещество является неметаллом, иногда его так и называют по-латыни, что не является ошибкой.
Немного истории
Сегодня уже мало кто вспомнит, что открытие элемента произошло еще 18 августа 1868 года, когда известный французский ученый решил исследовать солнечную хромосферу в момент полного затмения звезды в одном из индийских городов. Примечательно, что всего лишь через 3 месяца такое же открытие было сделано в Англии, правда, тогда о его неактуальности еще никто не знал, ввиду более сложной корреспонденции научных данных.
В 1881 году итальянский вулканолог Луиджи Пальмери, исследовавший Везувий, также идентифицировал это вещество, поспешив сообщить о своей находке общественности. Но самое важное событие в области открытия гелия произошло 27 годами позже, когда он был впервые выявлен в недрах планеты. Тогда газ удалось добыть из такого распространенного минерала, как клевеит, и со временем именно он использовался учеными для того, чтобы установить величину его удельного веса и других физических параметров.

Со временем исследователи научились получать гелий в жидком виде, для чего впервые довелось применить процедуру дросселирования. В отличие от этого попытки добывать твердый гелий долгое время не увенчивались успехом. Ситуация изменилась только в 1926 году, когда вдобавок к охлаждению было применено и критическое понижение атмосферного давления до 35 атм, в результате чего удалось выделить кристаллическую решетку вещества.
Получение и применение
Удивительно, но, несмотря на свое внушительное распространение во всей Вселенной, гелий довольно редко встречается на Земле. Разной является и природа образования этого элемента на Земле и в космосе, так как в первом случае его выделение происходит за счет распада альфа-частиц тяжелых элементов. В итоге часть вещества проходит через земные породы, сливаясь с природным газом и демонстрируя концентрацию от 7 процентов от общего объема и выше.
В настоящее время месторождения, в которых наблюдаются большие залежи гелия, имеются на территории таких стран, как Индия, Бразилия, Россия и Танзания. Естественно, речь идет о гелийсодержащих газах, которые используются в промышленности для выведения чистого элемента или его производных. Для этого применяется процедура охлаждения посредством дросселирования, и в этом случае сложность разжижения элемента в значительной мере облегчает процесс.
На выходе удается получить смесь, состоящую не только из гелия, но и из водорода и неона, после чего производится очистка. В итоге доля сырого гелия будет составлять около 70−90 процентов от общего объема. После финишной фильтрации продукт, который, как известно, не может гореть, а следовательно, и не представляет никакой угрозы, транспортируясь в металлических баллонах, изготовленных в соответствии с ГОСТ 949–73 . Если же стоит вопрос о перевозке сжиженного газа, то в ход идут специальные сосуды марки СТГ-10 и СТГ-25.

Что касается применения, то гелий используется в следующих сферах:
- Металлургия.
- Пищевая промышленность.
- Для изготовления хладагентов для различных агрегатов и рабочих установок.
- Для наполнения различных судов воздухоплавания и шариков.
- В дайвинге для приготовления дыхательных смесей, необходимых для погружения.
- В ракетных установках в качестве одной из составляющих теплоносителя.
- Для наполнения трубок газорезного типа.
- В сфере газовой хроматографии.
- Для поиска утечек в трубопроводах и всевозможных инфраструктурных установках.
Естественно, на этом применение элемента не заканчивается, ввиду чего производство гелия является очень развитым и востребованным в настоящее время.

Среди прочих преимуществ газа — его высокие перспективы в сфере термоядерной энергетики, благо, мировые запасы гелийсодержащих веществ не позволяют отнести его в разряд дефицитного.
Так, современные эксперты называют цифру в 45,6 миллиарда метров кубических, притом что объемы производства перевалили за 110 миллионов еще в 2003 году.
Источник
