Каким способом можно узнать свойства веществ
28 марта 2012
Автор
КакПросто!
Химические свойства вещества – это способность изменять свой состав в ходе химических реакций. Реакция может протекать либо в виде саморазложения, либо при взаимодействии с другими веществами. Свойства вещества зависят не только от его состава, но и от структуры. Вот характерный пример: и этиловый спирт, и этиловый эфир имеют одинаковую эмпирическую формулу С2Н6О. Но химические свойства у них разные. Поскольку структурная формула спирта СН3–СН2-ОН, а эфира – СН3-О-СН3.
Инструкция
Есть два основных способа определения свойств: теоретический и практический. В первом случае представление о свойствах вещества делают, исходя из его эмпирической и структурной формулы.
Если это простое вещество, то есть состоящее из атомов только одного элемента, для ответа на этот вопрос достаточно посмотреть в таблицу Менделеева. Есть четкая закономерность: чем левее и ниже располагается элемент в таблице, тем сильнее у него выражены металлические свойства (достигая максимума у франция). Соответственно, чем правее и выше, тем сильнее неметаллические свойства (достигая максимума у фтора).
Если вещество относится к классу оксидов, его свойства зависят от того, с каким элементом соединен кислород. Бывают основные оксиды, образованные металлами. Соответственно, они проявляют свойства оснований: реагируют с кислотами, образуя соль и воду; с водородом, восстанавливаясь до металла. Если же основной оксид образован щелочным или щелочноземельным металлом, он вступает в реакцию с водой, образуя щелочь, или с кислотным оксидом, образуя соль. Например:СаО + Н2О = Са(ОН)2;К2О + СО2 = К2СО3.
Кислотные оксиды реагируют с водой, образуя кислоту. Например: SO2 + H2O = H2SO3. Также они реагируют с основаниями, образуя соль и воду:СО2 + 2NaOH = Na2CO3 + H2O.
Если же оксид образован амфотерным элементом (например, алюминием, германием и т.п.), он будет проявлять как основные, так и кислотные свойства.
В том случае, когда вещество более сложного строения, заключение о его свойствах делают, рассматривая целый ряд факторов. Прежде всего, исходя из наличия и количества функциональных групп, то есть тех участков молекулы, которая непосредственно образует химическую связь. Для оснований и спиртов, например, это гидроксил-группа – ОН, для альдегидов – СOH, для карбоновых кислот – СООН, для кетонов – СО и т.д.
Практический же способ, как легко понять из самого названия, заключается в проверке химических свойств вещества опытным путем. Его подвергают взаимодействию с определенными реагентами при различных условиях (температуре, давлении, в присутствии катализаторов и т.п.) и смотрят, какой будет результат.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google
Privacy Policy and
Terms of Service apply.
Источник
«Вещества и их свойства. Чистые вещества и смеси»
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
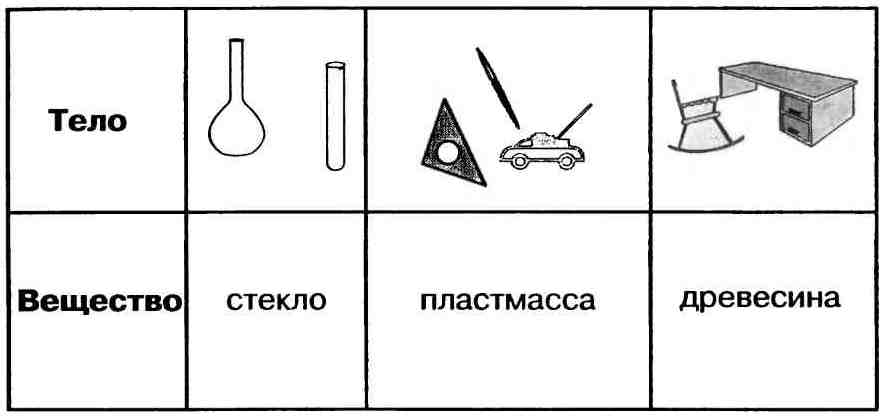
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
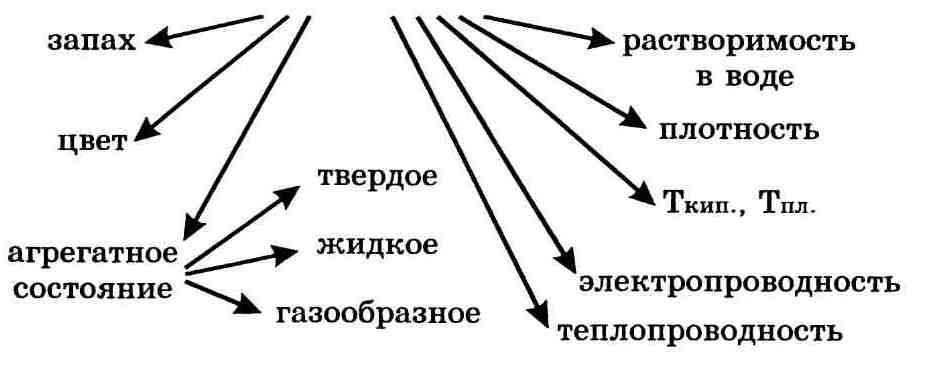
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:

Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
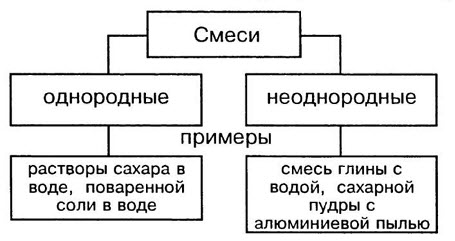
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
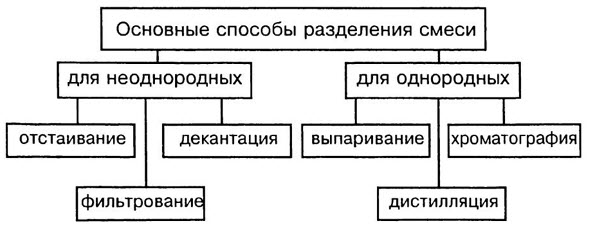
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Конспект урока «Вещества и их свойства. Чистые вещества и смеси».
Следующая тема: «Физические и химические явления».
Источник
Об
атомах и химических элементах
Другого
ничего в природе нет
ни
здесь, ни там, в космических глубинах:
все
— от песчинок малых до планет —
из
элементов состоит единых.
С.
П. Щипачев, «Читая Менделеева».
В
химии кроме терминов “атом” и “молекула” часто
употребляется понятие “элемент”. Что общего и чем эти понятия различаются?
Химический
элемент – это
атомы одного и того же вида. Так, например, все атомы водорода –
это элемент водород; все атомы кислорода и ртути – соответственно элементы
кислород и ртуть.
В
настоящее время известно более 107 видов атомов, то есть более 107 химических
элементов. Нужно различать понятия “химический элемент”, “атом” и “простое
вещество”
Простые
и сложные вещества
По
элементному составу различают простые вещества, состоящие из атомов
одного элемента (H2, O2, Cl2, P4,
Na, Cu, Au), и сложные вещества, состоящие из атомов разных
элементов (H2O, NH3, OF2, H2SO4,
MgCl2, K2SO4).
К 70-м гг. XIX в. было уже известно более 60 химических элементов. Их условно классифицировали на металлы и неметаллы
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ | |
МЕТАЛЛЫ | НЕМЕТАЛЛЫ |
ОТЛИЧИТЕЛЬНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА СООТВЕТСТВУЮЩИХ ПРОСТЫХ ВЕЩЕСТВ | |
Железо Fe, медь Cu, алюминий Al, ртуть Hg, золото Au, серебро Ag и другие | Уголь С, сера S, фосфор P, йод I2, кислород O2, водород H2 и другие. |
1. Твёрдое агрегатное состояние (исключение – ртуть) 2. Металлический блеск 3. Хорошие проводники тепла и электричества. 4. Пластичные и ковкие. | 1. Твёрдые (Уголь С, сера S, фосфор P, йод I2), жидкие (бром Br2) и газообразные (кислород O2, водород H2). 2. Металлическим блеском не обладают (исключение йод) 3. Не проводят тепло и электрический ток – ИЗОЛЯТОРЫ. 4. Хрупкие |
На
2019 год в периодической таблице – 118 химических элементов, которые
образуют около 500 простых веществ.

Самородное
золото – простое вещество
Способность
одного элемента существовать в виде различных простых веществ, отличающихся по
свойствам, называется аллотропией. Например, элемент кислород O
имеет две аллотропные формы – кислород O2 и
озон O3 с различным числом атомов в молекулах. Аллотропные
формы элемента углерод C – алмаз и графит – отличаются строение их кристаллов. Существуют
и другие причины аллотропии.
| Название элемента | Аллотропные формы | Пример простого вещества |
| Углерод С | Графит
|
|
| Углерод С |
|
Сложные
вещества часто называют химическими соединениями, например, оксид
ртути(II) HgO (получается путем соединения атомов простых веществ – ртути Hg и
кислорода O2), бромид натрия (получается путем соединения атомов
простых веществ – натрия Na и брома Br2).
Итак,
подытожим вышесказанное. Молекулы вещества бывают двух видов:
1. Простые –
молекулы таких веществ состоят из атомов одного вида. В химических реакциях не
могут разлагаться с образованием нескольких более простых веществ.
2. Сложные –
молекулы таких веществ состоят из атомов разного вида. В химических реакциях
могут разлагаться с образованием более простых веществ.
Различие
понятий “химический элемент” и “простое вещество”
Отличить
понятия “химический элемент” и “простое вещество” можно
при сравнении свойств простых и сложных веществ. Например, простое вещество
– кислород – бесцветный газ, необходимый для дыхания,
поддерживающий горение. Мельчайшая частица простого вещества кислорода –
молекула, которая состоит из двух атомов. Кислород входит также в состав оксида
углерода (угарный газ) и воды. Однако, в состав воды и оксида углерода входит
химически связанный кислород, который не обладает свойствами простого вещества,
в частности он не может быть использован для дыхания. Рыбы, например, дышат не
химически связанным кислородом, входящим в состав молекулы воды, а свободным,
растворенным в ней. Поэтому, когда речь идет о составе каких – либо химических
соединений, следует понимать, что в эти соединения входят не простые вещества,
а атомы определенного вида, то есть соответствующие элементы.
При
разложении сложных веществ, атомы могут выделяться в свободном состоянии и
соединяясь, образовывать простые вещества. Простые вещества состоят из атомов
одного элемента. Различие понятий «химический элемент» и «простое вещество»
подтверждается и тем, что один и тот же элемент может образовывать несколько
простых веществ. Например, атомы элемента кислорода могут образовать
двухатомные молекулы кислорода и трехатомные – озона. Кислород и озон – совершенно
различные простые вещества. Этим объясняется тот факт, что простых веществ
известно гораздо больше, чем химических элементов.
Пользуясь
понятием «химический элемент», можно дать такое определение простым и сложным
веществам:
Простыми
называют такие вещества, которые состоят из атомов одного химического элемента.
Сложными
называют такие вещества, которые состоят из атомов разных химических элементов.
Отличие
понятий «смесь» и «химическое соединение»
Сложные
вещества часто называют химическими соединениями.
Осуществите
переход по ссылке и просмотрите опыт взаимодействия простых веществ железа и серы.
Попробуйте
ответить на вопросы:
1.Чем
отличаются по составу смеси от химических соединений?
2. Сопоставьте
свойства смесей и химических соединений?
3. Какими
способами можно разделить на составляющие компоненты смеси и химического
соединения?
4. Можно
ли судить по внешним признакам об образовании смеси и химического соединения?
Сравнительная
характеристика смесей и химических
Вопросы для сопоставления смесей с химическими соединениями | Сопоставление | |
Смеси | Химические соединения | |
Чем отличаются по составу смеси от химических соединений? | Вещества можно смешивать в любых соотношениях, т.е. состав смесей | Состав химических соединений постоянный. |
Сопоставьте свойства смесей и химических соединений? | Вещества в составе смесей сохраняют свои свойства | Вещества, образующие соединения, свои свойства не сохраняют, так как |
Какими способами можно разделить на составляющие компоненты смеси и | Вещества можно разделить физическими способами | Химические соединения можно разложить только с помощью химических |
Можно ли судить по внешним признакам об образовании смеси и химического | Механическое смешивание не сопровождается выделением теплоты или | Об образовании химического соединения можно судить по признакам |
Задания
для закрепления
I.
Поработайте с тренажёрами
Тренажёр №1
Тренажёр №2
Тренажёр №3
Тренажёр №4
Тренажёр №5
II.
Решите задание
Из предложенного списка веществ выпишите отдельно
простые и сложные вещества:
NaCl, H2SO4, K, S8, CO2, O3,
H3PO4, N2, Fe. Объясните ваш выбор, в каждом
из случаев.
III.
Ответьте на вопросы
№1. Сколько простых веществ записано в ряду
формул:
H2O, N2, O3, HNO3,
P2O5, S, Fe, CO2, KOH.
№2. К сложным относятся оба
вещества:
А) С (уголь) и S (сера);
Б) CO2 (углекислый газ) и H2O
(вода);
В) Fe (железо) и CH4 (метан);
Г) H2SO4 (серная кислота)
и H2 (водород).
№3. Выберите правильное
утверждение: простые вещества состоят из атомов одного вида.
А) Верно; Б) Неверно
№4. Для смесей характерно то, что
А) Они имеют постоянный состав;
Б) Вещества в составе “смеси” не сохраняют
свои индивидуальные свойства;
В) Вещества в “смесях” можно разделить
физическими свойствами;
Г) Вещества в “смесях” можно разделить при
помощи химической реакции.
№5. Для “химических соединений”
характерно следующее:
А) Переменный состав;
Б) Вещества, в составе “химического соединения
«можно разделить физическими способами;
В) Об образовании химического соединения можно
судить по признакам химических реакций;
Г) Постоянный состав.
№6. В каком случае идёт речь
о железе как о химическом элементе?
А) Железо – это металл, который притягивается
магнитом;
Б) Железо входит с состав ржавчины;
В) Для железа характерен металлический блеск;
Г) В состав сульфида железа входит один атом железа.
№7.
В каком случае идёт речь о кислороде как о простом веществе?
А) Кислород – это газ, поддерживает дыхание и
горение;
Б) Рыбы дышат кислородом, растворённым в воде;
В) Атом кислород входит в состав молекулы воды;
Г) Кислород входит в состав воздуха.
Источник



