Каким кристаллическим строением и какими свойствами будут обладать

Всем специалистам в области кристаллографии или физики твердого тела совершенно ясно, что в случае кристалла мы имеем дело с упорядоченным расположением в пространстве атомов или ионов. В некоторых случаях, например в кристаллах льда или отвержденных газов, речь может идти о молекулах. Для краткости далее будем говорить только об атомах, в том числе ионизированных (ионах), если не оговаривается что-нибудь другое.
Итак, кристалл — это упорядоченная в пространстве система атомов. Они расположены правильным образом и чаще всего так, чтобы максимально плотно заполнить объем пространства. Попытавшись расположить вплотную друг к другу стальные шарики от шарикоподшипника, мы получим вполне приличную модель кристаллического строения и быстро убедимся, что число способов, которыми можно разместить шарики, ограничено. В зависимости от того, как расположены относительно друг друга атомные ряды и атомные плоскости, могут быть получены разные типы кристаллов. В свою очередь тип расположения атомов определяется их взаимодействием между собой, природой связи между частицами.
Аккуратное разламывание кристаллов приводит к появлению необычных структур с интересными свойствами. Сначала появляются крупные области с положительным или отрицательным поверхностным зарядом, создающие мощное электрическое поле, а затем они переходят в лабиринты шириной всего в несколько атомов.
Многие свойства ионных кристаллов обусловлены их структурой на атомарном масштабе: положительно и отрицательно заряженные атомы притягиваются друг к другу и образуют прочную периодическую решетку. Однако на поверхности кристалла заряды должны быть скомпенсированы. «Если расщепить кристалл с кубической решеткой вдоль определенных направлений, то можно получить заряды только одного типа, — поясняет один из авторов работы Ульрих Дибольд из Венского университета. — Такая конфигурация крайне нестабильна». Потенциально такой слой мог бы на крошечном образце создавать поле с напряжением в миллионы вольт. Такую ситуацию ученые называют «поляризационной катастрофой».
В новом исследовании физики пытались понять, как именно атомы реорганизуются, чтобы не допустить поляризационной катастрофы. «Поверхность может по-разному измениться в ответ на разлом, — говорит первый автор статьи Мартин Сетвин. — Электроны могут начать накапливаться в определенных местах, кристаллическая решетка может исказиться или молекулы из воздуха могут налипнуть на поверхность, меняя ее свойства».
Ученые раскалывали кристаллы танталата калия KTaO3 при низких температурах и получали сколы, при которых половина атомов из слоя с одинаковыми зарядами оставалось на одном обломке, а вторая — на другом. Области с ионами одинакового заряда формировали «островки», хотя в среднем поверхность оказывалась нейтральной. «Тем не менее, островки достаточно велики, поэтому поляризационной катастрофы не удается полностью избежать — создаваемое ими поле настолько велико, что оно меняет свойства нижележащих слоев», — рассказал Сетвин.
При небольшом повышении температуры островки распались на лабиринт из ломаных линий, причем его «стены» были высотой всего в один атом и шириной в 4-5 атомов.
«Лабиритнообразные структуры не только прекрасны, но и потенциально полезны, — подытожил Дибольд. — Этот как раз то, что нужно — сильные электрические поля на атомном масштабе». Одним из возможных применений авторы называют проведение химических реакций, которые не проходят в других условиях, например, расщепление воды для получения водорода.
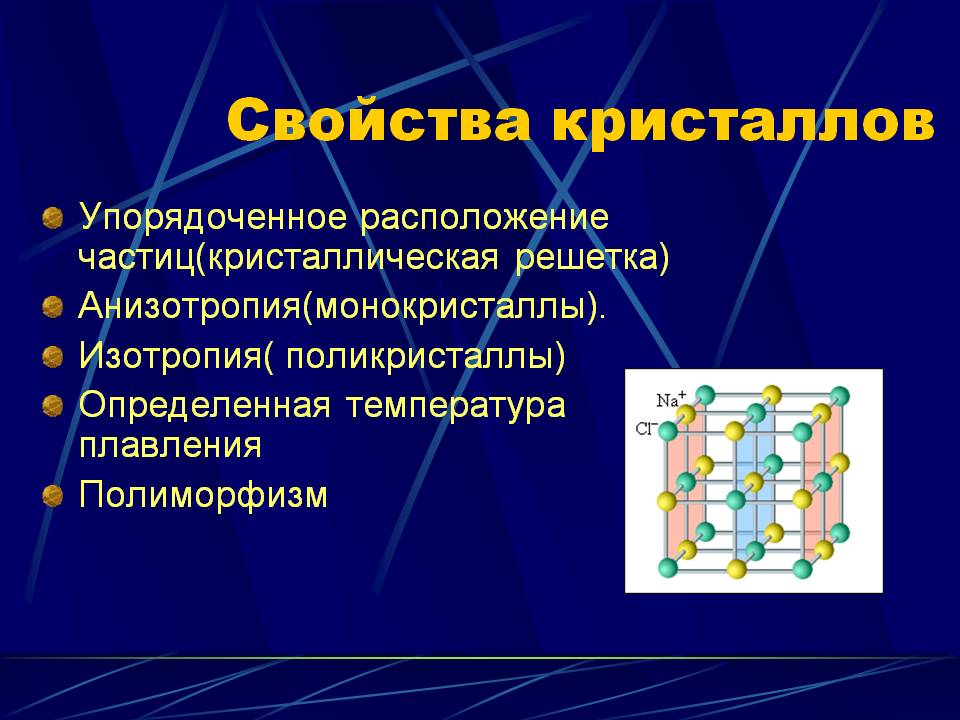
Основные свойства кристаллов – анизотропность, однородность, способность к самоогоранению и наличие постоянной температуры плавления определяются их внутренним строением.
Анизотропность
Это свойство называется еще неравносвойственностью. Выражается она в том, что физические свойства кристаллов (твердость, прочность, теплопроводность, электропроводность, скорость распространения света) неодинаковы по разным направлениям. Частицы, образующие кристаллическую структуру по непараллельным направлениям, отстоят друг от друга на разных расстояниях, вследствие чего и свойства кристаллического вещества по таким направлениям должны быть различными. Характерным примером вещества с ярко выраженной анизотропностью является слюда. Кристаллические пластинки этого минерала легко расщепляются лишь по плоскостям, параллельным его пластинчастости. В поперечных же направлениях расщепить пластинки слюды значительно труднее.
Анизотропность проявляется и в том, что при воздействии на кристалл какого-либо растворителя скорость химических реакций различна по различным направлениям. В результате каждый кристалл при растворении приобретает свои характерные формы, носящие название фигур вытравливания.
Аморфные вещества характеризуются изотропностью (равносвойственностью) – физические свойства по всем направлениям проявляются одинаково.
Однородность
Выражается в том, что любые элементарные объемы кристаллического вещества, одинаково ориентированные в пространстве, абсолютно одинаковы по всем своим свойствам: имеют один и тот же цвет, массу, твердость и т.д. таким образом, всякий кристалл есть однородное, но в то же время и анизотропное тело.
Однородность присуща не только кристаллическим телам. Твердые аморфные образования также могут быть однородными. Но аморфные тела не могут сами по себе принимать многогранную форму.
Способность к самоогранению
Способность к самоогранению выражается в том, что любой обломок или выточенный из кристалла шарик в соответствующей для его роста среде с течением времени покрывается характерными для данного кристалла гранями. Эта особенность связана с кристаллической структурой. Стеклянный же шарик, например, такой особенностью не обладает.
Кристаллы одного и того же вещества могут отличаться друг от друга своей величиной, числом граней, ребер и формой граней. Это зависит от условий образования кристалла. При неравномерном росте кристаллы получаются сплющенными, вытянутыми и т.д. Неизменными остаются углы между соответственными гранями растущего кристалла. Эта особенность кристаллов известна как закон постоянства гранных углов. При этом величина и форма граней у различных кристаллов одного и того же вещества, расстояние между ними и даже их число могут меняться, но углы между соответствующими гранями во всех кристаллах одного и того же вещества остаются постоянными при одинаковых условиях давления и температуры.
Закон постоянства гранных углов было установлен в конце XVII века датским ученым Стено (1699) на кристаллах железного блеска и горного хрусталя, впоследствии этот закон был подтвержден М.В. Ломоносовым (1749) и французским ученым Роме де Лиллем (1783). Закон постоянства гранных углов получил название первого закона кристаллографии.
Закон постоянства гранных углов объясняется тем, что все кристаллы одного вещества тождественны по внутреннему строению, т.е. имеют одну и ту же структуру.
Согласно этому закону кристаллы определенного вещества характеризуются своими определенными углами. Поэтому измерением углов можно доказать принадлежность исследуемого кристалла к тому или иному веществу. На этом основан один из методов диагностики кристаллов.
Для измерения у кристаллов двугранных углов были изобретены специальные приборы – гониометры.
Постоянная температура плавления
Выражается в том, что при нагревании кристаллического тела температура повышается до определенного предела; при дальнейшем же нагревании вещество начинает плавиться, а температура некоторое время остается постоянной, так как все тепло идет на разрушение кристаллической решетки. Температура, при которой начинается плавление, называется температурой плавления.
Аморфные вещества в отличие от кристаллических не имеют четко выраженной температуры плавления. На кривых охлаждения (или нагревания) кристаллических и аморфных веществ, можно видеть, что в первом случае имеются два резких перегиба, соответствующие началу и концу кристаллизации; в случае же охлаждения аморфного вещества мы имеем плавную кривую. По этому признаку легко отличить кристаллические вещества от аморфных.
Прочность кристаллов
Проблема прочности кристаллов была и остается одной из самых важных в современных технике. Дело в том, что широко используемые конструкционные материалы в большей части представляют собой сплавы железа (сталь), алюминия (силумин, дюралюминий), меди (латунь, бронза) и некоторых других металлов, и все они имеют кристаллическое строение. В случае металлов мы редко имеем дело с такими правильными и красивыми кристаллами, о которых шла речь раньше. Металлические сплавы имеют так называемое поликристаллическое строение, то есть состоят из отдельных зерен — кристаллов, несколько развернутых друг относительно друга.
Шаг за шагом человек переходил от менее прочного материала к более прочному, это вело к совершенствованию всей используемой техники и расширению ее возможностей. Сейчас в борьбе за прочность счет идет уже только на проценты; из технических материалов выжато практически все, что можно, и каждый последующий шаг дается со все большим трудом.
Лет двадцать назад казалось, что если научиться выращивать бездефектные кристаллы большого размера, то проблема прочности будет полностью решена, а расход металла в сотни раз сократится. К сожалению, эти надежды не сбылись. Вырастить идеальный кристалл большого размера или очень дорого, или невозможно. Только в таких областях, как радиоэлектроника, это можно себе позволить. Например, полупроводниковые кристаллы Ge и Si выращиваются практически бездефектными. Такими же являются и рубиновые кристаллы для лазеров. Что же касается конструкционных материалов, то здесь пока приходится достигать высоких значений прочности, идя традиционным путем.
И еще одно важное заключение. Оказывается, что многие физические свойства кристаллов, в первую очередь их прочность, определяются не идеальной кристаллической решеткой, а отклонениями от идеальности — дефектной структурой. Умелое использование таких пороков кристалла позволяет управлять его свойствами и приспосабливать их к разнообразным требованиям современной техники. Для физика или инженера дефекты являются очень важной составной частью кристалла, без которой он практически не может существовать. Но тема дефектов в кристаллах заслуживает более глубокого и всестороннего обсуждения, чем то, которое возможно в этой статье.
[источники]
Источники:
https://www.geolib.net/crystallography/vazhneyshie-svoystva-kristallov.html
https://indicator.ru/news/2018/02/02/labirinty-na-skolah-kristallov/?utm_source=indivk&utm_medium=social&utm_campaign=eta-zamyslovataya-struktura—ne-rezulta
https://biofile.ru/geo/3307.html
Это копия статьи, находящейся по адресу https://masterokblog.ru/?p=2285.
Источник
Кристаллические тела и их свойства
Подробности
Категория: Молекулярно-кинетическая теория
Опубликовано 14.11.2014 17:19
Просмотров: 17551

В твёрдых телах частицы (молекулы, атомы и ионы) расположены настолько близко друг к другу, что силы взаимодействия между ними не позволяют им разлетаться. Эти частицы могут лишь совершать колебательные движения вокруг положения равновесия. Поэтому твёрдые тела сохраняют форму и объём.
По своей молекулярной структуре твёрдые тела разделяются на кристаллические и аморфные.
Строение кристаллических тел

Кристаллическая решётка
Кристаллическими называют такие твёрдые тела, молекулы, атомы или ионы в которых располагаются в строго определённом геометрическом порядке, образуя в пространстве структуру, которая называется кристаллической решёткой. Этот порядок периодически повторяется по всем направлениям в трёхмерном пространстве. Он сохраняется на больших расстояниях и не ограничен в пространстве. Его называют дальним порядком.
Типы кристаллических решёток
Кристаллическая решётка – это математическая модель, с помощью которой можно представить, как расположены частицы в кристалле. Мысленно соединив в пространстве прямыми линиями точки, в которых расположены эти частицы, мы получим кристаллическую решётку.
Расстояние между атомами, расположенными в узлах этой решётки, называется параметром решётки.
В зависимости от того, какие частицы расположены в узлах, кристаллические решётки бывают молекулярные, атомные, ионные и металлические.
От типа кристаллической решётки зависят такие свойства кристаллических тел, как температура плавления, упругость, прочность.
При повышении температуры до значения, при котором начинается плавление твёрдого вещества, происходит разрушение кристаллической решётки. Молекулы получают больше свободы, и твёрдое кристаллическое вещество переходит в жидкую стадию. Чем прочнее связи между молекулами, тем выше температура плавления.
Молекулярная решётка

В молекулярных решётках связи между молекулами не прочные. Поэтому при обычных условиях такие вещества находятся в жидком или газообразном состоянии. Твёрдое состояние для них возможно только при низких температурах. Температура их плавления (перехода из твёрдого состояния в жидкое) также низкая. А при обычных условиях они находится в газообразном состоянии. Примеры – иод (I2), «сухой лёд» (двуокись углерода СО2).
Атомная решётка

В веществах, имеющих атомную кристаллическую решётку, связи между атомами прочные. Поэтому сами вещества очень твёрдые. Плавятся они при высокой температуре. Кристаллическую атомную решётку имеют кремний, германий, бор, кварц, оксиды некоторых металлов и самое твёрдое в природе вещество – алмаз.
Ионная решётка

К веществам с ионной кристаллической решёткой относятся щёлочи, большинство солей, оксиды типичных металлов. Так как сила притяжения ионов очень велика, то эти вещества способны плавиться только при очень высокой температуре. Их называют тугоплавкими. Они обладают высокой прочностью и твёрдостью.
Металлическая решётка

В узлах металлической решётки, которую имеют все металлы и их сплавы, расположены и атомы, и ионы. Благодаря такому строению металлы обладают хорошей ковкостью и пластичностью, высокой тепло- и электропроводностью.
Чаще всего форма кристалла – правильный многогранник. Грани и рёбра таких многогранников всегда остаются постоянными для конкретного вещества.
Одиночный кристалл называют монокристаллом. Он имеет правильную геометрическую форму, непрерывную кристаллическую решётку.
Примеры природных монокристаллов – алмаз, рубин, горный хрусталь, каменная соль, исландский шпат, кварц. В искусственных условиях монокристаллы получают в процессе кристаллизации, когда охлаждая до определённой температуры растворы или расплавы, выделяют из них твёрдое вещество в форме кристаллов. При медленной скорости кристаллизации огранка таких кристаллов имеет естественную форму. Таким способом в специальных промышленных условиях получают, например, монокристаллы полупроводников или диэлектриков.
Мелкие кристаллики, беспорядочно сросшиеся друг с другом, называются поликристаллами. Ярчайший пример поликристалла – камень гранит. Все металлы также являются поликристаллами.
Анизотропия кристаллических тел

В кристаллах частицы расположены с различной плотностью по разным направлениям. Если мы соединим прямой линией атомы в одном из направлений кристаллической решётки, то расстояние между ними будет одинаковым на всём этом направлении. В любом другом направлении расстояние между атомами тоже постоянно, но его величина уже может отличаться от расстояния в предыдущем случае. Это означает, что на разных направлениях между атомами действуют разные по величине силы взаимодействия. Поэтому и физические свойства вещества по этим направлениям также будут отличаться. Это явление называется анизотропией – зависимостью свойств вещества от направления.
Электропроводность, теплопроводность, упругость, показатель преломления и другие свойства кристаллического вещества различаются в зависимости от направления в кристалле. По-разному в разных направлениях проводится электрический ток, по-разному нагревается вещество, по-разному преломляются световые лучи.
В поликристаллах явление анизотропии не наблюдается. Свойства вещества остаются одинаковыми по всем направлениям.
Источник

Всем специалистам в области кристаллографии или физики твердого тела совершенно ясно, что в случае кристалла мы имеем дело с упорядоченным расположением в пространстве атомов или ионов. В некоторых случаях, например в кристаллах льда или отвержденных газов, речь может идти о молекулах. Для краткости далее будем говорить только об атомах, в том числе ионизированных (ионах), если не оговаривается что-нибудь другое.
Итак, кристалл — это упорядоченная в пространстве система атомов. Они расположены правильным образом и чаще всего так, чтобы максимально плотно заполнить объем пространства. Попытавшись расположить вплотную друг к другу стальные шарики от шарикоподшипника, мы получим вполне приличную модель кристаллического строения и быстро убедимся, что число способов, которыми можно разместить шарики, ограничено. В зависимости от того, как расположены относительно друг друга атомные ряды и атомные плоскости, могут быть получены разные типы кристаллов. В свою очередь тип расположения атомов определяется их взаимодействием между собой, природой связи между частицами.
Аккуратное разламывание кристаллов приводит к появлению необычных структур с интересными свойствами. Сначала появляются крупные области с положительным или отрицательным поверхностным зарядом, создающие мощное электрическое поле, а затем они переходят в лабиринты шириной всего в несколько атомов.

Многие свойства ионных кристаллов обусловлены их структурой на атомарном масштабе: положительно и отрицательно заряженные атомы притягиваются друг к другу и образуют прочную периодическую решетку. Однако на поверхности кристалла заряды должны быть скомпенсированы. «Если расщепить кристалл с кубической решеткой вдоль определенных направлений, то можно получить заряды только одного типа, — поясняет один из авторов работы Ульрих Дибольд из Венского университета. — Такая конфигурация крайне нестабильна». Потенциально такой слой мог бы на крошечном образце создавать поле с напряжением в миллионы вольт. Такую ситуацию ученые называют «поляризационной катастрофой».
В новом исследовании физики пытались понять, как именно атомы реорганизуются, чтобы не допустить поляризационной катастрофы. «Поверхность может по-разному измениться в ответ на разлом, — говорит первый автор статьи Мартин Сетвин. — Электроны могут начать накапливаться в определенных местах, кристаллическая решетка может исказиться или молекулы из воздуха могут налипнуть на поверхность, меняя ее свойства».
Ученые раскалывали кристаллы танталата калия KTaO3 при низких температурах и получали сколы, при которых половина атомов из слоя с одинаковыми зарядами оставалось на одном обломке, а вторая — на другом. Области с ионами одинакового заряда формировали «островки», хотя в среднем поверхность оказывалась нейтральной. «Тем не менее, островки достаточно велики, поэтому поляризационной катастрофы не удается полностью избежать — создаваемое ими поле настолько велико, что оно меняет свойства нижележащих слоев», — рассказал Сетвин.

При небольшом повышении температуры островки распались на лабиринт из ломаных линий, причем его «стены» были высотой всего в один атом и шириной в 4-5 атомов.
«Лабиритнообразные структуры не только прекрасны, но и потенциально полезны, — подытожил Дибольд. — Этот как раз то, что нужно — сильные электрические поля на атомном масштабе». Одним из возможных применений авторы называют проведение химических реакций, которые не проходят в других условиях, например, расщепление воды для получения водорода.
Основные свойства кристаллов – анизотропность, однородность, способность к самоогоранению и наличие постоянной температуры плавления определяются их внутренним строением.
Анизотропность
Это свойство называется еще неравносвойственностью. Выражается она в том, что физические свойства кристаллов (твердость, прочность, теплопроводность, электропроводность, скорость распространения света) неодинаковы по разным направлениям. Частицы, образующие кристаллическую структуру по непараллельным направлениям, отстоят друг от друга на разных расстояниях, вследствие чего и свойства кристаллического вещества по таким направлениям должны быть различными. Характерным примером вещества с ярко выраженной анизотропностью является слюда. Кристаллические пластинки этого минерала легко расщепляются лишь по плоскостям, параллельным его пластинчастости. В поперечных же направлениях расщепить пластинки слюды значительно труднее.

Анизотропность проявляется и в том, что при воздействии на кристалл какого-либо растворителя скорость химических реакций различна по различным направлениям. В результате каждый кристалл при растворении приобретает свои характерные формы, носящие название фигур вытравливания.
Аморфные вещества характеризуются изотропностью (равносвойственностью) – физические свойства по всем направлениям проявляются одинаково.
Однородность
Выражается в том, что любые элементарные объемы кристаллического вещества, одинаково ориентированные в пространстве, абсолютно одинаковы по всем своим свойствам: имеют один и тот же цвет, массу, твердость и т.д. таким образом, всякий кристалл есть однородное, но в то же время и анизотропное тело.
Однородность присуща не только кристаллическим телам. Твердые аморфные образования также могут быть однородными. Но аморфные тела не могут сами по себе принимать многогранную форму.

Способность к самоогранению
Способность к самоогранению выражается в том, что любой обломок или выточенный из кристалла шарик в соответствующей для его роста среде с течением времени покрывается характерными для данного кристалла гранями. Эта особенность связана с кристаллической структурой. Стеклянный же шарик, например, такой особенностью не обладает.
Кристаллы одного и того же вещества могут отличаться друг от друга своей величиной, числом граней, ребер и формой граней. Это зависит от условий образования кристалла. При неравномерном росте кристаллы получаются сплющенными, вытянутыми и т.д. Неизменными остаются углы между соответственными гранями растущего кристалла. Эта особенность кристаллов известна как закон постоянства гранных углов. При этом величина и форма граней у различных кристаллов одного и того же вещества, расстояние между ними и даже их число могут меняться, но углы между соответствующими гранями во всех кристаллах одного и того же вещества остаются постоянными при одинаковых условиях давления и температуры.
Закон постоянства гранных углов было установлен в конце XVII века датским ученым Стено (1699) на кристаллах железного блеска и горного хрусталя, впоследствии этот закон был подтвержден М.В. Ломоносовым (1749) и французским ученым Роме де Лиллем (1783). Закон постоянства гранных углов получил название первого закона кристаллографии.
Закон постоянства гранных углов объясняется тем, что все кристаллы одного вещества тождественны по внутреннему строению, т.е. имеют одну и ту же структуру.

Согласно этому закону кристаллы определенного вещества характеризуются своими определенными углами. Поэтому измерением углов можно доказать принадлежность исследуемого кристалла к тому или иному веществу. На этом основан один из методов диагностики кристаллов.
Для измерения у кристаллов двугранных углов были изобретены специальные приборы – гониометры.
Постоянная температура плавления
Выражается в том, что при нагревании кристаллического тела температура повышается до определенного предела; при дальнейшем же нагревании вещество начинает плавиться, а температура некоторое время остается постоянной, так как все тепло идет на разрушение кристаллической решетки. Температура, при которой начинается плавление, называется температурой плавления.
Аморфные вещества в отличие от кристаллических не имеют четко выраженной температуры плавления. На кривых охлаждения (или нагревания) кристаллических и аморфных веществ, можно видеть, что в первом случае имеются два резких перегиба, соответствующие началу и концу кристаллизации; в случае же охлаждения аморфного вещества мы имеем плавную кривую. По этому признаку легко отличить кристаллические вещества от аморфных.
Прочность кристаллов
Проблема прочности кристаллов была и остается одной из самых важных в современных технике. Дело в том, что широко используемые конструкционные материалы в большей части представляют собой сплавы железа (сталь), алюминия (силумин, дюралюминий), меди (латунь, бронза) и некоторых других металлов, и все они имеют кристаллическое строение. В случае металлов мы редко имеем дело с такими правильными и красивыми кристаллами, о которых шла речь раньше. Металлические сплавы имеют так называемое поликристаллическое строение, то есть состоят из отдельных зерен — кристаллов, несколько развернутых друг относительно друга.
Шаг за шагом человек переходил от менее прочного материала к более прочному, это вело к совершенствованию всей используемой техники и расширению ее возможностей. Сейчас в борьбе за прочность счет идет уже только на проценты; из технических материалов выжато практически все, что можно, и каждый последующий шаг дается со все большим трудом.
Лет двадцать назад казалось, что если научиться выращивать бездефектные кристаллы большого размера, то проблема прочности будет полностью решена, а расход металла в сотни раз сократится. К сожалению, эти надежды не сбылись. Вырастить идеальный кристалл большого размера или очень дорого, или невозможно. Только в таких областях, как радиоэлектроника, это можно себе позволить. Например, полупроводниковые кристаллы Ge и Si выращиваются практически бездефектными. Такими же являются и рубиновые кристаллы для лазеров. Что же касается конструкционных материалов, то здесь пока приходится достигать высоких значений прочности, идя традиционным путем.

И еще одно важное заключение. Оказывается, что многие физические свойства кристаллов, в первую очередь их прочность, определяются не идеальной кристаллической решеткой, а отклонениями от идеальности — дефектной структурой. Умелое использование таких пороков кристалла позволяет управлять его свойствами и приспосабливать их к разнообразным требованиям современной техники. Для физика или инженера дефекты являются очень важной составной частью кристалла, без которой он практически не может существовать. Но тема дефектов в кристаллах заслуживает более глубокого и всестороннего обсуждения, чем то, которое возможно в этой статье.
Источники:
https://www.geolib.net/crystallography/vazhneyshie-svoystva-kristallov.html
https://indicator.ru/news/2018/02/02/labirinty-na-skolah-kristallov/?utm_source=indivk&utm_medium=social&utm_campaign=eta-zamyslovataya-struktura—ne-rezulta
https://biofile.ru/geo/3307.html
Источник

