Каких реакциях сера проявляет восстановительные свойства

Сера расположена в VIа группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s23p4. В соединениях с металлами и водородом сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.
Сера встречается в свободном (самородном) состоянии и связанном виде.
Важнейшие природные соединения серы:
FeS2 — железный колчедан или пирит,
ZnS — цинковая обманка или сфалерит (вюрцит),
PbS — свинцовый блеск или галенит,
HgS — киноварь,
Sb2S3 — антимонит.
Кроме того, сера присутствует в нефти, природном угле, природных газах, в природных водах (в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды). Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Аллотропия — это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О2 и О3, S2 и S8, Р2 и Р4 и т.д).
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S8, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета.
Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).
1) ромбическая — S8
t°пл. = 113°C; r = 2,07 г/см3
Наиболее устойчивая модификация.
2) моноклинная — темно-желтые иглы
t°пл. = 119°C; r = 1,96 г/см3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
3) пластическая — коричневая резиноподобная (аморфная) масса
Неустойчива, при затвердевании превращается в ромбическую
- Промышленный метод — выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода):
2H2S + O2 → 2S + 2H2O
- Реакция Вакенродера:
2H2S + SO2 → 3S + 2H2O
Окислительные свойства серы
(S + 2ē → S-2)
1) Сера реагирует со щелочными металлами без нагревания:
2Na + S → Na2S
c остальными металлами (кроме Au, Pt) — при повышенной t°:
2Al + 3S –→ Al2S3
Zn + S –→ ZnS
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S → H2S
2P + 3S → P2S3
C + 2S → CS2
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
(S — 2ē → S+2; S — 4ē → S+4; S — 6ē → S+6)
3) c кислородом:
S + O2 –t° → S+4O2
2S + 3O2 –t°;pt → 2S+6O3
4) c галогенами (кроме йода):
S + Cl2→ S+2Cl2
S + 3F2→ SF6
Со сложными веществами:
5) c кислотами — окислителями:
S + 2H2SO4(конц) → 3S+4O2 + 2H2O
S + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
Реакции диспропорционирования:
6) 3S0 + 6KOH → K2S+4O3 + 2K2S-2 + 3H2O
7) сера растворяется в концентрированном растворе сульфита натрия:
S0 + Na2S+4O3 → Na2S2O3 тиосульфат натрия


Сероводород H2S и сульфиды- химические свойства
Соединения серы +4: сернистый газ, сернистая кислота и её соли сульфиты.
Серная кислота – химические свойства и промышленное производство
Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
Источник
Сера – элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к
группе халькогенов – элементов VIa группы.
Сера – S – простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при
религиозных обрядах.

Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных
электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.

Природные соединения
- FeS2 – пирит, колчедан
- ZnS – цинковая обманка
- PbS – свинцовый блеск (галенит), Sb2S3 – сурьмяный блеск, Bi2S3 – висмутовый блеск
- HgS – киноварь
- CuFeS2 – халькопирит
- Cu2S – халькозин
- CuS – ковеллин
- BaSO4 – барит, тяжелый шпат
- CaSO4 – гипс
В местах вулканической активности встречаются залежи самородной серы.

Получение
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S,
SO2.
H2S + O2 = S + H2O (недостаток кислорода)
SO2 + C = (t) S + CO2
Серу можно получить разложением пирита
FeS2 = (t) FeS + S
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
H2S + H2SO4 = S + H2O
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакции с кислотами
- Реакции с щелочами
На воздухе сера окисляется, образуя сернистый газ – SO2. Реагирует со многими неметаллами, без нагревания –
только со фтором.
S + O2 = (t) SO2
S + F2 = SF6
S + Cl2 = (t) SCl2
S + C = (t) CS2

При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
K + S = (t) K2S
Al + S = Al2S3
Fe + S = (t) FeS
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
S + H2SO4 = (t) SO2 + H2O
S + HNO3 = (t) H2SO4 + NO2 + H2O
Сера вступает в реакции диспропорционирования с щелочами.
S + KOH = (t) K2S + K2SO3 + H2O

Сероводород – H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные
ванны).

Получение
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Al2S3 + H2O = (t) Al(OH)3↓ + H2S↑
FeS + HCl = FeCl2 + H2S↑

Химические свойства
- Кислотные свойства
- Восстановительные свойства
- Качественная реакция
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит
от соотношения основания и кислоты).
MgO + H2S = (t) MgS + H2O
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
2KOH + H2S = K2S + 2H2O
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Ca + H2S = (t) CaS + H2
Сероводород – сильный восстановитель (сера в минимальной степени окисления S2-). Горит в кислороде синим пламенем, реагирует с кислотами.
H2S + O2 = H2O + S (недостаток кислорода)
H2S + O2 = H2O + SO2 (избыток кислорода)
H2S + HClO3 = H2SO4 + HCl

Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
H2S + Pb(NO3)2 = PbS↓ + HNO3
Оксид серы – SO2
Сернистый газ – SO2 – при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся
спички).

Получение
В промышленных условиях сернистый газ получают обжигом пирита.
FeS2 + O2 = (t) FeO + SO2
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота,
распадающаяся на сернистый газ и воду.
K2SO3 + H2SO4 = (t) K2SO4 + H2O + SO2↑
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2 + H2O
- Кислотные свойства
- Восстановительные свойства
- Как окислитель
С основными оксидами, основаниями образует соли сернистой кислоты – сульфиты.
K2O + SO2 = K2SO3
NaOH + SO2 = NaHSO3
2NaOH + SO2 = Na2SO3 + H2O

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
Fe2(SO4)3 + SO2 + H2O = FeSO4 + H2SO4
SO2 + O2 = (t, кат. – Pt) SO3
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
CO + SO2 = CO2 + S
H2S + SO2 = S + H2O
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Получение
SO2 + H2O ⇄ H2SO3
Химические свойства
- Диссоциация
- Кислотные свойства
- Окислительные свойства
- Восстановительные свойства
Диссоциирует в водном растворе ступенчато.
H2SO3 = H+ + HSO3-
HSO3- = H+ + SO32-
В реакциях с основными оксидами, основаниями образует соли – сульфиты и гидросульфиты.
CaO + H2SO3 = CaSO3 + H2O
H2SO3 + 2KOH = 2H2O + K2SO3 (соотношение кислота – основание, 1:2)
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота – основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
H2SO3 + H2S = S↓ + H 2O
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
H2SO3 + Br2 = H2SO4 + HBr

Оксид серы VI – SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
Получение
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора
(оксид ванадия – Pr, V2O5).
SO2 + O2 = (кат) SO3
В лабораторных условиях разложением солей серной кислоты – сульфатов.
Fe2(SO4)3 = (t) SO3 + Fe2O3
Химические свойства
- Кислотные свойства
- Окислительные свойства
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли – сульфаты и
гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке – средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке – кислая соль)
SO3 + Ca(OH)2 = CaSO4 + H2O

SO3 + Li2O = Li2SO4
SO3 + H2O = H2SO4
SO3 – сильный окислитель. Чаще всего восстанавливается до SO2.
SO3 + P = SO2 + P2O5
SO3 + H2S = SO2 + H2O
SO3 + KI = SO2 + I2 + K2SO4

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Сера
Элемент сера 16S, как и кислород 8О, находится в главной подгруппе VI группы периодической системы элементов. Однако химия серы существенно отличается от химии кислорода. Это обусловлено следующими причинами:
1. В отличие от кислорода сера проявляет и окислительные, и восстановительные свойства.
2. В отличие от кислорода, имеющего постоянную валентность II и степень окисления в соединениях -2, сера – элемент с переменной валентностью и с переменной степенью окисления.
Характеристика элемента
16S1s22s22p63s23p4
Аr = 32,066
ЭО – 2,5
Изотопы: 32S (95,084 %); 34S (4,16 %); 33S и 36S (
Кларк в земной коре 0,05 % по массе. Формы нахождения:
1) самородная сера (свободная S);
2) S2- (H2S и сульфиды металлов);
3) S+6 (сульфаты Ва и Са);
4) в составе белков, витаминов.
Сера – типичный неметалл, р-элемент. Устойчивые С.О. в соединениях -2, +4, +6.
Отличительное свойство – способность образовывать прочные гомоатомные связи-S-S-S- что приводит к существованию линейных и циклических цепей.
Важнейшие S-содержащие вещества
S-2 | S0 | S+4 | S+6 |
восстановители | окислительно – восстановительная двойственность | окислители | |
H2S сероводород CS2 – сероуглерод | S, свободная сера, большое число аллотропов | SO2 сернистый ангидрид | SO3 |
Свободная сера
Аллотропные модификации серы: ромбическая – S8. Твердое кристаллическое вещество ли монно-желтого цвета; нерастворимо в воде, хорошо растворимо в сероуглероде, ацетоне, бензоле.
Моноклинная – S8. Существует при температуре около 950С. Отличается от ромбической взаимной ориентацией октаэдров в кристаллической решетке.
Пластическая. Длинные зигзагообразные цепи.
Получение серы
1. Извлечение самородной серы из ее месторождений
2. Переработка природных газов, содержащих H2S (окисление при недостатке О2).
3. В лаборатории серу получают взаимодействием SО2 и H2S в водном растворе:
SО2 + 2H2S = 3S↓ + 2H2О
Химические свойства серы
При обычной температуре твердофазная сера малореакционноспособна. Однако при нагревании, и особенно в расплавленном состоянии, сера ведет себя как очень химически активное вещество
Сера – окислитель:
S + 2e- = S2-
Для завершения октета на внешнем слое атомы серы принимают недостающие 2 электрона и в состоянии S2- образуют ионные и ковалентные связи с водородом, металлами и некоторыми неметаллами.
1) Сера непосредственно соединяется с большинством Me (кроме Pt, Au), образуя сульфиды. С некоторыми Me реакция протекает при обычной температуре, например:
S + Сu = CuS
S + 2Ag = Ag2S
S + Hg = HgS
С железом и многими другими Me сера реагирует при нагревании:
S + Fe = FeS
S + Н2 = H2S сероводород
2S + С = CS2 сероуглерод
3S + 2Р = P2S3 сульфид фосфора (III)
Сера – восстановитель:
S – 4e- = S+4; S – 6e- = S+6
В соединениях с более ЭО элементами атомы серы находятся в положительно заряженном состоянии.
Непосредственно сера не взаимодействует с азотом и йодом.
Практически важными являются реакции соединения серы с кислородом. При обычных условиях сера горит на воздухе, окисляясь кислородом до диоксида серы:
S + O2 = SO2
Высший оксид SO3 образуется при окислении серы или SO2 кислородом в присутствии катализаторов:
2S + 3O2 = 2SO3 триоксид серы (оксид серы (VI)).
Сера непосредственно соединяется с фтором (при обычной температуре) и с хлором (расплавленная сера):
S + 3F2 = SF6 гексафторид серы
2S + Cl2 = S2CI2 дитиодихлорид серы
S2Cl2 + Cl2 = 2SCI2 дихлорид серы
Сильные окислители (HNO3, H2SO4 конц., К2Сr2O7 и др.) окисляют свободную серу до SO2 или H2SO4:
S + 2HNO3(разб.) = H2SO4 + 2NO↑
S + 6HNO3(конц.) = H2SO4 + 6NO2↑ + 2Н2O
S + 2H2SO4(конц.) = 3SO2↑ + 2Н2O
S + К2Сr2O7 = Сr2O3 + K2SO4
Диспропорционирование серы в растворах щелочей
3S+ 6NaOH = 2Na2S + Na2SO3 + 3Н2O
Источник
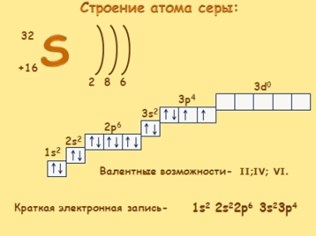
Электронное строение атома.
Сера относится к элементу, находящемуся в VI-й группе главной подгруппы периодической системы Д.И.Менделеева. Его электронная конфигурация атома 1s22s22p63s23p4.
Нахождение в природе.
В обычных условиях сера представляет собой лёгкие, жёлтые кристаллы, нерастворимые в воде, но хорошо растворимые в сероуглероде. Кристаллическая решётка серы – молекулярная, в узлах которой находится циклическая молекула S8. Сера имеет ряд аллотропных модификаций.
Вышеуказанная форма серы называется моноклинной серой, при охлаждении которой переходит в устойчивые кристаллы ромбической серы.
Если расплавленную серу влить в холодную воду, то образуется ещё одна аллотропная модификация – пластическая сера. Температура кипения серы +445оС. В парах расплавленной серы содержатся молекулы S8, S6, S4, S2.
В природе сера встречается в трёх формах:

1) Самородная сера
2) Сульфидная сера:
FeS2 – серный или железный колчедан, пирит.
CuS – медный блеск.
CuFeS2 – халькопирит или медный колчедан.
PbS – свинцовый блеск.
ZnS – цинковая обманка.
HgS – киноварь.
3) Сульфатная сера:
CaSO4x2H2O – гипс.
CaSO4xH2O – алебастр.
Na2SO4x10H2O – глауберова соль.
MgSO4x 7H2O – горькая соль.
Химические свойства.
1. Свойства простого вещества.
Сера может проявлять как окислительные, так и восстановительные свойства. Окислителем сера является в первую очередь по отношению к металлам:
S + 2Na = Na2S
S + Ca = CaS
3S +2Al = Al2S3
В качестве окислителя сера проявляет свои свойства и при взаимодействии с неметаллами:
S + H2 = H2S
3S + 2P = P2S3
2S + C = CS2
Однако с неметаллами, имеющими электроотрицательность бóльшую, чем у серы, она реагирует в качестве восстановителя:
S +3F2 = SF6
S + Cl2 = SCl2
Сера реагирует со сложными веществами, как правило, окислителями. Причём азотная кислота окисляет её до серной кислоты:
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
Другие окислители окисляют серу до степени окисления (+4):
S + 2H2SO4 = 3SO2 + 2H2O
3S + 2KClO3 = 3SO2 + 2KCl
По механизму реакции ДИСПРОПОРЦИОНИРОВАНИЯ сера реагирует с щелочами. В процессе этой реакции образуются соединения серы (-2) и (+4):
3S + 6KOH = K2SO3 + 2K2S + 3H2O
Непосредственно с водой сера не реагирует, однако при нагревании подвергается дисмутации в атмосфере водяного пара.
Сера может быть получена в процессе реакций:
SO2 + 2CO = S + 2CO2
Na2S2O3 + 2HCl = S + SO2 + 2NaCl + H2O
2. Соединения серы (-2).
У серы в степени окисления (-2) соединения называются сульфидами. Это бинарные соединения, в которых одним из элементов является металл: Na2S, ZnS, Al2S3, PbS2 и др.
Соединение серы (-2) с водородом называется сероводород – H2S. Сероводород – газ без цвета, неприятного запаха, тяжелее воздуха, очень ядовит, мало растворим в воде. Сероводород можно получить различными способами. Oбычно, в лаборатории, сероводород получают, действуя на сульфиды сильными кислотами:
FeS + 2HCl = FeCl2 + H2S
Для сероводорода и его солей характерны восстановительные свойства:
H2S + SO2 = 3S + 2H2O
В указанной реакции сера образуется по механизму конпропорционирования ( из двух атомов серы, имеющих различные степени окисления (-2) и (+4) образуется соединение серы со степенью окисления (0).
SO2 + 2CO = S + 2CO2
Na2S2O3 + 2HCl = S + SO2 + 2NaCl + H2O
В лаборатории сероводород получают:
FeS + 2HCl = FeCl2 + H2S
При сгорании в кислороде он образует различные продукты:
2H2S + O2 = 2H2O + 2S (недостаток кислорода)
2H2S + 3O2 = 2H2O + 2SO2 (избыток кислорода)
Cероводород легко окисляется галогенами, оксидом серы, хлоридом железа (III):
H2S + Cl2 = 2HCl + S
2H2S + SO2 = 2H2O + 3S
H2S + 2FeCl3 = 2FeCl2 + S + 2HCl
На воздухе сероводород окисляет серебро, чем и объясняется почернение серебряных изделий со временем:
2H2S + 4Ag + O2 = 2Ag2S + 2H2O
Водные растворы сероводорода являются слабой кислотой. Диссоциирует в две стадии, образует два типа солей: гидросульфиды и сульфиды:
H2S ↔ HS-1 + H+
HS-1 ↔ H+ + S-2
Сульфиды большинства металлов нерастворимы и имеют различную окраску. Это является фактором, благодаря которому можно распознавать те или иные катионы в растворах:
Чёрные – HgS, Ag2S, PbS, CuS, FeS, NiS;
Коричневые – SnS, Bi2S3;
Оранжевые – Sb2S3, Sb2S5;
Жёлтые – As2S3, As2S5, SnS2, CdS;
Розовые – MnS
Белые – ZnS, Al2S3, BaS, CaS;
Cульфиды в водной среде проявляют восстановительные свойства, обычно окисляясь до серы: 
3H2S + 2KMnO4 = 3S + 2MnO2 + 2KOH + 2H2O
H2S + 2HNO3 = S + 2NO2 + 2H2O
3H2S + 2FeCl3 = S + FeS + 6HCl
H2S + J2 = S + 2HJ
При взаимодействии с более сильными окислителями сульфиды окисляются до соединений со степенью окисления (+6):
H2S + 4H2O + Cl2 = H2SO4 + 8HCl
MnS + 3HNO3 = MnSO4 + 8NO2 + 4H2O
PbS + 4H2O2 = PbSO4 + 4H2O
3. Соединение серы (+4).
Из соединений серы со степенью окисления (+4) наиболее характерны оксид серы (SO2) или сернистый газ и сернистая кислота (H2SO3) и её соли. Оксид серы представляет собой газ с резким запахом, бесцветный, тяжелее воздуха, хорошо растворяется в воде. Получают при неполном горении сероводорода или при окислении сульфидов. В лаборатории его получают при взаимодействии меди с концентрированной серной кислотой:
Cu + H2SO4 = CuSO4 + SO2 + H2O
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
Для оксида серы (+4) характерны как окислительные:
SO2 + H2S = 3S + 2H2O
так и восстановительные свойства:
2SO2 + O2 = 2SO3
2SO2 + 2H2O + Br2 = H2SO4 + 2HBr
SO2 + Cl2 = SO2Cl2
SO2 + 2HNO3 = H2SO4 + 2NO2
Оксид серы (+4) – типичный кислотный оксид, он реагирует с основания-ми с образованием солей, с водой образует сернистую кислоту:
SO2 + 2NaOH = Na2SO4 + H2O
SO2 + H2O = H2SO3
Сернистая кислота – слабая кислота, диссоциирует в две стадии, образует два типа солей: кислые – гидросульфитыи средние –сульфиты :
H2SO3 ↔ HSO3- + H+
HSO3-↔ SO32- + H+
Соли сернистой кислоты неустойчивы, разлагаются при действии более сильных кислот и при нагревании:
Na2SO3 + HNO3 = 2NaNO3 + SO2 + H2O
K2SO3 = K2O + SO2
В растворах сульфит-ионы проявляют чаще всего восстановительные свойства:
Na2SO3 + 2KOH + KMnO4 = Na2SO4 + 2K2MnO4 + H2O
4. Соединения серы (+6)
Из соединений серы в степени окисления (+6) наиболее характерны оксид серы – SO3 или серный ангидрид и H2SO4 – cерная кислота. SO3 – бесцветный газ с характерным резким запахом, тяжелее воздуха, хорошо растворим в воде.
Оксид серы (+6) получают окислением оксида серы (+4) в присутствии катализатора и высоком давлении:
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
Оксид серы (+6) является сильным окислителем:
SO3 + 2KJ = J2 + K2SO3
SO3 + H2S = 4SO2 + H2O2
5SO3 + 2P = P2O5 + 5SO2
Кроме того, он проявляет кислотные свойства, так как является кислотным оксидом:
SO3 + ZnO = ZnSO4
SO3 + KOH = KHSO4
SO3 + 2KOH = K2SO4 + H2O
Серная кислота, её соли.
Серная кислота представляет собой бесцветную маслообразную жидкость, максимальная плотность которой 1,84 г/мл. Исходным сырьём для получения серной кислоты является серный колчедан или пирит:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Далее, под воздействием катализатора – V2O5 происходит окисление оксида серы (+4) до оксида серы (+6):
2SO2 + O2 = 2SO3
Полученная безводная серная кислота называется олеум, т.к. в действительности, оксид серы (+4) растворяют в 98%-ной серной кислоте.
SO3 + H2O = H2SO4
Концентрированная серная кислота проявляет сильное водоотнимающее действие. Это свойство положено в основу многочисленных химических процессов, особенно в органической химии (получение спиртов, простых и сложных эфиров, альдегидов и т.д.). Концентрированная серная кислота является сильным окислителем. Например, при взаимодействии с просты-ми веществами, она окисляет их до кислот или оксидов:
2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
C + H2SO4 = 2SO2 + CO2 + 2H2O
При обычной температуре она окисляет галогенводороды и сероводород:
H2SO4 + 8HJ = 4J2 + H2S + 4H2O
H2SO4 + 2HBr = Br2 + SO2 + 2H2O
H2SO4 + H2S = S + SO2 + 2H2O
Серная кислота термически устойчива и не летуча, поэтому способна вытеснять другие кислоты из их солей:
H2SO4 + KClO3 = KHSO4 + HClO4
Cерная кислота диссоциирует в две стадии, образует два типа солей:
кислые – гидросульфатыи средние – сульфаты:
H2SO4 ↔ HSO4- + H+
HSO4- ↔ SO42- + H+
Серная кислота проявляет свойства, характерные для остальных кислот: она реагирует с металлами, оксидами металлов, гидроксидами, солями слабых кислот. Качественной реакцией на сульфат-ионы в растворах является взаимодействие её с ионами бария Ва2+, в результате чего выпадает белый осадок:
Ba2+ + SO42- = BaSO4
При прокаливании сульфаты разлагаются на различные классы соединений в зависимости от металла, входящего в состав соли. Сульфаты щелочных металлов плавятся без разложения. Сульфаты металлов средней активности разлагаются на соответствующие оксиды:
ZnSO4 = ZnO + SO3
Сульфат железа (II) разлагается по механизму внутримолекулярной ОВР:
4FeSO4 = 2Fe2O3 + 4SO2 + O2
Сульфаты наиболее тяжёлых или малоактивных металлов разлагаются с образованием простых веществ – металла и кислорода:
HgSO4 = Hg + SO2 + O2
Некоторые сульфаты, являясь окислителями, реагируют с простыми веществами:
CaSO4 + C = CaO + SO2 + CO
BaSO4 + 4C = BaS + 4CO
Большое значение в промышленности, лабораторных исследованиях имеет взаимодействие серной кислоты с металлами. Эта тема заслуживает особого внимания, т.к. образуются различные продукты реакции в зависимости от положения реагируемого металла в ряду напряжений, степени разбавленности кислоты, температуры, катализаторов.
Разбавленная серная кислота с металлами, стоящими в ряду активности до водорода, при обычной температуре образует соль и водород:
H2SO4 + Zn = ZnSO4 + H2
Разбавленная кислота не реагирует с металлами, стоящими в ряду активности после водорода (медь, серебро, ртуть), но концентрированная кислота образует с ними соль, оксид серы (+4) и воду:
H2SO4 + Cu = CuSO4 + SO2 + H2O
Такие же продукты реакции концентрированная серная кислота образует при взаимодействии с металлами, стоящими в ряду активности до водорода:
2H2SO4 + Zn = ZnSO4 + SO2 + 2H2O
Однако, концентрированная серная кислота реагирует не со всеми металлами. Алюминий, железо, свинец и олово она пассивирует с образованием на их поверхности тонких оксидных плёнок, предотвращающих дальнейшее растворение металла:
H2SO4 + Al = Al2O3 + SO2 + H2O
Активные щелочные и щелочноземельные металлы могут образовывать с разбавленной кислотой не только водород. Например, магний с очень разбавленной серной кислотой на холоду образует соль, серу и воду:
H2SO4 + Mg = MgSO4 + S + H2O
Натрий при обычной температуре с очень разбавленной серной кислотой образует соль, серу и воду:
H2SO4 + Na = Na2SO4 + S + H2O,
а при охлаждении образует сероводород:
H2SO4 + Na = Na2SO4 + Н2S + H2O
Соли серной кислоты находят большое применение в промышленности, сельском хозяйстве, в быту.
Na2SO4x 10H2O – глауберова соль, применяется в медицине в качестве слабительного,
(NH4)2SO4 – азотное удобрение для сельского хозяйства,
CaSO4 – безводный гипс, применяется в строительстве.
CaSO4x 2H2O – водный гипс,
2CaSO4 xH2O – алебастр, продукт получения гипса,
MgSO4 – горькая соль, применяется в медицине как слабительное и гипотензивное средство,
BaSO4 – баритова каша, средство, применяемое как рентгеноконтрастное средство.
CuSO4 x 5H2O – медный купорос, применяется в строительстве,
FeSO4x 7H2O – железный купорос,
ZnSO4 x 7H2O – цинковый купорос,
KАl(SO4)2 x 12H2O – алюмокалиевые квасцы.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Источник
