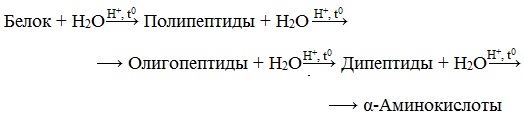Какие вы знаете конечные продукты гидролиза белков

Гидролиз – это распад сложного вещества (белка) на более простые составные части, связанный с присоединением по месту разрыва связей воды.
В зависимости от применяющегося катализатора различают гидролиз кислотный, щелочной, ферментативный. Промежуточными продуктами гидролиза являются поли-, олиго-, дипептиды и конечные продукты – аминокислоты.
Гидролиз является важным методом исследования, применяемым для расшифровки первичной структуры белка. При кислотном гидролизе разрушаются некоторые аминокислоты: триптофан разрушается полностью, а серин, треонин, цистин, тирозин, фенилаланин – частично, однако процент разрушения этих аминокислот невелик. При щелочном гидролизе отмечается более выраженное разрушение аминокислот.
Белковые гидролизаты применяются в качестве лечебных препаратов для парентерального питания. Например, церебролизин – продукт кислотного гидролиза мозгового вещества крупного рогатого скота, гидролизин – продукт такого же гидролиза фибриллярных сгустков и цельной крови крупного рогатого скота.
Структурная организация белка. Первичная, вторичная, третичная, четвертичная структура белка. Зависимость биологических свойств белка от особенностей строения белковой молекулы. Шапероны, биологическая роль.
Первичная структура – это последовательное соединение аминокислотных остатков в полипептидную цепь. Она стабилизируется пептидными связями между аминокислотами, обеспечивая прочность ковалентного состава полипептидной цепи. Каждый индивидуальный белок уникален своей первичной структурой. Она определяет последующие уровни организации белковой молекулы.
Вторичная структура – это способ свертывания, скручивания, упаковки полипептидной цепи в спиральную или другую конформацию. Она возникает самопроизвольно, автоматически, что зависит от набора аминокислот и их последовательности. Различают 2 типа вторичной структуры: 1-α-спираль и 2 – слоисто-складчатая (β-структура).
α-спираль имеет винтовую симметрию:
а) ход спирали стабилизируется водородными связями между пептидными группами каждого 1-го и 4-го остатка аминокислот.
б) регулярность витков спирали.
в) равнозначность всех аминокислотных остатков независимо от строения их боковых радикалов.
г) боковые радикалы не участвуют в образовании α-спирали.
Высота одного витка (шаг спирали) равна 0,54 нм, в него входят 3,6 аминокислотных остатка, период регулярности равен 5 виткам (18 аминокислотных остатка). Длина одного периода – 2,7 нм.
Очень много в α-спирали цистеина. Благодаря своей SH-группе он может образовать дисульфидные связи между витками спирали.
Другой тип вторичной структуры называется β-структурой. Этот вид обнаружен в белках волос, мышц, ногтей и других фибриллярных белках. Состав таких полипептидных цепей имеет складчатую структуру. Её стабилизируют водородные связи между пептидными группировками отдельных участков цепи, чаще двух или нескольких полипептидных цепей, расположенных параллельно. В β-складчатых слоях отсутствуют S-S-связи (в этих участках нет цистеина). Боковые радикалы выступают наружу по обе стороны складчатого слоя.
β-структура образуется только при наличии в составе цепей определенных аминокислот, в частности, аланина и глицина. В молекулах многих нативных белков одновременно присутствует α-спиральные участки и β-складчатые слои.
Третичная структура – это трехмерная пространственная организация полипептидной спирали, или способ укладки полипептидной цепи в объеме.
Стабилизируют эту структуру 4 типа внутримолекулярных связей:
1 – ковалентные дисульфидные связи между остатками цистеина;
2 – нековалентные водородные связи (между С=О и – ОН, –NH2, –SH-группами);
3 – электростатическое взаимодействие заряженных групп в боковых радикалах аминокислот (NН3+ и СОО-);
4- гидрофобные ван-дер-ваальсовые взаимодействия между неполярными боковыми радикалами аминокислот.
По форме третичной структуры белки делят на глобулярные (ферменты, транспортные белки, антитела, гормоны) и фибриллярные (структурные) (кератин волос, ногтей; коллаген соединительной ткани, эластин связок; миозин и актин мышечной ткани).
Третичная структура определяет нативные свойства белка.
Процесс сворачивания полипептидной цепи в правильную пространственную структуру получил название «фолдинг белков». Для многих белков, имеющих высокую Mr и сложную пространственную структуру, фолдинг протекает при участии специальной группы белков, которые называют «шапероны». Синтез и фолдинг бедков протекают при участии разных групп шаперонов, препятствующих нежелательным взаимодействиям белков с другими молекулами клетки и сопровождающих их до окончания формирования нативной структуры. Попадая в полость шаперонового комплекса, белок связывается с гидрофобными радикалами апикальных участков. В специфической среде этой полости, в изоляции от других молекул клетки происходит перебор возможных конформаций белка пока не будет найдена единственная энергетически наиболее выгодная конформация. При действии различных стрессовых факторов (температура, гипоксия, инфекция, УФО, изменение pH, действие тяжелых металлов и т.д) в клетках усиливается синтез БТШ. Имея высокое сродство к гмдрофобным участкам частично денатурированных белков, они могут препятствовать их полной денатурации и восстанавливать нативную конформацию белков.
Четвертичная структура – это способ укладки в пространстве нескольких полипептидных цепей, обладающих первичной, вторичной и третичной структурами, которые могут быть как одинаковыми, так и разными.
Примеры белков, обладающих четвертичной структурой: гемоглобин – 4 субъединицы; пируватдегидрогеназа – 72 субъединицы. Субъединицы связаны между собой ионными, водородными, дисульфидными связями.
Date: 2016-11-17; view: 2972; Нарушение авторских прав
Источник
Гидролиз – распад сложного вещества на более простые составные части, связанный с присоединением воды по месту разрыва связей. В зависимости от применяющегося катализатора различают кислотный, щелочной и ферментативный гидролиз.
Кислотный гидролиз осуществляется кипячением раствора белка в течение 16-92 часов, при температуре 1100с нормальным раствором кислоты. Щелочной гидролизпроизводится кипячением раствора белка в течение 4 – 8 часов, при 1100 с нормальным раствором NaOH. Ферментативный гидролиз происходит при участии ферментов протеиназ (пептидаз): трипсин, пепсин. В отличие от кислотного и щелочного гидролиза ферментативный гидролиз (протеолиз) наиболее специфичен, при нём ферменты расщепляют только определённые связи в белках. Окончание процесса гидролиза оценивают по двум признакам: а) отсутствие положительной биуретовой реакции на пептидные связи и б) окончание прироста концентрации аминогрупп и карбоксильных групп в гидролизате. Динамику прироста аминогрупп и карбоксильных групп определяют методом формольного титрования, связывая формальдегидом аминогруппы аминокислот, освобождающихся при гидролизе белка. Образовавшиеся при гидролизе аминокислоты идентифицируют методом хроматографического анализа, основанном на разных физико-химических свойствах аминокислот.
В организме гидролиз белка постоянно протекает в процессе как пищеварения, так и жизнедеятельности клеток под действием протеолитических ферментов. Действие протеолитических ферментов может быть разделено на две различные категории:
- ограниченный протеолиз, в котором протеаза специфически расщепляет одну или несколько пептидных связей в белке-мишени, что обычно приводит к изменению функционального состояния последнего: ферменты, например, при этом становятся активными, а прогормоны превращаются в гормоны;
- неограниченный или тотальный протеолиз, при котором белки распадаются до своих аминокислот.
При кислотном гидролизе белка разрушаются некоторые аминокислоты (триптофан подвергается полному разрушению, серин, треонин, цистин, тирозин, фенилаланин – частичному). При щелочномм гидролизе отмечается значительно более сильное разрушение аминокислот.
Продуктами полного гидролиза белков являются аминокислоты. В качестве промежуточных продуктов гидролиза образуются пептиды и полипептиды.
Биосинтез жирных кислот: этапы, последовательность реакций, ферменты.
Источником синтеза ЖК является малонил КоА, образующийся из ацетил КоА.
Образование малонил КоА из ацетил КоА.
Ацетил КоА поступает из матрикса митохондрий в цитоплазму с помощью карнитина и фермента ацетил КоА карнитинтрансферазы, которые переносят ацетильные остатки.
Стадии синтеза ЖК.
Синтез ЖК происходит на поверхности пальмитатсинтетазы- полфиерментный комплекс, состоящий из 7 ферментов. В центре комплекса –ацилпереносящий белок, который содержит две свободные SH-группы . А по периметру 6 остальных ферментов, каждый из которых выполняет определенные функции.
1)Перенос ацетила с ацетил КоА на синтетазу с участием ацетилтрансацилазы. Ацетил является затравкой в синтезе.
2)Перенос малоноила с малонил КоА на синтетазу с участием малонилтрансацилазы.
3)Конденсация ацетила с малонилом и декарбоксилирование образовавшегося продукта с участием бета-кетоацилсинтетаза.
4)Первое восстановление промежуточного продукта с участием НАДФН2.
5)Дегидратация промежуточного продукта с участием гидроксиацил-гидратазы.
6) Второе восстановление промежуточного продукта с участием НАДФН2.
Образуется бутирил, связанный с ферментом. Синтезированный бутирил переносится с участием ацетилртансацилазы на ту SH-группу, с которой вначале был связан затравочный ацетил. На освободившуюся SH-группу поступает новый малонильный остаток. Цикл синтеза повторяется.
Источник
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
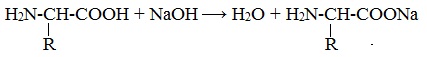
При действии же кислот он выступает в форме катиона:
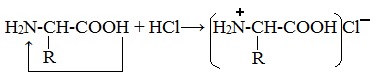
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
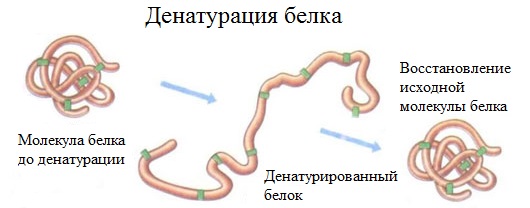
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-700С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.

![]()
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина: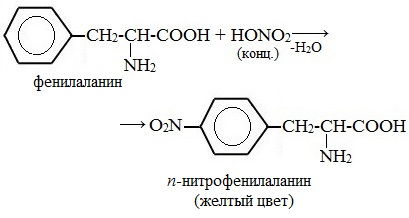
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.

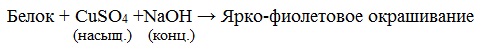
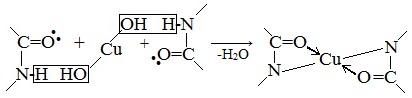
Причина появления окраски – образование комплексных соединений с координационным узлом: 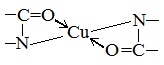
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)

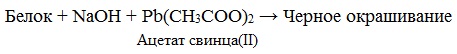
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Белки
Источник

Основные способы гидролиза белков:
– кислотный гидролиз
– энзимный (ферментативный) гидролиз
Кислотный гидролиз
При кислотном гидролизе исходное сырье обрабатывают определенными кислотами. Белок обрабатывают кислотой и нагревают. В результате молекулярные связи разрушаются и белки распадаются на отдельные аминокислоты. Кислотный гидролиз – это наиболее простой и дешевый способ дробления белка.
Недостатки кислотного гидролиза
Расщепление белка с помощью кислоты требует тщательного соблюдения технологии. При этом способе гидролиза очень важны качество реагентов и точность дозировок. При использовании неподходящих реагентов или при неправильных дозировках может произойти не только разрывание молекулярных связей, но и разрушение самих аминокислот. В этом случае конечный продукт гидролиза не будет иметь ценности для организма человека. Кроме того, в продукте могут содержаться опасные остатки солей и кислот.
Энзимный (ферментативный) гидролиз
Ферментативный гидролиз белков повторяет естественный процесс пищеварения в организме человека. На первом этапе белковое сырье подвергают легкой температурной обработке. В результате белок частично денатурирует (разрушается). После этого частично раздробленные белки смешивают с ферментами, которые «переваривают» белок до тех пор, пока он не распадется до аминокислот. При ферментативном гидролизе легко удалить излишки ферментов. В конечный продукт гидролиза не могут попасть опасные для человека вещества, так как они не используются ни на одном из этапов ферментативного гидролиза.
Преимущества белковых гидролизатов
Благодаря гидролизу можно получить аминокислотные комплексы, ценность которых гораздо выше, чем ценность исходного белка.
- При гидролизации белка увеличивается скорость и качество его усвоения.
- При дроблении бека на отдельные аминокислоты решаются многие проблемы с аллергическими реакциями и индивидуальной непереносимостью компонентов исходного белка. Пищевая аллергия – это реакция на специфические белки, содержащиеся в пищевых продуктах. В процессе гидролиза белки разрушаются до пептидов. Пептиды – это короткие фрагменты белка, которые не вызывают аллергических реакций.
Применение гидролизатов
- Гидролизаты используются в составе элитной косметики.
- Гидролизаты входят в состав специального питания для детей, которые из-за недостатка ферментов не могут усваивать лактозу, а также используются в питании детей, больных фенилкетонурией.
- Из гидролизатов изготовлены многие лекарственные препараты, например, кортексин и церебролизин. Эти препараты улучшают мозговой метаболизм, их принимают после инсульта.
Ферментативные гидролизаты из морепродуктов
Сырье, полученное из морепродуктов, обладает уникальными химическими свойствами. Благодаря полноценному аминокислотному составу и ряду важных компонентов гидролизаты белка, полученного из морепродуктов, можно использовать для профилактики многих болезненных состояний.
Многочисленные полезные свойства гидролизатов из морепродуктов использованы при разработке различных БАДов.
Гидролизаты хрящей лосося, кальмара, ската и акулы входят в состав биологически активной добавки Артрофиш.
Артрофиш – натуральный хондропротекторный комплекс, разработанный дальневосточными учеными.
Артрофиш эффективен при остеоартрозе (ОА), в том числе, при гонартрозе (артроз коленных суставов) и коксартрозе (артроз тазобедренных суставов), артрите, остеохондрозе, остеопорозе. При этих заболеваниях в первую очередь страдают суставы, что может приводить к потере трудоспособности и даже к тяжелой инвалидности.
Компоненты комплекса Артрофиш содержат натуральные вещества, питающие хрящевую ткань, способствующие ее регенерации.
Хотя полностью вылечить болезни суставов пока нельзя, можно предотвратить их возникновение или существенно замедлить развитие.
Уникальный натуральный препарат для усиления потенции и укрепления организма ЭКСТРА СИЛА содержит ферментативный гидролизат коллагена из трепанга и кукумарии. Комплекс усиливает потенцию за счет сосудорасширяющего эффекта, проявляет антимикробное, антигрибковое и противовоспалительное действие, повышает умственную и физическую активность, улучшает кровоснабжение мозга.
Рыбьи молоки в косметических и лекарственных средствах
Уникальные свойства рыбных молок лососевых рыб используют в косметических средствах. Питательные вещества из молок помогают сохранить молодость и здоровье кожи. Также молоки осетров используются в средствах, которые помогают улучшить мозговую деятельность и снизить последствия стрессовой нагрузки.
Ферментативный гидролизат молок лососевых рыб
Основой компонент гидролизата молок лососевых рыб – это дезоксирибонуклеиновая кислота (ДНК). ДНК обладает общеукрепляющим и противовирусным действием, повышает сопротивляемость организма к воздействию неблагоприятных факторов внешней среды, помогает справиться с болезнетворными микроорганизмами и ядовитыми веществами.
Гидролизат молок лососевых рыб повышает физическую и умственную работоспособность, улучшает сон, способствует быстрому восстановлению организма после болезни или тяжелых физических и интеллектуальных нагрузок.
Незаменимые качества молок лососевых рыб нашли применение при разработке ИммуноСтимула – оригинального сбалансированного комплекса натуральных биологически активных веществ (БАВ), обладающего общеукрепляющим, противовоспалительным и противовирусным действием. Компоненты комплекса ИммуноСтимул подобраны таким образом, чтобы максимально защитить организм от внутренних и внешних повреждающих воздействий.
Метод ферментативного гидролиза открывает широкие возможности для разработки новых перспективных продуктов на базе морских гидробионтов.
Источник