Какие вещества обладают физическими и химическими свойствами
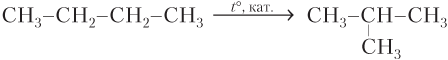
Разнообразие веществ
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.
Агрегатное состояние вещества
Вещества могут существовать в нескольких агрегатных состояниях, три из которых вам известны: твердое, жидкое, газообразное. Например, вода в природе существует во всех трех агрегатных состояниях: твердом (в виде льда и снега), жидком (жидкая вода) и газообразном (водяной пар). Известны вещества, которые не могут существовать в обычных условиях во всех трех агрегатных состояниях. Например, таким веществом является углекислый газ. При комнатной температуре это газ без запаха и цвета. При температуре –79°С данное вещество «замерзает» и переходит в твердое агрегатное состояние. Бытовое (тривиальное) название такого вещества «сухой лед». Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Это интересно: Химические свойства кислорода
Таким образом, можно сделать важный вывод. Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
- цвет – бесцветная (в небольшом объеме)
- запах – без запаха
- агрегатное состояние – при обычных условиях жидкость
- плотность – 1 г/мл,
- температура кипения – +100°С
- температура плавления – 0°С
- теплопроводность – низкая
- электропроводность – чистая вода электричество не проводит
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
- Существуют две большие группы веществ: вещества природного и искусственного происхождения
- В обычных условиях вещества могут находиться в трех агрегатных состояниях
- Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
- Кристаллы – твердые тела, имеющие форму правильных многогранников
- Аморфные вещества – вещества, не имеющие кристаллического строение
- Химические явления – явления превращений одних веществ в другие
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образующиеся в результате химической реакции
- Химические реакции могут сопровождаться выделением газа, осадка, тепла, света; изменением окраски веществ
- Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе химической реакции, сопровождающийся интенсивным выделением тепла и света (пламени)
Источник
Химия – наука о веществах, их свойствах, превращениях и явлениях, сопровождающих эти превращения.
Вещества – это то, из чего состоят предметы (физические тела) окружающего мира. Вещества, существующие в природе, постоянно претерпевают различные изменения.
Явления – различные изменения, которые происходят с веществами.
Физические явления – явления, не сопровождающиеся превращениями одних веществ, в другие (обычно изменяется агрегатное состояние веществ или их форма).
Химические явления – явления, в результате которых из данных веществ образуются другие.
Иначе химические явления называют химическими реакциями.
Каждое вещество обладает строго определёнными свойствами.
Свойства веществ – признаки, позволяющие отличить одни вещества от других, или установить сходство между ними.
Физические свойства:
m – масса, V – объём, ρ – плотность.
Масса может быть выражена в граммах, объем в миллилитрах (если это жидкость) или литрах (если это газ).
1 мл = 1 см3, 1 л = 1 дм3, 1000 л = 1 м3
Поэтому плотность измеряют в г/мл, г/см3 (если это жидкость), или в г/л, г/дм3 (если это газ).
Если принять V = 1, то плотность – это масса единичного объёма вещества.
Химические свойства – это те химические реакции, в которые вступает данное вещество.
Так же можно сказать, что химические свойства – это те химические реакции, которые характеризуют группу веществ (класс веществ). Например, мы будем в дальнейшем изучать свойства воды, свойства класса оксидов, свойства класса алканов и т.д.
ООсновы атомно – молекулярного учения
Идея о том, что вещества состоят из мельчайших частиц возникла в Древней Греции в философских учениях Левкиппа и его ученика Демокрита. Эти частицы они назвали атомами (неделимые).
Существование атомов было доказано эмпирическим путём в конце 16 – начале 17 века Джоном Дальтоном и М. В. Ломоносовым. Ими же были заложены основы атомно – молекулярного учения.
В настоящее время, в связи с открытием делимости атома и появлением теории химической связи, основные положения атомно – молекулярного учения существенно изменились. Его суть можно свести к ряду важных положений, которые необходимо запомнить.
Все вещества, существующие в природе, представляют собой совокупность очень большого числа частиц (атомов, молекул или ионов). В зависимости от типа частиц все вещества условно подразделяют на две группы: вещества молекулярного строения и вещества немолекулярного строения (атомного или ионного).
Вещества молекулярного строения – вещества, основной структурной единицей которых является молекула.
Вещества немолекулярного строения – вещества, основными структурными единицами которых являются атомы или ионы.
Частицы, из которых состоит данное вещество, взаимодействуют между собой посредством электромагнитных (кулоновских) сил и находятся в постоянном движении. Движение частиц ограничено силами взаимодействия между ними.Каждое вещество, в зависимости от условий (температуры, давления) может находиться в определённом агрегатном состоянии.
В твёрдом агрегатном состоянии вещества, составляющие его частицы находятся относительно упорядоченно (кристаллическое состояние), их кинетическая энергия (энергия движения) существенно меньше чем потенциальная (энергия покоя). В газообразном состоянии, частицы свободно движутся в предоставленном им объёме и их кинетическая энергия существенно выше чем потенциальная.
В жидкости же потенциальная энергия частиц примерно равна их кинетической энергии. Это связано с тем, что часть частиц жидкости находится относительно упорядоченно в составе так называемых кластеров(англ. cluster— скопление). Другие же частицы свободно перемещаются по объёму жидкости. Чем ниже температура жидкости, тем больше в ней кластеров и наоборот.
Рис. Кластеры воды, где число молекул 20-220
Следует отметить, что существуют еще два дополнительные “состояния”. Это жидкокристаллическое состояние и состояние плазмы.
Цитоплазматическая мембрана клетки – типичный пример жидкого кристалла. Молекулы фосфолипидов в биологической мембране относительно упорядоченно распределяются в двух слоях, но при этом могут в пределах слоя свободно перемещаться, а также “перескакивать” из одного слоя в другой.
Жидкие кристаллы имеют широкое применение в технике (напр., ЖК-мониторы компьютеров).
Плазма (от греч. πλάσμα «вылепленное», «оформленное») — ионизованный газ.
Плазма в своём составе содержит свободные электроны, катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы).
Так как плазма содержит заряженные частицы, то она проводит электрический ток и на неё можно воздействовать внешним магнитным полем. Различают низкотемпературную и высокотемпературную плазму.
Изучает свойства плазмы наука физика.
Вещество из одного агрегатного состояния может переходить в другие агрегатные состояния при изменении внешних условий – температуры (T) и давления (P). Такие переходы принято называть фазовыми переходами.
Так, при повышении температуры, твердое вещество превращается в жидкость, а жидкость при ещё большей температуре превращается в газ. Дальнейшее повышение температуры переводит газ в плазму. При таких переходах вещество в другие вещества не превращается. Напомним, что такие явления мы называем физическими. Поэтому фазовые переходы – это физические явления.
При понижении температуры происходят обратные фазовые переходы – газ превращается в жидкость, а жидкость переходит в твердое состояние.
Фазовые переходы имеют названия.
Твердое —> Жидкое (плавление, обратный переход – кристаллизация)
Жидкое —> Газообразное (испарение, обратный переход – конденсация)
Газообразное —> Плазма (ионизация, обратный переход – деионизация)
Твердое —> Газообразное (сублимация или возгонка, обратный переход – десублимация)
Вещество – совокупность большого числа частиц, находящаяся в определённом агрегатном состоянии в зависимости от условий (температуры и давления).
Поэтому, например, такая фраза как: “Вода – жидкое вещество”, является некорректной. Если мы говорим об агрегатном состоянии вещества, то следует обязательно уточнить условия в которых находится вещество – температуру и давление. Такая фраза как: “При нормальном атмосферном давлении и комнатной температуре, вода – жидкое по агрегатному состоянию вещество”, является правильной.
С точки зрения физики, что более точно, вещество – это форма материи, состоящая из частиц, обладающих массой покоя. Существуют частицы, не обладающие массой покоя, например, фотоны. Материя, состоящая из частиц, не обладающих массой покоя называется поле.
Протоны, нейтроны, электроны – это частицы, обладающие массой покоя, следовательно это частицы вещества. Но химия не изучает вещество, состоящее, к примеру, из электронов (электронный газ), или вещество, состоящее из нейтронов (нейтронный газ). Это удел физики.
Химия изучает вещества, состоящие из атомов, молекул или ионов.
Ввиду этого вещество условно можно подразделить на физическое (электронный газ в проводнике, нейтронный газ и т.д.) и химическое (состоящее из атомов, молекул, ионов, свободных радикалов).
Источник
1. Основные понятия, определения и законы химии
1.1. Вещество, его физические и химические свойства
Химия — наука о веществах, их строении, свойствах и превращениях.
В самом широком смысле вещество — это то, из чего состоят физические тела. Например, физическое тело «железный гвоздь» состоит из вещества железо. Физическое тело может состоять как из одного вещества (физическое тело «медная проволока» состоит из одного вещества — меди), так и из нескольких (физическое тело «автомобиль» состоит из различных металлов, пластмасс). Одно и то же вещество, в свою очередь, может образовывать несколько физических тел. Например: вещество вода образует айсберги, капли дождя, снежинки, иней; только из вещества железо состоят железные гвоздь, скрепка, проволока. В отличие от физического тела, понятие «вещество» абстрактное, вещество нельзя потрогать, нарисовать.
Вещество — только одна из форм материи. Вторая форма существования материи — поле. Поле — это материальная среда, посредством которой тела или частицы вещества взаимодействуют между собой. Примеры полей: гравитационное, электрическое, магнитное, ядерные силы. Вещество имеет дискретное (прерывистое, корпускулярное) строение, поскольку состоит из атомов, а поле однородно, непрерывно. Частицы поля (кванты), в отличие от частиц вещества, не имеют массы покоя (это означает, что они всегда находятся в движении). Характеристики поля: частота, потенциал, напряженность. Характеристики вещества: масса (покоя), размеры, плотность, окраска и т.д.
Традиционно физика и химия понятие «вещество» рассматривают по-разному. В физическом смысле веществом являются все материальные объекты, имеющие массу покоя; иными словами, это не только, например, порция воды массой 1 г, но и отдельно взятая молекула воды, а также любая элементарная частица — электрон, протон или нейтрон.
С химической точки зрения вещество — это устойчивая совокупность атомов, молекул или ионов:
- находящаяся в определенном агрегатном состоянии,
- обладающая некоторым набором постоянных при данных условиях физических и химических свойств.
Пример 1.1.
Укажите химические вещества: а) молекула воды; б) порция аммиака массой 10 г; в) соляная кислота; г) медный таз; д) порция метана объемом 1,12 дм3.
1) б, в, г, д; 3) а, б, в, д;2) б, в, д; 4) б, д.
Решение. Молекула воды является веществом только в физическом смысле, так как имеет массу, но не имеет определенного агрегатного состояния. Соляная кислота — это не вещество, а смесь HCl и H2O, медный таз — физическое тело. О веществах в химическом смысле говорится в случаях б), д).
Ответ: 4).
Физические свойства вещества — это набор определенных констант, характеризующих его агрегатное состояние, плотность, температуры плавления и кипения, цвет, растворимость, твердость, вязкость, летучесть, запах и вкус, теплопроводность, электрическую проводимость, магнитные и оптические свойства, диэлектрическую проницаемость и т.д.
Химические свойства вещества — это совокупность данных о том, с какими веществами и при каких условиях реагирует данное вещество и в какие другие вещества оно при этом превращается.
Например, физические свойства воды: бесцветная жидкость (обычные условия), без цвета, запаха и вкуса, плотность (н.у.) равна 1 г/см3, температуры кипения и плавления соответственно 100 °С и 0 °С, плохо проводит электрический ток. Химические свойства воды: взаимодействует с кислотными и основными оксидами, некоторыми металлами, при электролизе разлагается на водород и кислород.
Свойства вещества зависят от его состава и строения. Различают качественный и количественный состав вещества.
Качественный состав — это природа атомов, образующих вещество. Количественный состав — это число атомов каждого элемента в составе молекулы или в формульной единице вещества.
Например, вещество гидроксид натрия состоит из атомов натрия, кислорода и водорода (качественный состав), причем в формульной единице вещества, NaOH, мольное отношение атомов равно 1:1:1 (количественный состав).
Под строением вещества понимается природа его структурных единиц (молекулы — в случае веществ молекулярного строения или формульные единицы — для веществ немолекулярного строения), взаимное положение атомов и структурных единиц, длины связей, валентные углы, распределение электронной плотности в молекуле или формульной единице. Например, именно о строении идет речь, когда мы говорим, что вещество вода состоит из молекул, молекулы воды имеют угловое строение (валентный угол равен 105°), связь в молекуле ковалентная полярная.
Каждое вещество имеет свое название (названия). Названия бывают:
- международные (систематические): NaCl — хлорид натрия; KNO3 — нитрат калия; H2SO4 — сульфат водорода;
- традиционные (привычные): H2SO4 — серная кислота; H3PO4 — фосфорная кислота;
- специальные: NH3 — аммиак; H2O — вода; H2S — сероводород;
- тривиальные: олеум, норвежская селитра, угарный газ, пирит, галит, сусальное золото.
В зависимости от качественного состава вещества делят на простые и сложные. Простые вещества состоят из атомов одного элемента, причем число атомов в структурной единице простого вещества может быть разным: аргон Ar, медь Cu, водород Н2, кислород О2, белый фосфор Р4, ромбическая сера S8. Сложные вещества (химические соединения) состоят из атомов различных элементов. Например, вода Н2О, аммиак NH3, метан CH4. Сложные вещества, в отличие от простых, можно разложить на несколько других простых и/или сложных веществ:
2H2O →электролиз 2H2↑ + O2↑
2KNO3→t° 2KNO2 + O2↑
CaCO3→t° CaO + CO2↑
В свою очередь простые вещества делятся на неметаллы и металлы. Неметаллы, как правило, плохо проводят теплоту и электрический ток, при обычных условиях могут быть жидкими (бром), твердыми (кремний, бор, сера) или газообразными (водород, кислород, азот, хлор). Металлы (медь, железо, кальций) хорошо проводят электрический ток и теплоту, твердые при обычных условиях (кроме ртути), ковкие, непрозрачные.
Сложные вещества классифицируются:
- по происхождению (органические и неорганические);
- составу (бинарные, т.е. состоящие из атомов двух различных элементов — CaO, H2O, PH3, и многоэлементные, состоящие из атомов трех и более различных элементов — H3PO4, CH3COOH).
Бинарные вещества в свою очередь делятся на оксиды (CuO, K2O), нитриды (Ca3N2), фосфиды (Mg3P2), карбиды (CaC2), гидриды (NaH), галогениды (KCl, FeBr3) и халькогениды (K2S, CS2, Al2Se3).
Среди многоэлементных веществ различают соли, гидроксиды (кислородсодержащие кислоты, основания и амфотерные гидроксиды), комплексные соединения (K3[Al(OH)6], Na2[Zn(OH)4]) и кристаллогидраты (CuSO4 ⋅ 5H2O, Na2SO4 ⋅ 7H2O). Комплексные соединения содержат внешнюю и внутреннюю (указана в квадратных скобках) сферы. Частицы, образующие внутреннюю сферу соединения, очень устойчивы и в водных растворах существуют самостоятельно: [Al(OH)6]3−, [Zn(OH)4]2−.
При записи формул бинарных соединений вначале, как правило, записывается символ менее электроотрицательного элемента. Исключения: аммиак NH3, гидразин N2H4, углеводороды CH4, C2H2 и др., фосфин PH3.
Физические и химические явления
В природе с веществами происходят различные изменения (явления), которые принято классифицировать на химические и физические.
Физические явления — это изменения агрегатного состояния, скорости движения, температуры и формы тел. При этих явлениях новые вещества не образуются. Например, таяние снега, испарение воды, возгонка (сублимация) сухого льда СО2 (сублимация — переход вещества при нагревании из твердого состояния в газообразное, минуя жидкое).
К физическим явлениям относятся также ядерные реакции:
B510+n01→L37i+H24e
и радиоактивные превращения:
R88226a→R86222n+H24e
В этих процессах новые вещества хотя и образуются, однако это связано с изменением природы атомов.
Химические явления, или химические реакции — это изменения веществ, процесс их превращения в другие вещества, протекающий без изменения природы атомов (атомы в химических реакциях сохраняются).
В результате химических явлений могут изменяться:
- как качественный состав, так и строение веществ:
BaCl2 + H2SO4 = BaSO4 + 2HCl
- только строение веществ с сохранением качественного и количественного состава:
CH3–CH2–CH=CH2→t°, кат. CH3–CH=CH–CH3
C (алмаз) →t° C (графит);
- количественный состав (с сохранением качественного) и строение:
3O2 = 2O3
2NO → N2O4
1. В результате химических явлений молекулы (формульные единицы) разрушаются, а атомы не изменяются (сохраняются).
2. Ядерные реакции и радиоактивные превращения относятся к физическим явлениям.
Каждому химическому явлению сопутствует физическое, которое может быть зафиксировано непосредственно нашими органами чувств или специальными приборами. К числу важнейших физических признаков химических явлений относятся выделение газа, выпадение или растворение осадка, изменение окраски, выделение или поглощение теплоты, излучение света, появление запаха.
Следует иметь в виду, что само по себе каждое из отмеченных физических явлений еще не будет однозначным признаком химической реакции. Например, если ударить молотком по куску железа, то выделится тепло и железо нагреется (механическая энергия переходит в тепловую), однако новые вещества при этом не образуются. Откроем флакон с духами — появится запах, но и в этом случае новые вещества не образуются. Оба описанных явления относятся к физическим. Однозначный признак химической реакции — это образование новых веществ.
Закон сохранения массы вещества
Поскольку при химических реакциях атомы не исчезают и их природа сохраняется (новые атомы не образуются), то и общее число атомов до и после реакции остается неизменным. Отсюда следует закон сохранения массы в химических реакциях (М.В. Ломоносов, 1748; А. Лавуазье, 1789): масса веществ, вступивших в химическую реакцию, равна массе продуктов.
Отметим, что этот закон справедлив только в практическом смысле, так как из-за взаимосвязи массы и энергии выделение или поглощение теплоты (энергии) в химических реакциях должно приводить к тому, что массы исходных веществ и продуктов будут различаться. Оценим численное значение этого различия.
Связь массы и энергии выражается уравнением А. Эйнштейна:
Е = mc
2,
где c — скорость света (c = 3 ⋅ 108 м/с).
Отсюда следует, что изменение массы
Δm=ΔEc2.
Для химических реакций значение ΔЕ(Q) порядка нескольких сотен килоджоулей, поэтому при огромной скорости света значения Δm получаются чрезвычайно малыми (≈ 10−9 г) и не поддаются непосредственному измерению. (Изменение энергии огромно в ядерных реакциях, например процессах образования ядер атомов из протонов и нейтронов. Это приводит к так называемому дефекту масс, суть которого состоит в том, что масса ядра атома всегда меньше общей суммы масс составляющих его протонов и нейтронов.) Тем не менее, более правильно говорить о сохранении не только массы, но и энергии (т.е. материи) в химических реакциях:
суммарные масса и энергия веществ, вступающих в химическую реакцию, равны суммарным массам и энергии продуктов реакции.
Чистые вещества и смеси
В природе вещества встречаются как в индивидуальном виде (так называемые чистые вещества), так и (чаще) в виде смесей.
Смесь — система, состоящая из двух и более разных веществ, не изменяющих свои свойства в результате смешивания. Примеры смесей: молоко, бетон, дым, туман, пена.
1. Абсолютно чистых веществ в природе нет и быть не может.
2. Смеси к веществам не относятся.
Вещество считают чистым (индивидуальным), если содержание примесей в нем настолько мало, что практически не влияет на физические и химические свойства вещества.
Чистые сложные вещества следует отличать от смесей (табл. 1.1).
Таблица 1.1
Различия между смесями и сложными веществами
| Сложное вещество | Смесь веществ |
|---|---|
| Образуется в результате химической реакции | Образуется при смешивании |
| Физические и химические свойства отдельных веществ, из которых получено сложное вещество, не сохраняются | Физические и химические свойства веществ, образующих смесь, сохраняются (исключение — растворы) |
| Имеет определенный качественный и количественный состав, который может быть выражен химической формулой | Состав произвольный и не может выражаться определенной химической формулой |
| Разлагается на составные части только в химических реакциях | Можно разделить на составные компоненты сравнительно простыми физическими методами (выпаривание, фильтрование и т.д.) |
| Физические свойства постоянные | Физические свойства не постоянные |
Например, при нагревании железных опилок с серой образуется новое химическое вещество с определенным качественным и количественным составом — сульфид железа(II) FeS. В составе FeS химические свойства веществ железо и сера утрачены, не проявляются. Разложить сульфид железа(II) на отдельные простые вещества железо и серу простыми физическими методами нельзя. Плотность сульфида железа(II) постоянна, магнитом это вещество не притягивается.
Смешаем железные опилки и серу без нагревания. Во-первых, смешивать эти вещества можно в любых соотношениях (состав смеси произвольный и не имеет определенной формулы), во-вторых, железо и сера не утратили своих свойств (в составе смеси железо так же притягивается магнитом, как и индивидуальное железо); эту смесь можно разделить на отдельные компоненты с помощью магнита или воды (сера водой не смачивается и остается на ее поверхности), ее плотность не постоянна и возрастает с увеличением содержания железа.
Смеси делятся на однородные и неоднородные. В однородных (гомогенных) смесях отдельные компоненты нельзя различить не только невооруженным глазом, но и с помощью микроскопа. Однородными смесями являются растворы. В неоднородных (гетерогенных) смесях отдельные компоненты можно различить невооруженным глазом (смесь бензина и воды) или с помощью микроскопа (сливки). Неоднородные смеси часто называются механическими.
Из неоднородных смесей отдельные компоненты выделяют:
- отстаиванием (смесь воды и подсолнечного масла, воды и глины);
- фильтрованием (смесь воды и глины, воды и осадка BaSO4);
- с помощью магнита (смесь железных и древесных опилок, железа и серы).
Однородную смесь разделяют на отдельные вещества:
- выпариванием (смесь NaCl и H2O),
- дистилляцией (перегонкой); этот метод основан на различии температур кипения компонентов.
Примеры разделения однородных смесей методом перегонки:
а) нефть представляет собой смесь различных углеводородов. При постепенном нагревании нефти происходит ее разделение на отдельные фракции (процесс называется ректификацией) со все большей молярной массой углеводородов;
б) для получения азота и кислорода из воздуха последний предварительно повышением давления и понижением температуры переводят в жидкое состояние. Затем полученную жидкую смесь нагревают, вначале испаряется азот (его молекулы более легкие), оставшаяся жидкость представляет собой чистый кислород.
Примеры неоднородных смесей: томатный сок, шоколад, взвесь глины в воде, смесь железных и древесных опилок.
Примеры однородных смесей: нашатырный спирт — смесь NH3 и H2O; соляная кислота — смесь HCl и H2O; раствор этанола в воде.
