Какие свойствами обладают ферменты

Здравствуйте, уважаемые читатели блога KtoNaNovenkogo.ru. Ферменты (или энзимы) относятся к особому глобулярному классу белков, выполняющих функции биологических катализаторов.
Все биологические и химические процессы в клетках, благодаря ферментам, происходят при огромной скорости реакций. При этом сам фермент в этих процессах остается неизменным.
Ферменты — это…
Прежде чем приступить к лекции по теме ферментов, преподаватель одного из ВУЗов предложил студентам, для большего восприятия, послушать небольшую старинную притчу.
Перед смертью арабский старец разделил стадо из 17 верблюдов с чудесной белой шерстью на части, и в качестве наследства распределил между сыновьями. Старшему из сыновей завещал половину стада, средний — получал треть стада, младший сын получил – девятую часть.
После смерти отца перед сыновьями возникла проблема, как же разделить это количество верблюдов согласно завещанию, ведь число 17 нельзя поделить на 2 части, 3, либо 9 частей.
В это время по пустыне шел нищий, но мудрый монах (дервиш), ведя на поводке старого, черного, тощего верблюда. Заметив грустных братьев, поинтересовался чем те озабочены. И когда братья рассказали о полученном наследстве, которое не могут поделить, дервиш решил подарить им своего старого верблюда.
Когда верблюдов стало 18, их легко разделили. Старшему досталось – 9, средний получил – 6, а младший – 2. Черный верблюд дервиша остался лишним, и братья вернули его хозяину.
В этом случае роль ферментативного катализатора сыграл черный верблюд, но остался в прежнем статусе – собственностью дервиша.
Ферменты, либо энзимы, это молекулы белка, синтезируемые клетками организма. В составе каждой клетки имеется более сотни разновидностей энзимов.
При их помощи, в различных показателях температуры (5-40 градусов), характерных для определенного живого организма, реакции биохимических процессов протекают с очень большой скоростью.
Чтобы эти же процессы протекали не в живом организме, понадобились бы иные условия и критически высокая температура. Наши клетки бы в таких условиях погибли, так как для обеспечения их жизнедеятельности недопустимы какие-либо изменения в условиях их физиологического существования.
Благодаря своим свойствам ферменты получили статус биокатализаторов, веществ, ускоряющих процессы биохимических реакций в клетках, без которых они протекали бы в сотни, а то и в миллионы раз медленней.
Особенности и свойства ферментов
Сам термин «fermentum» означает – закваска. Его предложил голландский ученый В.Гельмонд еще в 17 веке.
Почти все белки в клетках, за исключением небольших фракций, являются энзимами, но это выявилось не сразу. Чтобы белковая «родословная» ферментов была признана на основе доказательной базы, необходимо было выделить их кристаллическую форму.
Первым это сделал в средине 20-х годов прошлого столетия американский ученый Д.Самнер, выделив кристаллы энзима, разлагающего мочевину – уреазу.
Лишь спустя десятилетия, пройдя длительный путь эволюции (что это?), удалось получить несколько разновидностей кристаллических ферментов и доказать их белковую природу.
Какими же свойствами обладают ферменты?
Несмотря на их огромное разнообразие, все ферменты на основании строения молекулярной кристаллической решетки разделяют на группы простых и сложных белков.
В основе сложной формы энзимов, кроме белковой фракции, присутствует так называемый кофактор, в виде добавочной небелковой группы происхождения, к примеру – различные варианты витамин.
В молекулярном составе простых белков (однокомпонентных) выделяется особая молекулярная часть энзимов, называемая активным центром. Он обеспечивает специфичность и каталитическую функцию фермента, благодаря уникальному сочетанию аминокислотных остатков.
Вступая в контакт с субстратом, реакция образует своеобразный комплекс с последующим его распадом на энзимы и вещества, образуемые после процессов реакции. По пространственной конфигурации субстрата и активного ферментативного центра они имеют точное соответствие, подобно тому как ключ подходит к отверстию в замке.
Наиболее эффективная активность ферментов, как, впрочем, и всех белков, отмечается лишь в нормальных естественных условиях и зависит от конкретных обстоятельств.
- Температуры — многие из ферментов проявляют активность лишь при определенных температурных показателях. К примеру, каталитическая активность (при среднем значении повышенной температуры до 50 С) увеличивается вдвое при каждом повышении температуры на 10 С. Но если температура превысит среднестатистическое значение, молекулярная структура белка нарушается и активность ферментативных реакций снижается.
- Определенного значения водородного показателя (рН), который индивидуален для каждого энзима и обеспечивает развитие его максимальной активности.
- Концентрации. Зависимости ферментативной реакции от количественной концентрации фермента и субстрата.
- Специфичности. Все энзимы специфичны к своему конкретному субстрату и катализируют, как правило, лишь одну определенную реакцию.
Именно ферментативная специфичность и тип катализирующей реакции лежат в основе классификации ферментов.
Классификация ферментов
Изначально многие ферменты носили упрощенные названия, не связанные часто с типом катализируемых реакций. Лишь в середине прошлого столетия была разработана и предложена систематическая номенклатура (что это такое?) и классификация ферментов на шесть главных классов.
Почти 3000 ферментов были распределены с учетом реакционной и субстратной составляющей и принципа катализирующего действия.
- Ферменты, входящие в класс оксидоредуктазы, катализируют различные окислительно-восстановительные реакции.
- Энзимы класса трансферазы ускоряют процессы переноса большинства функциональных кислотных группировок.
- Принадлежность к классу гидролазы характеризуется способностью расщепления веществ, состоящих из атомов различных химических соединений посредством обязательного наличия воды.
- Катализаторы группы лиазы расщепляют вещества без наличия жидкости, участвуют в процессах разрыва или присоединения веществ с кратными связями.
- Ферменты, относящиеся к группе изомеразы, обладают способностью превращения одних веществ в другие.
- Белковые фракции лигазы способны ускорять синтез различных сложных веществ (неорганических и органических групп) из простых веществ.
Для удобства пользования длинные названия ферментов заменили на более короткое рабочее обозначение, с опознавательным окончанием – аза, включающее название субстрата и тип ускоряемой реакции. Всем ферментам был присвоен классификационный шифр – КФ, включающий 4 цифры.
Первая – обозначает принадлежность к классу. Две последующих определяют тип подкласса и подподкласса. Последняя – порядковый номер элемента в определенном подклассе (к примеру, дегидрогеназа – КФ 1.3 99.3).
Практическая значимость энзимов
Практическую значимость ферментов трудно переоценить. Они применяются практически везде.
Используются для изготовления колбас, консервов, сыров и копченостей. Применяются для обработки зерновых культур и приготовления кормов. В кожевенной промышленности смягчают кожу. Являются составляющим компонентом чистящих средств, участвуют в огромном количестве химических процессов в различных производственных областях.
В медицине служат своеобразным диагностическим маркером развития патологических процессов – дисбаланс и признаки активности энзимов способствуют распознаванию природы различных заболеваний в организме.
Существование всего живого на земле обеспечивают процессы биохимических реакций с участием ферментативного катализа. Ферменты по праву считают основным источником здоровья и жизни любых живых организмов.
Автор статьи: детский врач-хирург Ситченко Виктория Михайловна
Удачи вам! До скорых встреч на страницах блога KtoNaNovenkogo.ru
Использую для заработка
- ВоркЗилла – удаленная работа для всех
- Анкетка – платят за прохождение тестов
- Etxt – платят за написание текстов
- Кьюкоммент – биржа комментариев
- Поиск лучшего курса обмена
- 60сек – выгодный обмен криптовалют
- Бинанс – надёжная биржа криптовалют
- ВкТаргет – заработок в соцсетях (ВК, ОК, FB и др.)
Источник
- Общие свойства ферментов
- Классификация
- Пищеварительные ферменты
- Роль заместительной терапии препаратом «Микразим»
Жизнь любого организма возможна благодаря протекающим в нем процессам обмена веществ. Этими реакциями управляют природные катализаторы, или ферменты. Другое название этих веществ – энзимы. Термин «ферменты» происходит от латинского fermentum, что означает «закваска». Понятие появилось исторически при изучении процессов брожения.

Рис. 1 — Брожение с использованием дрожжей – типичный пример ферментативной реакции
Человечество давно пользуется полезными свойствами этих ферментов. Например, уже много веков из молока с помощью сычужного фермента делают сыр.
Ферменты отличаются от катализаторов тем, что действуют в живом организме, тогда как катализаторы – в неживой природе. Отрасль биохимии, которая изучает эти важнейшие для жизни вещества, называется энзимологией.
Общие свойства ферментов
Ферменты представляют собой молекулы белковой природы, которые взаимодействуют с различными веществами, ускоряя их химическое превращение по определенному пути. При этом они не расходуются. В каждом ферменте есть активный центр, присоединяющийся к субстрату, и каталитический участок, запускающий ту или иную химическую реакцию. Эти вещества ускоряют протекающие в организме биохимические реакции без повышения температуры.
Основные свойства ферментов:
- специфичность: способность фермента действовать только на специфический субстрат, например, липазы – на жиры;
- каталитическая эффективность: способность ферментативных белков ускорять биологические реакции в сотни и тысячи раз;
- способность к регуляции: в каждой клетке выработка и активность ферментов определяется своеобразной цепью превращений, влияющей на способность этих белков вновь синтезироваться.
Роль ферментов в организме человека невозможно переоценить. В то время, когда еще только открыли структуру ДНК, говорили, что один ген отвечает за синтез одного белка, который уже определяет какой-то определенный признак. Сейчас это утверждение звучит так: «Один ген – один фермент – один признак». То есть без активности ферментов в клетке жизнь не может существовать.
Классификация
В зависимости от роли в химических реакциях, различаются такие классы ферментов:
Классы | Особенности |
Оксиредуктазы | Катализируют окисление своих субстратов, перенося электроны или атомы водорода |
Трансферазы | Участвуют в переносе химических групп из одного вещества в другое |
Гидролазы | Расщепляют крупные молекулы на более мелкие, добавляя к ним молекулы воды |
Лиазы | Катализируют расщепление молекулярных связей без процесса гидролиза |
Изомеразы | Активируют перестановку атомов в молекуле |
Лигазы (синтетазы) | Образуют связи с атомами углерода, используя энергию АТФ. |
В живом организме все ферменты делятся на внутри- и внеклеточные. К внутриклеточным относятся, например, ферменты печени, участвующие в реакциях обезвреживания различных веществ, поступающих с кровью. Они обнаруживаются в крови при повреждении органа, что помогает в диагностике его заболеваний.
Внутриклеточные ферменты, которые являются маркерами повреждения внутренних органов:
- печень – аланинаминотрансефраза, аспартатаминотрансфераза, гамма-глютамилтранспептидаза, сорбитдегидрогеназа;
- почки – щелочная фосфатаза;
- предстательная железа – кислая фосфатаза;
- сердечная мышца – лактатдегидрогеназа
Внеклеточные ферменты выделяются железами во внешнюю среду. Основные из них секретируются клетками слюнных желез, желудочной стенки, поджелудочной железы, кишечника и активно участвуют в пищеварении.
Пищеварительные ферменты
Пищеварительные ферменты – это белки, которые ускоряют расщепление крупных молекул, входящих в состав пищи. Они разделяют такие молекулы на более мелкие фрагменты, которые легче усваиваются клетками. Основные типы пищеварительных ферментов – протеазы, липазы, амилазы.
Основная пищеварительная железа – поджелудочная. Она вырабатывает большинство этих ферментов, а также нуклеаз, расщепляющих ДНК и РНК, и пептидаз, участвующих в образовании свободных аминокислот. Причем незначительное количество образующихся ферментов способно «обработать» большой объем пищи.
При ферментативном расщеплении питательных веществ выделяется энергия, которая расходуется для процессов обмена веществ и жизнедеятельности. Без участия ферментов, подобные процессы происходили бы слишком медленно, не обеспечивая организм достаточным энергетическим запасом.
Кроме того, участие ферментов в процессе пищеварения обеспечивает распад питательных веществ до молекул, способных проходить через клетки кишечной стенки и поступать в кровь.
Амилаза
Амилаза вырабатывается слюнными железами. Она действует на крахмал пищи, состоящий из длинной цепи молекул глюкозы. В результате действия этого фермента образуются участки, состоящие из двух соединенных молекул глюкозы, то есть фруктоза, и другие короткоцепочечные углеводы. В дальнейшем они метаболизируются до глюкозы в кишечнике и оттуда всасываются в кровь.
Слюнные железы расщепляют только часть крахмала. Амилаза слюны активна в течение короткого времени, пока пища прожевывается. После попадания в желудок фермент инактивируется его кислым содержимым. Большая часть крахмала расщепляется уже в 12-перстной кишке под действием панкреатической амилазы, вырабатываемой поджелудочной железой.
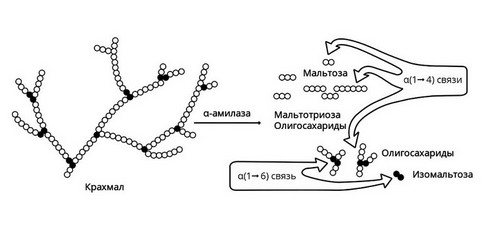
Рис. 2 — Амилаза начинает расщепление крахмала
Короткие углеводы, образовавшиеся под действием панкреатической амилазы, попадают в тонкий кишечник. Здесь с помощью мальтазы, лактазы, сахаразы, декстриназы они расщепляются до молекул глюкозы. Нерасщепляющаяся ферментами клетчатка выводится из кишечника с каловыми массами.
Протеазы
Белки или протеины – существенная часть человеческого рациона. Для их расщепления необходимы ферменты – протеазы. Они различаются по месту синтеза, субстратам и другим характеристикам. Некоторые из них активны в желудке, например, пепсин. Другие вырабатываются поджелудочной железой и активны в просвете кишечника. В самой железе выделяется неактивный предшественник фермента – химотрипсиноген, который начинает действовать только после смешивания с кислым пищевым содержимым, превращаясь в химотрипсин. Такой механизм помогает избежать самоповреждения протеазами клеток поджелудочной железы.
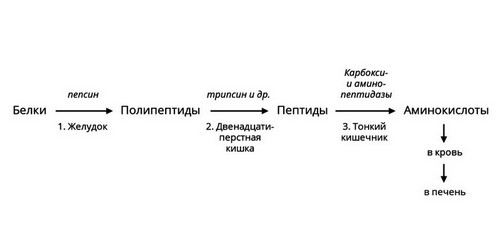
Рис. 3 — Ферментативное расщепление белков
Протеазы расщепляют пищевые белки на более мелкие фрагменты – полипептиды. Ферменты – пептидазы разрушают их до аминокислот, которые усваиваются в кишечнике.
Липазы
Пищевые жиры разрушаются ферментами-липазами, которые также вырабатываются поджелудочной железой. Они расщепляют молекулы жира на жирные кислоты и глицерин. Такая реакция требует наличия в просвете 12-перстной кишки желчи, образующейся в печени.
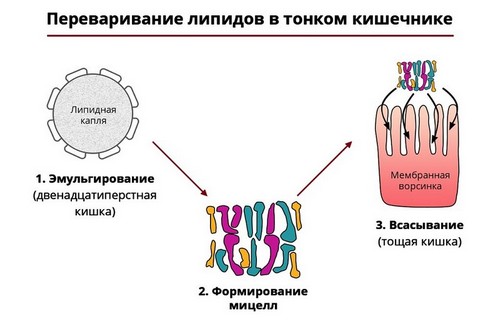
Рис. 4 — Ферментативный гидролиз жиров
Роль заместительной терапии препаратом «Микразим»
Для многих людей с нарушением пищеварения, прежде всего с заболеваниями поджелудочной железы, назначение ферментов обеспечивает функциональную поддержку органа и ускоряет процессы выздоровления. После купирования приступа панкреатита или другой острой ситуации прием ферментов можно прекратить, так как организм самостоятельно восстанавливает их секрецию.
Длительный прием ферментативных препаратов необходим лишь при тяжелой внешнесекреторной недостаточности поджелудочной железы.
Одним из наиболее физиологичных по своему составу является препарат «Микразим». В его состав входят амилаза, протеазы и липаза, содержащиеся в панкреатическом соке. Поэтому нет необходимости отдельно подбирать, какой фермент нужно использовать при разнообразных болезнях этого органа.
Показания для использования этого лекарства:
- хронический панкреатит, муковисцидоз и другие причины недостаточной секреции ферментов поджелудочной железы;
- воспалительные заболевания печени, желудка, кишечника, особенно после операций на них, для более быстрого восстановления пищеварительной системы;
- погрешности в питании;
- нарушение функции жевания, например, при стоматологических заболеваниях или малоподвижности пациента.
Прием пищеварительных ферментов с заместительной целью помогает избежать вздутия живота, жидкого стула, болей в животе. Кроме того, при тяжелых хронических заболеваниях поджелудочной железы Микразим полностью принимает на себя функцию по расщеплению питательных веществ. Поэтому они могут беспрепятственно усваиваться в кишечнике. Это особенно важно для детей, страдающих муковисцидозом.
Важно: перед применением ознакомьтесь с инструкцией или проконсультируйтесь с лечащим врачом.
Источник
Ферменты – органические катализаторы белковой природы, обладающие специфической способностью к активированию других веществ. Они участвуют практически во всех реакциях, протекающих в живом организме, в процессах обмена между организмом и внешней средой.
Ферменты – каталитически активные белки. Как и все белки, они состоят из аминокислот, которые связаны между собой пептидной связью. Из-за большого количества аминокислот молекулярная масса ферментов составляет от 10000 до 100000.
Свойства белка определяются в большей мере последовательностью соединения аминокислот. От нее зависит также пространственная организация пептидных связей, которая называется конформацией. От конформации зависит, обладает ли белок каталитической активностью, т.е. является ли он ферментом.
Ферменты могут находиться в свободном или частично связанном состоянии. Ферменты, которые находятся в свободном состоянии (растворенные в клеточном соке) – экзоферменты. Они выделяются клеткой в окружающую среду, где проявляют свое ферментативное действие. Связанные ферменты адсорбированы клеточными структурами, входят в состав цитоплазмы и называются эндоферменты. Они проявляют свое действие лишь внутри живых клеток и в окружающую среду не выделяются.
Вещества, которые подвергаются под действием ферментов различным химическим превращениям, называются субстратами.
Круг реакций, катализируемых ферментами, очень широк (реакции гидролиза, поликонденсации, окисления-восстановления, дегидрирования и др.). Это обусловлено их свойствами.
Ферменты обладают следующими основными свойствами.
Высокая каталитическая активность.1 молекула фермента за 1 мин может прогидролизовать огромное число молекул субстрата. Активность ферментов намного превышает активность неорганических катализаторов. Например, разложение перекиси водорода на воду и кислород может происходить благодаря каталитическому действию ионов железа или же ферментом каталазой, который также содержит железо. Каталитическая активность каталазы намного превосходит каталитическую активность ионов железа. В результате 1 моль ионов железа при температуре 0 0С в течение 1 с разлагает 10 -5 молей перекиси водорода, а такое же количество фермента каталазы при тех же условиях – 10 5 молей перекиси водорода.
За единицу активности принимается такое количество фермента, которое превращает 1 моль субстрата в течение 1 сек (реже в течение 1 мин или 1 час) при заданной температуре (чаще всего 30 °С).
Строгая специфичность.Каждый фермент действует на один или несколько схожих по строению субстратов, т.е. каждый фермент действует на определенное вещество или на определенный тип химической связи в молекуле. Например, β-фруктофуранозидаза действует только на сахарозу и не действует на другие родственные дисахариды, например мальтозу.
Специфичность действия обусловлена структурными особенностями молекул субстрата и фермента, в частности его активным центром. Если бы ферменты не обладали высокой специфичностью, то не происходило бы упорядоченного обмена веществ в организме.
Большая лабильность, т.е.чувствительность к внешним воздействиям среды: температуре, рН, концентрации продуктов обмена веществ, активаторов, ингибиторов и т.д. Для каждого фермента имеется свой температурный оптимум, действие их ограничивается либо присутствием, либо отсутствием кислорода и т.д. Этим также отличаются ферменты от неорганических катализаторов.
Классификация ферментов
Все ферменты по строению подразделяются на два больших класса:
простые (однокомпонентные) – ферменты, состоящие исключительно из белка, обладающего каталитическими свойствами;
сложные (многокомпонентные) – ферменты, состоящие из белковой и небелковой части. Небелковая часть необходима для того, чтобы фермент обладал активностью.
Белковая часть молекулы называется ферон, а небелковая – простетической группой или коферментом (это активный центр фермента). Ферон оказывает решающее действие на специфичность фермента, а соединение белка с простетической группой приводит к огромному возрастанию его каталитической активности.
В качестве простетической группы могут быть: ионы металлов, витамины и их производные, комплексные органические соединения или металлоорганические соединения. Примером многокомпонентных ферментов являются каталаза и пероксидаза, в которых кроме белка содержится еще и простетическая группа, в состав которой входит железо.
Простетическая группа может быть очень прочно связана с белком и эта связь не разрушается даже при жестких воздействиях. В других случаях простетическая группа может быть легко отделена от своего белка. Белковый компонент сложного фермента, лишенный своей простетической группы, называется апоферментом. Это потенциальный фермент, который приобретает свою активность только после добавления к нему соответствующего кофермента. Роль коферментов очень велика. Они осуществляют перенос отдельных атомов и групп в ходе ферментативного превращения, служат «связными» между отдельными родственными ферментами и обеспечивают их согласованную деятельность.
По типу катализируемой реакции (избирательности) все ферменты делятся на 6 основных классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы. Классы в свою очередь делятся на подклассы. Каждому ферменту присваивается свой номер, состоящий из четырех цифр.
Первая указывает на основной класс, вторая и третья обозначают подклассы, которые точнее определяют тип катализируемой реакции, четвертая является порядковым номером фермента в подклассе. Например, 3.2.1.1. 3 – класс гидролазы; 3.2 – указывает на то, что данные ферменты действуют на гликозидные соединения; 3.2.1 – указывает на то, что эти ферменты действуют на D-гликозидные соединения; 3.2.1.1 – конкретный фермент 1,4-α-D- глюкан глюканогидролаза (α-амилаза).
Оксидоредуктазы – (окислительно-восстановительные ферменты). Катализируют реакции окисления и восстановления (перенос атомов и электронов водорода), которые происходят при дыхании и брожении. К этим ферментам относятся дегидрогеназы (катализирующие процесс дегидрирования – отщепление молекулы водорода); оксидазы (осуществляющие реакции окисления, например, полифенолоксидаза – окисление полифенолов); пероксидаза (окисление происходит с участием перекиси водорода); каталаза (катализирует распад перекиси водорода).
Трансферазы – катализируют перенос различных групп от одного субстрата на другой. Представителями этого класса являются: метилтрансферазы (переносчики метильных групп); ацилтрансферазы (переносчики ацильных групп – альдегидных или кетонных); киназы (переносчики фосфорных групп).
Гидролазы – катализируют расщепление различных сложных органических соединений на более простые с присоединением воды. К ним относятся протеолитические ферменты, гидролизующие белки; гликозидазы, гидролизующие углеводы (амилазы, цитазы, пектиназы).
Лиазы – разрывают связи С-С, С-О, C-N с образованием двойных связей или осуществляют присоединение по двойным связям. Лиазы принимают участие в процессах брожения, дыхания, фотосинтезе и расщеплении жиров. Под действием этих ферментов происходит отщепление воды, углекислого газа (углерод-кислород лиазы), аммиака (аммиак-лиазы) с образованием двойной связи.
Изомеразы – катализируют реакции изомеризации. Этот класс сравнительно небольшой. В отличие от трансфераз, изомеразы катализируют перенос групп только внутри молекулы. К ним относятся: внутримолекулярные оксидоредуктазы (катализируют взаимные превращения альдоз и кетоз, перемещают –С=С- связи); внутримолекулярные трансферазы (переносят фосфорно-эфирные группы).
Лигазы (синтетазы) – катализируют присоединение друг к другу двух различных молекул с участием АТФ-источника энергии. Эти ферменты катализируют синтез полисахаридов, жиров, белков, нуклеиновых кислот, а также ряд промежуточных продуктов обмена веществ. Этот класс очень важен для промышленного производства, так как позволяет синтезировать органические вещества заданного строения. К этим ферментам относятся лигазы, образующие С-О связи (ферменты, катализирующие присоединение остатков аминокислот к транспортной РНК); С-S связи (ферменты, катализирующие присоединение остатков органических кислот к коферменту А); С-N связи (глютаминсинтетаза – катализирующая реакцию синтеза глютамина из глютаминовой кислоты и аммиака); С-С связи (карбоксилазы – катализируют присоединение углекислого газа к различным органическим кислотам, таким образом, удлиняя органическую цепочку).
Механизм действия ферментов
Специфичность и каталитическая активность ферментов обусловлены его активным центром – это та часть молекулы фермента, к которой присоединяется субстрат.
Молекула фермента представляет собой белковое тело сложной пространствен-ной конфигурации (рисунок 1). Деятельность каждого струк-турного элемента молекулы строго специализирована. Отдельные функциональные группы белка участвуют в связывании субстрата и в осуществлении его превраще-ний. Совокупность таких групп и участков называют активным центром. Причем, молекула белка свернута таким образом, что эти группы оказываются сближенными и создают благоприятную комбинацию реакционно-способных центров и групп для взаимодействия с субстратом. Периферийные участки полипептидной цепи фермента ответственны за поддержание его специфической пространственной конфигурации и за формирование активного центра.
В самом активном центре функции отдельных групп строго специализированы. Активный центр состоит из каталитического центра и пространственного центра связывания. Первый отвечает за химическую природу катализируемой реакции (специфичность действия), второй – за сродство к субстрату (субстратную специфичность).
Активный центр находится в полости ферментного белка, которая связывает субстрат. Эта область называется контактной, или якорной, площадкой фермента. Эта область непосредственно взаимодействует с субстратом и играет роль «посадочной» площадки. Специфичность взаимодействия фермента с субстратом определяется в значительной мере тем, что по своим очертаниям площадка напоминает молекулу субстрата. Так как размер активного центра значительно меньше остальной части молекулы фермента, то в контакте с субстратом находятся определенные функциональные группы – каталитически активный центр фермента. Остальная часть играет роль в формировании фермента в процессе синтеза.
Катализируемая ферментом реакция начинается с узнавания субстрата, которое происходит в процессе связывания.
Первый этап ферментативной реакции __ связывание субстрата, его расположение на молекуле фермента. Перед контактированием с ферментом в молекуле субстрата происходят изменения формы, которая точно «подгоняется» к форме активного центра (как «ключ к замку». Это обеспечивает высокую скорость и полноту реакции.
Далее следует сама ферментативная реакция. Реакционно-способные группы активного центра атакуют связанный субстрат и осуществляют с ним то или иное химическое превращение. При этом происходит перестройка конформации пептидной цепи ферментного белка таким образом, что образуются дополнительные связи между субстратом и реакционно-способными функциональными группами белка, которые катализируют расщепление субстрата. Это обеспечивает высокую скорость и полноту реакции.

Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
Источник
