Какие свойства вещества сохраняет молекула
Молекула — совокупность двух или более атомов, образующих наименьшее целое, на которое можно разделить чистое вещество, сохраняя при этом состав и его химические свойства (способность вступать в соединения, вкусовые свойства, свойства растворимости).
↪ Содержание: ↩
Молекула является одной из фундаментальных концепций современной науки. Впервые ввели эту концепцию европейские учёные в 1860 году, что послужило основой для развития химии, физики и ряду других естественных наук.
Молекула, по самому общему определению, — это частица, сформированная из нескольких (двух и более) атомов, связанных друг с другом ковалентной связью. Она не имеет электрического заряда, и все электроны в ее составе парные.
Молекулы, имеющие заряд, называются ионами, а непарные электроны — радикалами. Их качественный и количественный состав остается постоянным. Число ядер атомов, электронов и их взаиморасположение помогают различать молекулы разных веществ между собой.
Что такое молекула в физике
В физике термин молекула используется для описания характеристик газов, жидкостей и твердых тел. Мобильность молекул напрямую зависит от способности вещества к диффузии, его вязкости, теплопроводности и т. д. Впервые прямое экспериментальное подтверждение факта существования молекул получил французский физик Жан Перрен в 1906 году во время изучения броуновского движения.
Что такое молекула в химии
Для химической дисциплины изучение молекул играет одну из самых важных ролей. Благодаря химическим исследованиям была получена важнейшая информация о составе и характеристиках этой крошечной единицы материи.
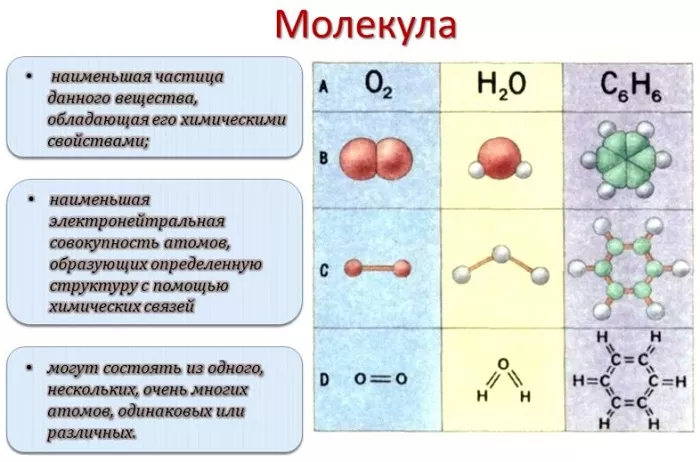
Молекула является:
- наименьшей частью одного вещества;
- наименьшим электрически нейтральным множеством атомов, которые образуют определенную структуру посредством химических связей;
- может представлять собой один, несколько или множество, как одинаковых, так и разнообразных атомов.
Когда молекулы проходят через химические превращения, они обмениваются атомами и распадаются. Именно поэтому знания о строении и состоянии данных частиц являются основой для изучения химии веществ и их преобразования.
Основываясь на имеющихся знаниях о происходящих химических реакциях, мы имеем возможность прогнозировать структуру молекул задействованных в них веществ. Верен и обратный вывод: на основании знаний о структуре молекулы вещества вполне реально прогнозировать его поведенческие характеристики в ходе химической реакции.
Строение молекулы
Физико-химические свойства молекул обусловлены их конструктивным строением. Таким образом, многие свойства можно предсказать на основе структурной формулы. К таким свойствам относятся размер, форма, в некоторой степени конформация молекул (т.е. взаимное расположение отдельных атомов), в момент, когда вещество находилось в растворе, и, в заключение, реакционная способность.
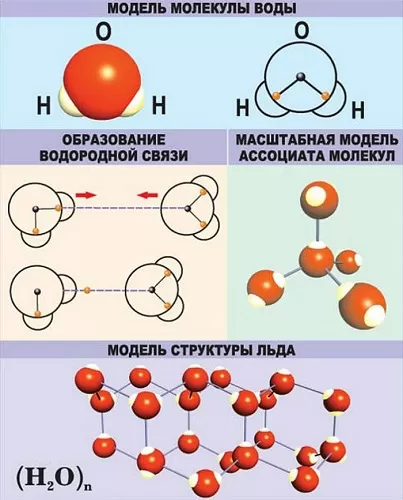
Молекула воды имеет угловую структуру: это равнобедренный треугольник с углом наклона в верхней части 104°5′. Масса молекулы воды в состоянии пара составляет 18 г/моль. Вместе с тем, уровень молекулярной массы воды в жидком состоянии выше. Это указывает на то, что молекулы в жидкой воде связаны водородными связями. Когда вода замерзает, она расширяется (поскольку образуется множество водородных связей), однако лед легче воды, всплывает на ее поверхность, «самая тяжелая вода» при значении +4°C.
Молекула полярна: атом кислорода несет частично отрицательный заряд, а два атома водорода несут частично положительный заряд. Это означает, что молекула воды является диполем. Поэтому взаимодействие молекул воды создает между ними водородные связи, которые сказываются на физических свойствах воды. Благодаря высокой полярности молекул вода является непревзойденным растворителем других полярных соединений. В воде распадается больше веществ, чем в других жидкостях.
Типы химической связи
- Металлическая — расположенные в узлах кристаллических решеток ядра атомов металла объединены единым массивом электронов.
- Водородная — обусловлена возможностью атома водорода формировать при смещении от него электронной плотности дополнительные связи.
- Ионная — носит электрическую сущность. Она высоко поляризована. Формируется за счет присоединения ионов, которые несут противоположный заряд.
- Ковалентная — бывает как полярной, так и неполярной. Она состоит из пары электронов, которые принадлежат двум атомам. Данная связь примечательна наивысшей стабильностью и энергетической ёмкостью.
Связи обозначаются нижеуказанными признаками:
- длина — степень, в которой ядра атомов, образовавших связь, удаляются друг от друга;
- энергия — величина силы, приложенной к разрыву соединения;
- полярность — сдвиг облака электронов в сторону одного из атомов;
- порядок или кратность — число электронных пар, которые образовали связь.
Структура молекул может быть представлена графически (структурной формулой). Главные взаимосвязи атомов в формуле обозначаются штрихами. В подобных структурах связи формируют целостную цепь и демонстрируют валентность элементов (атомов), которые их образовывали.
Структурные формулы также демонстрируют, каков внешний вид молекулы (линейный, циклический, наличие радикалов и т.д.).
В настоящее время интенсивно изучается структура частицы вещества. С этой целью применяются различные эксперименты и теоретические методы. Экспериментальные методы включают рентгеновский структурный анализ, спектроскопию, масс-спектрометрию и др. Теоретические методы включают методы расчета квантовой химии.
Масса (размер) молекулы
В соответствии с количеством ядер атомов могут быть выделены двух-, трехатомные и т.д. молекулы.
Mr — Относительная молекулярная (атомная) масса вещества — отношение массы молекул (или атомов) данного вещества к 1/12 массы атома углерода.
М — молярная масса — масса вещества, взятого в количестве одного моля.
M = Mr * 10-3 кг/моль
В случае большого количества атомов молекулу называют макромолекулой.
При сложении масс атомов, из которых состоит частица, определяется молекулярная масса. В зависимости от размера молекулярной массы, все химические вещества разделяются на низко- и высокомолекулярные.
Свойства молекулы
В современной науке отмечаются следующие свойства молекул:
- Электрические — эти свойства определяют поведение вещества в электрическом поле. Атомы, которые входят в состав молекулу, состоят из положительно заряженного ядра и электронов, несущих отрицательный заряд. Такие заряды внутри самой молекулы неравномерно распределены, что приводит к так называемому дипольному моменту и смещению электронной плотности в сторону какого-либо из атомов.
- Оптические — описывают поведение вещества в световолновом поле. Оптические свойства включают в себя способность к поляризации света, его преломлению и рассеиванию.
- Магнитные — объясняют распространение электронов в атомах.
Между веществами проводится разграничение:
- диамагнитные — без парных электронов;
- парамагнитные — присутствуют парные электроны.
Изучение свойств и структуры молекул имеет фундаментальное значение для развития теоретической и прикладной науки, а также играет важнейшую роль в жизнедеятельности человека.
Источник
Основной структурной единицей веществ, имеющих молекулярное строение является молекула. Молекула состоит из ограниченного числа атомов, связанных друг с другом ковалентными химическими связями. Заряд молекулы также как и атома равен нулю.
Объединяясь в молекулу, атомы образуют определённую 2D или 3D-структуру (треугольник, квадрат, тетраэдр, октаэдр и т.д.).
Молекула – электронейтральная частица вещества, состоящая из конечного числа атомов, связанных между собой ковалентными связями и имеющая определённую пространственную структуру.
Отметим, что в некоторых случаях вещество может состоять из химически несвязанных атомов, но при этом иметь “молекулярное строение”, например, все инертные газы. Для инертных газов понятия атом и молекула пересекаются.
Ковалентные связи между атомами образуются в результате обобществления атомами валентных электронов.
Валентные электроны – это электроны, принимающие участие в образовании химических связей.
Валентные электроны в атомах элементов главных подгрупп находятся на внешнем электронном слое. В атомах элементов побочных подгрупп часть валентных электронов находится на внешнем электронном слое, их там как правило 2, а иногда 1, с учётом эффекта провала электрона, а оставшаяся часть на d-подуровне предвнешнего электронного слоя.
При обобществлении валентных электронов атомами возникают общие электронные пары. Поэтому более точно, ковалентная связь – это связь, возникающая за счёт общих электронных пар.
Общие электронные пары могут возникать двумя способами: в результате обобществления неспаренных валентных электронов (обменный или коллигативный механизм) и в результате обобществления неподелённой электронной пары одного из атомов (донорно-акцепторный механизм). Более подробно речь об этих механизмах пойдёт в соответствующей главе.
Обобществление неспаренных электронов атомов водорода (обменный механизм образования ковалентной связи)
Валентный штрих Купера, показывающий общую электронную пару
Количество общих электронных пар, образуемых атомом принято называть его валентностью.
Валентность – это количество ковалентных связей атома с другими атомами.
Особо отметим, что если связи между атомами ковалентные, то это не свидетельство того, что вещество имеет молекулярное строение, т.е. состоит из молекул. Например, связи между атомами кремния и кислорода в SiO2 являются ковалентными, но SiO2 имеет атомное строение.
Чтобы однозначно определить имеет ли вещество молекулярное строение, необходимо знать его физические свойства: температуру кипения, температуру плавления и т.д. Вещества, имеющие молекулярное строение, как правило легкоплавки, имеют относительно низкую температуру кипения, так как связи между молекулами (межмолекулярное взаимодействие) достаточно слабые, имеющие низкие значения энергии.
Молекулы всегда имеют постоянный состав, поэтому и вещества молекулярного строения имеют постоянный состав, т.е. являются дальтонидами. Дальтониды подчиняются закону постоянства состава – закону Пруста (Ж. Л. Пруст, 1801—1808 гг.).
Для того, чтобы отразить состав молекулы применяют условную запись под названием химическая формула.
Химическая формула – условная запись, отражающая качественный и количественный состав веществ, имеющих молекулярное строение (условная запись состава молекулы).
Если вещество имеет немолекулярное строение (атомное или ионное), то его состав отражает формульная единица.
К примеру, если хлорид натрия находится при стандартных условиях, то он имеет ионное строение, а значит запись NaCl для кристаллического хлорида натрия не является химической формулой, а является записью формульной единицы.
При достаточно высоких температурах хлорид натрия можно перевести в газообразное агрегатное состояние, в этом случае резко повышается степень ковалентности связи. Это значит, что в газовой фазе существуют молекулы состава NaCl. На сей счёт имеются экспериментальные доказательства. Действительно, подобные молекулы в настоящее время удаётся получить, изолировав их друг от друга в твёрдом аргоне при температуре -2630 С. В приведённом примере запись NaCl является химической формулой, отражающей состав молекулы.
Во многих пособиях и учебниках до сих пор встречается определение молекулы, как наименьшей частицы вещества, обладающей его химическими свойствами.
Отметим, что данное определение является устаревшим и неправильным. Так молекулу определял Канницаро в 1860 году.
Ошибочность определения заключается в следующем.
Молекула не является наименьшей частицей вещества, так как существуют вещества атомного строения.
Молекула не является носителем химических свойств вещества, свойства обусловлены не единичной частицей, а их совокупностью, характером их взаимодействия.
Одна молекула тринитротолуола не обладает свойством взрывчатости, как даже две, три и большее их количество. Свойством взрывчатости будет обладать совокупность громадного числа молекул тринитротолуола – вещество.
Состав и строение молекулы определяют свойства вещества, но не молекула является носителем этих свойств.
Для наглядного изображения пространственного строения молекул применяют различные модели: шаростержневая модель, полусферическая модель Стюарта-Бриглеба, модель Драйдинга.
Источник
В уроке 3 «Молекулы и простые вещества» из курса «Химия для чайников» рассмотрим, что такое молекулы, простые вещества, а также металлы и неметаллы. Напоминаю, что в прошлом уроке «Относительная атомная масса химических элементов» мы рассмотрели разные способы выражения массы химических элементов.
Атомы химических элементов существуют в природе как в свободном, так и в связанном состоянии. Например, благородные газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe — находятся в воздухе в виде одиночных атомов. Атомы всех остальных элементов в природе не существуют изолированно друг от друга. Они всегда стремятся соединиться, связаться с другими атомами за счет особых сил. Почему? Так они достигают более устойчивого состояния. Это одна из иллюстраций всеобщего принципа природы — стремления к максимально устойчивому состоянию.
Что такое молекула?
Из курса физики вы уже немного знаете о молекулах — частицах вещества, состоящих обычно из двух и более атомов. Что же такое молекула?
Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулы благородных газов одноатомны, а молекулы таких веществ, как кислород, водород, азот, хлор, бром, состоят из двух атомов (рис. 34). Молекула фосфора содержит четыре атома, а серы — восемь (рис. 35).
Простые вещества
Если вещества состоят из атомов одного вида, то они относятся к простым веществам.
Простыми называются вещества, которые образованы атомами одного химического элемента.
Простые вещества — одна из форм существования химических элементов в природе. Простые вещества, состоящие из молекул, относятся к веществам молекулярного строения. При обычных условиях среди них есть газы (водород, кислород, азот, фтор, хлор, благородные газы), жидкости (бром) и твердые вещества (сера, иод, фосфор).
Элемент кислород существует в виде двух простых веществ молекулярного строения: одно из них (просто кислород) состоит из двухатомных молекул, а второе (озон) — из трехатомных.
Связываясь друг с другом, атомы образуют не только молекулы. Гораздо больше простых веществ, которые имеют немолекулярное строение. Они обычно представляют собой твердые кристаллические вещества, построенные из атомов, например кристаллы алмаза, графита, меди, железа (рис. 36).
Металлы и неметаллы
Простые вещества по их свойствам делят на металлы и неметаллы.
Все металлы при комнатной температуре являются твердыми веществами (за исключением ртути), которые проводят электрический ток и теплоту, имеют характерный металлический блеск. Многие из металлов пластичны, т. е. меняют свою форму при механическом воздействии. Благодаря этому свойству металлы можно ковать, расплющивать, вытягивать в проволоку.
Большинство простых веществ — металлы, и все они имеют немолекулярное строение.
Хотя простых веществ неметаллов гораздо меньше, по своим свойствам они различаются между собой значительно сильнее, чем металлы. Почти все они плохо проводят электрический ток и теплоту. Многие из неметаллов при обычных условиях являются хрупкими твердыми веществами (рис. 37), другие — газами (рис. 38), а бром — жидкостью (рис. 39). Большинство неметаллов существует в виде молекул, но некоторые имеют немолекулярное строение, например бор, углерод, кремний.
Алмаз и графит — это простые вещества, состоящие из атомов одного и того же химического элемента — углерода. Хотя они оба имеют немолекулярное строение, свойства этих веществ сильно отличаются: алмаз — прозрачное, самое твердое в природе вещество, а графит — темно-серое, непрозрачное, мягкое вещество (рис. 40). Их свойства различны потому, что различно строение их кристаллов, хотя состоят эти кристаллы из одних и тех же атомов — атомов углерода.
Названия простых веществ
В настоящее время известно более 400 простых веществ, хотя элементов пока открыто только 118. Названия большинства простых веществ такие же, как и названия соответствующих химических элементов. Только у элемента углерода простые вещества (как вы уже знаете) имеют собственные названия, да еще у элемента кислорода есть простое вещество озон.
Необходимо различать понятия простое вещество и химический элемент, поскольку в большинстве случаев их названия совпадают.
Химический элемент — это определенный вид атомов. Поэтому название химического элемента — это то, что объединяет атомы данного вида. У всех таких атомов есть общие черты. Каждый химический элемент обозначается с помощью соответствующего химического знака.
В то же время понятие простое вещество обозначает конкретное химическое вещество, образованное атомами одного вида. Оно характеризуется определенными составом, строением, физическими и химическими свойствами.
Например, если говорят о том, что в состав какого-то вещества входит азот, то имеют в виду атомы этого химического элемента, а когда говорят об азоте, который входит в состав воздуха, то, конечно, речь идет о простом веществе.
Более подробно о различии понятий «простое вещество» и «химический элемент» вы узнаете в главах 2, 3.
Краткие выводы урока:
- Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
- Простые вещества состоят из атомов одного химического элемента.
- Простые вещества имеют молекулярное или немолекулярное строение.
- Простые вещества делят на металлы и неметаллы.
Надеюсь урок 3 «Молекулы и простые вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Одним из основополагающих понятий современной науки является понятие молекулы. Его введение европейскими учеными в 1860 г. дало толчок к развитию не только химии и физики, но и других естественных наук.
Молекулой, в наиболее общем определении, называется частица, образованная из нескольких (двух или более) атомов, объединенных между собой ковалентными связями. Она не имеет электрического заряда, все электроны в её составе имеют пару.
Молекулы, несущие заряд, называются ионами, неспаренные электроны – радикалами. Качественный и количественный состав их стабилен. Количество ядер атомов, электронов и их взаимное расположение позволяют отличать молекулы разных веществ друг от друга.
Что такое молекула в физике
В физике этим понятием оперируют при изучении свойств разных сред (газы, жидкости) и твердых тел.

Также их свойствами объясняются явления диффузии, теплопроводности и вязкость веществ.
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.

При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
В качестве примера рассмотрим строение наименьшей частицы воды.
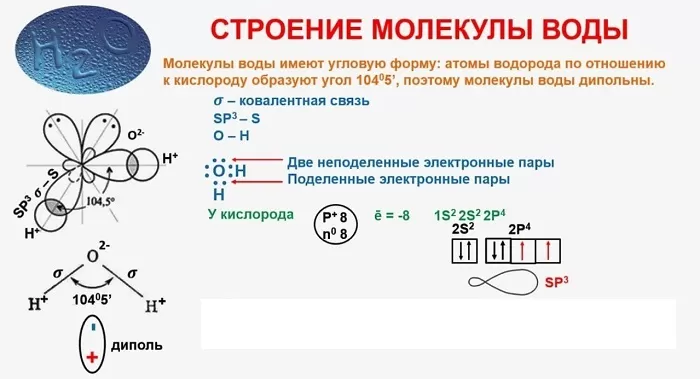
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
Металлическая – ядра атомов металлов, расположенные в узлах кристаллических решёток, объединены общим облаком электронов.
Водородная – основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
Ионная – имеет электрическую природу. Сильно поляризована. Возникает при притяжении ионов, несущих противоположный заряд.
Ковалентная – может быть полярной и неполярной. Образуется за счет пары электронов, совместно принадлежащей двум атомам. Отличается наибольшей устойчивостью и энергетической емкостью.
Связи характеризуются следующими показателями:
длина – степень удаления друг от друга ядер атомов, образовавших связь;
энергия – сила, прилагаемая для разрушения связи;
полярность – смещение электронного облака к одному из атомов;
порядок или кратность – количество пар электронов, образовавших связь.
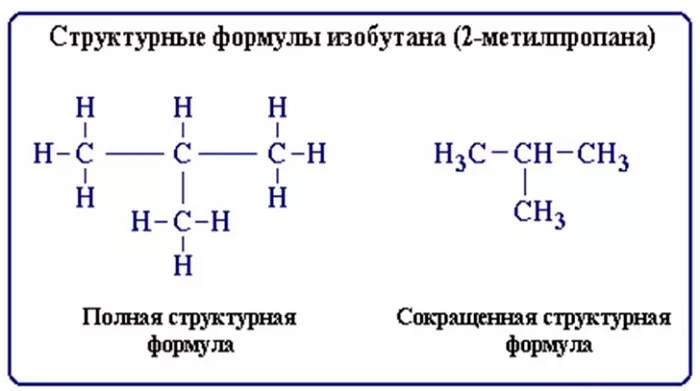
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Строение частицы вещества активно изучается. Для этого используют различные экспериментальные и теоретические методы. К экспериментальным относят рентгеновский структурный анализ, спектроскопия, массспектрометрия и др. К теоретическим – расчётные методы квантовой химии.
Масса (размер) молекулы
В зависимости о количества ядер атомов, входящих в их состав, можно выделить молекулы двухатомные, трехатомные и т. д.

В том случае, если количество атомов велико, молекула носит название макромолекулы.
Путем сложения масс атомов, входящих в состав частицы, можно определить молекулярную массу. В зависимости от её величины, все вещества делят на высоко- и низкомолекулярные.
Свойства молекулы

Современная наука выделяет следующие свойства молекул:
Электрические – этими свойствами определяется то, как ведет себя вещество в электрическом поле. Атомы, входящие в состав молекулы, состоят, в свою очередь, из положительно заряженного ядра и электронов, несущих отрицательный заряд. Эти заряды внутри самой молекулы располагаются неравномерно, в связи с этим возникает так называемый дипольный момент и смещение электронной плотности в сторону одного из атомов.
Оптические – дают характеристику того, как ведет себя вещество в поле световой волны. К оптическим свойствам относят способность поляризовать свет, преломлять его и рассеивать.
Магнитные – объясняются распределением электронов в атомах.
Различают вещества:
диамагнитные – парных электронов нет;
парамагнитные – имеются непарные электроны.
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.
Источник
