Какие свойства вещества определяются ковалентным видом
Ковалентная связь, формирующая молекулу водорода H2 (справа), где два атома водорода перекрывают два электрона
Ковалентная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием (обобществлением) пары валентных (находящихся на внешней оболочке атома) электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Ковалентная связь включает в себя многие виды взаимодействий, включая σ-связь, π-связь, металлическую связь, банановую связь и двухэлектронную трёхцентровую связь[1][2].
С учётом статистической интерпретации волновой функции М. Борна плотность вероятности нахождения связывающих электронов концентрируется в пространстве между ядрами молекулы (рис.1). В теории отталкивания электронных пар рассматриваются геометрические размеры этих пар. Так, для элементов каждого периода существует некоторый средний радиус электронной пары (Å):
0,6 для элементов вплоть до неона; 0,75 для элементов вплоть до аргона; 0,75 для элементов вплоть до криптона и 0,8 для элементов вплоть до ксенона[3].
Характерные свойства ковалентной связи[править | править код]
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
- Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы.
Углы между двумя связями называют валентными.
- Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
- Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов.
По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
- Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
Однако, дважды лауреат Нобелевской премии Л. Полинг указывал, что «в некоторых молекулах имеются ковалентные связи, обусловленные одним или тремя электронами вместо общей пары»[4]. Одноэлектронная химическая связь реализуется в молекулярном ионе водорода H2+.
Молекулярный ион водорода H2+ содержит два протона и один электрон. Единственный электрон молекулярной системы компенсирует электростатическое отталкивание двух протонов и удерживает их на расстоянии 1,06 Å (длина химической связи H2+). Центр электронной плотности электронного облака молекулярной системы равноудалён от обоих протонов на боровский радиус α0=0,53 А и является центром симметрии молекулярного иона водорода H2+.
История термина[править | править код]
Термин «ковалентная связь» был впервые введён лауреатом Нобелевской премии Ирвингом Ленгмюром в 1919 году[5][4].
Этот термин относился к химической связи, обусловленной совместным обладанием электронами, в отличие от металлической связи, в которой электроны были свободными, или от ионной связи, в которой один из атомов отдавал электрон и становился катионом, а другой атом принимал электрон и становился анионом.
Позднее (1927 год) Ф. Лондон и В. Гайтлер на примере молекулы водорода дали первое описание ковалентной связи с точки зрения квантовой механики.
Образование связи[править | править код]
Ковалентная связь образуется парой электронов, поделённой между двумя атомами, причём эти электроны должны занимать две устойчивые орбитали, по одной от каждого атома[6].
A· + ·В → А: В
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет ни чем иным, как энергией связи).
Заполнение электронами атомных (по краям) и молекулярных (в центре) орбиталей в молекуле H2. Вертикальная ось соответствует энергетическому уровню, электроны обозначены стрелками, отражающими их спины.
Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО. Обобществлённые электроны располагаются на более низкой по энергии связывающей МО.
Образование связи при рекомбинации атомов[править | править код]
Атомы и свободные радикалы склонны к рекомбинации — образованию ковалентной связи путём обобществления двух неспаренных электронов, принадлежащих разным частицам.
Образование связи при рекомбинации сопровождается выделением энергии. Так, при взаимодействии атомов водорода выделяется энергия в количестве 436 кДж/моль. Этот эффект используют в технике при атомно-водородной сварке. Поток водорода пропускают через электрическую дугу, где генерируется поток атомов водорода. Атомы затем вновь соединяются на металлической поверхности, помещаемой на небольшое расстояние от дуги. Металл может быть таким путём нагрет выше 3500 °C. Большим достоинством «пламени атомного водорода» является равномерность нагрева, позволяющая сваривать очень тонкие металлические детали[7].
Однако, механизм межатомного взаимодействия долгое время оставался неизвестным. Лишь в 1930 г. Ф. Лондон ввёл понятие дисперсионное притяжение — взаимодействие между мгновенным и наведённым (индуцированными) диполями. В настоящее время силы притяжения, обусловленные взаимодействием между флуктуирующими электрическими диполями атомов и молекул носят название «Лондоновские силы».
Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости α и обратно пропорциональна расстоянию между двумя атомами или молекулами в шестой степени[8].
Образование связи по донорно-акцепторному механизму[править | править код]
Кроме гомогенного механизма образования ковалентной связи существует гетерогенный механизм — взаимодействие разноименно заряженных ионов — протона H+ и отрицательного иона водорода H-, называемого гидрид-ионом:
При сближении ионов двухэлектронное облако (электронная пара) гидрид-иона притягивается к протону и в конечном счёте становится общим для обоих ядер водорода, то есть превращается в связывающую электронную пару. Частица, поставляющая электронную пару, называется донором, а частица, принимающая эту электронную пару, называется акцептором. Такой механизм образования ковалентной связи называется донорно-акцепторным[9].
Распределение электронной плотности между ядрами в молекуле водорода одно и то же, независимо от механизма образования, поэтому называть химическую связь, полученную по донорно-акцепторному механизму, донорно-акцепторной связью некорректно.
В качестве донора электронной пары, кроме гидрид-иона, выступают соединения элементов главных подгрупп V—VII групп периодической системы элементов в низшей степени окисления элемента. Так, ещё Йоханнес Брёнстед установил, что протон не существует в растворе в свободном виде, в воде он образует катион оксония:
Протон атакует неподелённую электронную пару молекулы воды и образует устойчивый катион, существующий в водных растворах кислот[10].
Аналогично происходит присоединение протона к молекуле аммиака с образованием комплексного катиона аммония:
Таким путём (по донорно-акцепторному механизму образования ковалентной связи) получают большой класс ониевых соединений, в состав которого входят аммониевые, оксониевые, фосфониевые, сульфониевые и другие соединения[11].
В качестве донора электронной пары может выступать молекула водорода, которая при контакте с протоном приводит к образованию молекулярного иона водорода H3+:
Связывающая электронная пара молекулярного иона водорода H3+ принадлежит одновременно трём протонам.
Виды ковалентной связи[править | править код]
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь. Для её образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
- Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют многие простые вещества, например: О2, N2, Cl2.
- Если атомы различны, то степень владения обобществлённой парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь. Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образование семиполярной связи протекает в два этапа:
1. Перенос одного электрона от атома с неподелённой парой электронов к атому с двумя неспаренными электронами. В результате атом с неподелённой парой электронов превращается в катион-радикал (положительно заряженная частица с неспаренным электроном), а атом с двумя неспаренными электронами — в анион-радикал (отрицательно заряженная частица с неспаренным электроном).2. Обобществление неспаренных электронов (как в случае простой ковалентной связи).
При образовании семиполярной связи атом с неподелённой парой электронов увеличивает свой формальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу.
σ-связь и π-связь[править | править код]
Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании -связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
В молекуле этилена С2Н4 имеется двойная связь СН2=СН2, его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвёртого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют -связью.
В линейной молекуле ацетилена
Н—С≡С—Н (Н : С ::: С : Н)
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две -связи между этими же атомами углерода. Две -связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Все шесть атомов углерода циклической молекулы бензола С6H6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвёртых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные -связи, а единая -электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые.
Примеры веществ с ковалентной связью[править | править код]
Простой ковалентной связью соединены атомы в молекулах простых газов (Н2, Cl2 и др.) и соединений (Н2О, NH3, CH4, СО2, HCl и др.). Соединения с донорно-акцепторной связью — аммония NH4+, тетрафторборат анион BF4− и др. Соединения с семиполярной связью — закись азота N2O, O−-PCl3+.
Кристаллы с ковалентной связью — диэлектрики или полупроводники.
Типичными примерами атомных кристаллов (атомы в которых соединены между собой ковалентными (атомными) связями) могут служить алмаз, германий и кремний.
См. также[править | править код]
- Донорно-акцепторная связь
- Поляризация химической связи
- Ионная связь
- Металлическая связь
- Рекомбинация
Примечания[править | править код]
- ↑ March, Jerry. Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (англ.). — John Wiley & Sons, 1992. — ISBN 0-471-60180-2.
- ↑ Gary L. Miessler; Donald Arthur Tarr. Inorganic Chemistry (неопр.). — Prentice Hall, 2004. — ISBN 0-13-035471-6.
- ↑ Гиллеспи Р. Геометрия молекул. — М: “Мир”, 1975. — С. 49. — 278 с.
- ↑ 1 2 Л.Паулинг. Природа химической связи. — М.-Л.: Издательство химической литературы, 1947. — С. 16. — 440 с.
- ↑ I. Langmuir. Journal of the American Chemical Society. — 1919. — Т. 41. — 868 с.
- ↑ Полинг.Л., Полинг П. Химия. — «Мир», 1978. — С. 129. — 684 с.
- ↑ Некрасов Б. В. Курс общей химии. — 14. — М.: изд. химической литературы, 1962. — С. 110. — 976 с.
- ↑ Даниэльс Ф., Олберти Р. Физическая химия. — М.: «Мир», 1978. — С. 453. — 646 с.
- ↑ Ахметов Н. С. Неорганическая химия. — изд. 2-е перераб. и доп.. — М.: Высшая школа, 1975. — С. 60. — 672 с.
- ↑ Химический энциклопедический словарь / гл. ред. И. Л. Кнунянц. — М.: Сов. энциклопедия, 1983. — С. 132. — 792 с.
- ↑ Onium compounds IUPAC Gold Book
Литература[править | править код]
- «Химический энциклопедический словарь», М., «Советская энциклопедия», 1983, с.264.
Источник
- Длина связи
- Энергия связи
- Полярность связи
- Поляризуемость связи
- Насыщаемость связи
- Направленность связи
- Кратность связи
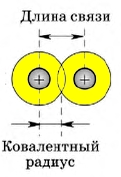
1. Длина ковалентной связи

Длиной ковалентной связи называют расстояние между ядрами атомов, которые образуют связь. Длина связи напрямую связана с радиусом атома – чем он больше, тем длиннее связь.
Значения ковалентных радиусов некоторых атомов (пм; 10-12 м):
- H = 30 пм;
- F = 58;
- O = 73;
- N = 75;
- C = 77;
- Cl = 99;
- S = 103;
- P = 110;
- Si = 118;
- Al = 130.
В симметричных молекулах (H2, F2, Cl2…) половину длины связи называют ковалентным радиусом. Зная ковалентный радиус, очень легко вычислять длину ковалентной связи в молекуле. Например, длина ковалентной связи молекулы HF = 30 + 58 = 88 пм.
2. Энергия ковалентной связи
Под энергией ковалентной связи (выражают в ккал/моль или кДж/моль) обычно понимают энергию, которая необходима для разрыва связи (при образовании ковалентной связи энергия выделяется, при разрыве – поглощается). Чем выше энергия связи, тем прочнее связь.
Энергия связи зависит от ее длины – чем длиннее связь в молекуле, тем проще ее разорвать (затратить меньше энергии).
Энергии связи некоторых молекул (кДж/моль):
- H2 = 453 (длина связи = 60 пм);
- Cl2 = 242 (198 пм);
- HCl = 431 (129 пм).
3. Полярность ковалентной связи
Данная характеристика отображает расположение электронной пары двух атомов, образующих связь. Степень полярности связи зависит от величины электроотрицательности атомов, образующих связь (чем она больше, тем больше полярность связи). У более полярной ковалентной связи общая пара электронов больше смещена к более электроотрицательному атому (см. понятие электроотрицательности).
Электроотрицателность является табличной величиной, определяемой по шкале Поллинга. Гораздо более важно знать не саму электроотрицательность атома как таковую, но разницу этих значений в молекуле – какой из атомов более электроотрицателен, а какой менее.
Полярность ковалентной связи оценивается количественно при помощи дипольного момента (µ), при этом система из двух равнозначных, но противоположных по знаку, зарядов, называется диполем.
Очень важно различать дипольный момент ковалентной связи (ее полярность) и дипольный момент молекулы в целом. В простых двухатомных молекулах эти два параметра равны между собой. Совсем другая картина наблюдается в сложных молекулах, в которых дипольный момент молекулы складывается из суммы векторов дипольных моментов отдельных связей.
4. Поляризуемость ковалентной связи
Поляризуемость отображает степень способности электронов смещаться под воздействием внешнего электрического поля, формируемого ионами или другими полярными молекулами.
Поляризуемость ковалентной связи прямо пропорциональна ее длине, что, в общем-то, логично – чем дальше от ядра атома находится электрон, тем он слабее им притягивается, поэтому, легче смещается при внешнем воздействии на него. Таким образом, с увеличением длины связи происходит увеличение ее поляризуемости, что, в свою очередь, приводит к возрастанию силы кислот (например, йодистоводородная кислота сильнее фтороводородной).
Поляризуемость и полярность связи являются обратнозависимыми величинами: менее полярная связь больше поляризуется, и наоборот.
5. Насыщаемость ковалентной связи
Насыщаемостью называют способность атома образовывать определенное кол-во ковалентных связей – в образовании связи стремятся принять участие все “неспаренные” электроны атома. Например, атом водорода имеет только один неспаренный электрон, а атом азота – три. По этой причине наиболее устойчивым химическим соединением будет NH3, но не NH или NH2.
6. Направленность ковалентной связи
Направленность характеризует пространственную ориентацию ковалентной связи относительно других связей молекулы. В молекулах электроны ковалентных связей и свободные пары электронов постоянно испытывают взаимное отталкивание в результате чего ковалентные связи располагаются так, что валентный угол между ними отвечает принципу наименьшего отталкивания между электронами (например, в молекуле воды валентный угол составляет 104,5°).
7. Кратность ковалентной связи
В некоторых случаях между атомами могут возникать не одна, а две (двойная связь) или три (тройная связь) общих электронных пар (так называемые кратные связи).
Двойная ковалентная связь образуется у атомов, имеющих по два неспаренных электрона; тройная – у атомов, имеющих по три неспаренных электрона (см. Множественные связи).
Как видно из таблицы, приведенной ниже, молекула азота примерно в 7 раз “крепче” молекулы фтора.
Таблица зависимости длины и прочности ковалентной связи от ее кратности:
| Молекула | F2 | O2 | N2 |
|---|---|---|---|
| Кратность связи | одинарная | двойная | тройная |
| Прочность связи (энергия), кДж/моль | 139 | 494 | 942 |
| Длина связи, пм | 141 | 121 | 109 |
Источник
