Какие свойства вещества фтора

Что такое фтор и какие свойства имеет?
Фтор – это химическое вещество, относящаяся к группе галогенов (символ F, атомный номер 9). Он является неметаллом и в чистом виде при нормальных условиях среды находится в газообразном состоянии, молекула состоит из двух атомов, пары имеют резкий запах и бледно-желтый цвет.
Фтор отличатся тем, что является самым активным электроотрицательным веществом, при этом ядовитым, способным нанести химические ожоги при контакте с кожей человека. Фтор активно взаимодействует с другими химическими элементами, создавая новые вещества и соединения.
В повседневной жизни мы сталкиваемся с этим веществом при употреблении пищи, воды, использовании зубной пасты и т. д. В человеческом скелете фтор находится в виде ионов, он укрепляет кости, делая их крепче. При употреблении большого количества фтора, он накапливается, кости становятся хрупкими, на зубах могут появиться пятна, вызванные флюорозом. Флюороз наблюдается чаще всего в местности, где его концентрация в питьевой воде превышает 10 промилле.
В чистом виде фтор опасен для человека, при взаимодействии с водой он образует фтористоводородную кислоту, проникающую сквозь ткани и разрушающую соединения кальция в костях. При этом фториды имеют ряд полезных и незаменимых для человека свойств, оберегающих его здоровье.
Как фтор используется в стоматологии?
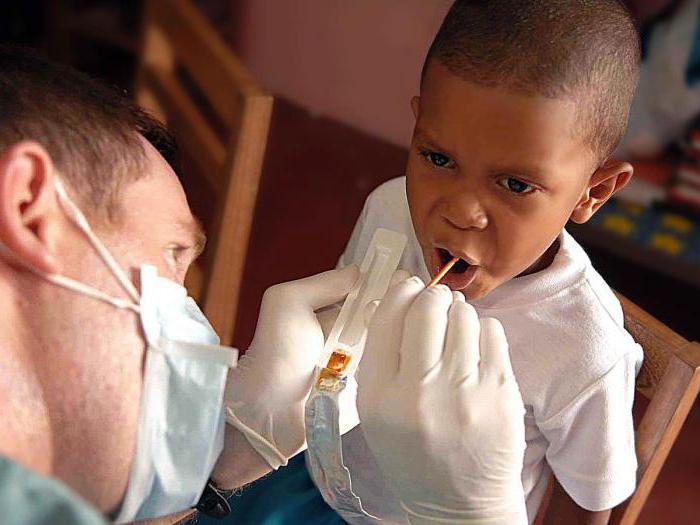
В современной стоматологии фтор активно применяется в виде фторидов, безлопастных для человека соединений фтора с другими элементами. Они способствуют предотвращению кариозных процессов на зубах. Фториды, взаимодействуя с эмалью зубов, образуют соединения, препятствующие проникновению кислот в более уязвимые слои зуба. Так же создается среда, негативная для развития микробов, восстанавливается обмен белков и минералов в костях и зубах. Для профилактики кариеса стоматологи рекомендуют фторированную воду, полоскания раствором фторидов, использование зубной пасты с фтором, нанесение на зубы гелей, покрытие зубов фтор-лаком, прием препаратов в виде таблеток. Все рекомендации назначаются в индивидуальном порядке в зависимости от состояния среды проживания пациента и его здоровья.
Фторирование зубов в стоматологии является распространенной процедурой, хорошо зарекомендовавшей себя как эффективное средство для профилактики кариеса. Фтор-лак имеет вязкую структуру, которая позволяет веществу оставаться на зубах до нескольких часов. Это время необходимо для закрепления фторидов на эмали и образования с ней устойчивого соединения. Препарат наносится на поверхность зубов, подсушенных ватным тампоном, не касаясь слизистой оболочки, удерживается в течение 4-5 минут. После процедуры рекомендуется только жидкая пища, чистить зубы не нужно.
При глубоком фторировании зубы полностью просушиваются, изолируется слизистая оболочка. Препарат втирается в зубы массирующими движениями и остается на несколько минут. При глубокой обработке зубы насыщаются микроэлементами и минералами. При этом перед фторированием необходимо провести чистку зубов и удалить весь зубной камень.
Плюсы фтора
- Фтор препятствует закреплению микробов на поверхности эмали, следовательно, не образуется зубной камень, который является основной причиной разрушения зубов.
- Фтор способствует расщеплению углеводов, которые образуют кислоту, разрушающую эмаль.
- Фтор образует соединение фтораппатит, который отвечает за проницаемость эмали, делает ее более устойчивой к воздействию кислот.
- Фтор препятствует размножению микробов в полости рта.
- Фтор взаимодействует с ионами кальция, делая зубы более плотными, укрепляя зубную решетку.
Минусы фтора
- Переизбыток фтора приводит к флюорозу, делает зубы крапчатыми, они теряют природную гибкость и эластичность, становятся ломкими.
- Переизбыток фторида натрия негативно отражается на нервной и кровеносной системе. Чаще он встречается в зубных пастах и гелях. Пациентам с заболеваниями почек или сахарным диабетом рекомендуется применять пасты и гели по рекомендации специалистов и не превышать норму.
- Избыток фтора негативно отражается на работе щитовидной железы. Токсичность вещества способно привести к снижению иммунитета, что сделает человека более уязвимым для различных заболеваний.
- Симптомами переизбытка фтора может стать повышена утомляемость, сухость и бледность кожи.
Как восполнить нехватку фтора в организме?
Фтор незаменим для человека и входит в состав клеток организма. Поддерживать баланс этого вещества важно для здоровья. При нехватке фтор можно восполнить, употребляя фторированную воду, применять зубную пасту или гели и медицинские препараты для профилактики кариеса. Стоматологические процедуры эффективно восполняют нехватку фтора в эмали зубов. Перед применением того или иного средства проконсультируйтесь со специалистом, чтобы установить подходящую именно для вас форму препарата и дозировку.
Ссылка на источник: https://king-smile.ru/article/ftor-polza-ili-vred-dlya-zubov/
Смотрите также:
—Рейтинг отбеливающих зубных паст — 2018
—Что делать, если режется зуб мудрости и болит десна?
—Как выбрать электрическую зубную щетку?
—Анестезия и седация в стоматологии
—Как ухаживать за несъемными зубными протезами ?
—Как выбрать брекеты?
—Атрофия костной ткани челюсти
—Нужно ли ставить временные коронки?
—Уход за зубами при диабете
Имеются противопоказания. Необходима консультация врача. Данный материал носит информационный характер и не является публичной офертой, определяемой положениями Статьи 437 (2) ГК РФ.
Источник
Фтор – химический элемент (символ F, атомный номер 9), неметалл, который относится к группе галогенов. Это самое активное и электроотрицательное вещество. При нормальной температуре и давлении молекула фтора является ядовитым газом бледно-желтого цвета с формулой F2. Как и другие галоиды, молекулярный фтор очень опасен и при контакте с кожей вызывает тяжелые химические ожоги.
Использование
Фтор и его соединения широко применяются, в т. ч. и для получения фармацевтических препаратов, агрохимикатов, горюче-смазочных материалов и текстиля. Плавиковая кислота используется для травления стекла, а плазма из фтора – для производства полупроводниковых и других материалов. Низкие концентрации ионов F в зубной пасте и питьевой воде могут помочь предотвратить кариес зубов, в то время как более высокие концентрации входят в состав некоторых инсектицидов. Многие общие анестетики представляют собой производные фторуглеводородов. Изотоп 18F является источником позитронов для получения медицинских изображений методом позитронно-эмиссионной томографии, а гексафторид урана используется для разделения изотопов урана и получения обогащенного урана для атомных электростанций.

История открытия
Минералы, содержащие соединения фтора, были известны за много лет до выделения этого химического элемента. Например, минерал плавиковый шпат (или флюорит), состоящий из фторида кальция, был описан в 1530 г. Георгием Агриколой. Он заметил, что его можно использовать в качестве флюса — вещества, которое помогает снизить температуру плавления металла или руды и помогает очистить нужный металл. Поэтому фтор название свое латинское название получил от слова fluere («течь»).
В 1670 году стеклодув Генрих Шванхард обнаружил, что стекло травится под действием фтористого кальция (плавикового шпата), обработанного кислотой. Карл Шееле и многие более поздние исследователи, в том числе Гемфри Дэви, Жозеф-Луи Гей-Люссак, Антуан Лавуазье, Луи Тенар, экспериментировали с плавиковой кислотой (HF), которую было несложно получить путем обработки CaF концентрированной серной кислотой.
В конце концов, стало понятно, что HF содержит ранее неизвестный элемент. Это вещество, однако, из-за его чрезмерной реактивности в течение многих лет выделить не удавалось. Его не только трудно отделить от соединений, но оно тут же вступает в реакцию с другими их компонентами. Выделение элементарного фтора из плавиковой кислоты чрезвычайно опасно, и ранние попытки ослепили и убили нескольких ученых. Эти люди стали известны как «мученики фтора».

Открытие и производство
Наконец, в 1886 году французскому химику Анри Муассану удалось выделить фтор путем электролиза смеси расплавленных фторидов калия и плавиковой кислоты. За это он был удостоен Нобелевской премии 1906 года в области химии. Его электролитический подход продолжает использоваться сегодня для промышленного получения данного химического элемента.
Первое масштабное производство фтора началось во время Второй мировой войны. Он требовался для одного из этапов создания атомной бомбы в рамках Манхэттенского проекта. Фтор использовался для получения гексафторида урана (UF6), который, в свою очередь, применялся для отделения друг от друга двух изотопов 235U и 238U. Сегодня газообразный UF6 необходим для получения обогащенного урана для ядерной энергетики.
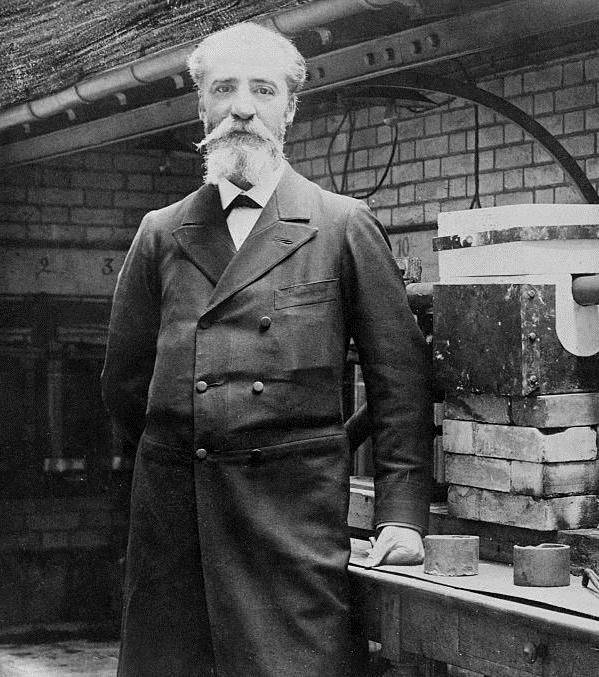
Важнейшие свойства фтора
В периодической таблице элемент находится в верхней части 17 группы (бывшая группа 7А), которую называют галогенной. К другим галогенам относятся хлор, бром, йод и астат. Кроме того, F находится во втором периоде между кислородом и неоном.
Чистый фтор – это коррозионный газ (химическая формула F2) с характерным резким запахом, который обнаруживается в концентрации 20 нл на литр объема. Как наиболее реактивный и электроотрицательный из всех элементов, он легко образует соединения с большинством из них. Фтор слишком реактивный, чтобы существовать в элементарной форме и имеет такое сродство с большинством материалов, включая кремний, что его нельзя готовить или хранить в стеклянных емкостях. Во влажном воздухе он реагирует с водой, образуя не менее опасную плавиковую кислоту.
Фтор, взаимодействуя с водородом, взрывается даже при низкой температуре и в темноте. Он бурно реагирует с водой, образуя плавиковую кислоту и газообразный кислород. Различные материалы, в том числе мелкодисперсные металлы и стекла, в струе газообразного фтора горят ярким пламенем. Кроме того, данный химический элемент образует соединения с благородными газами криптоном, ксеноном и радоном. Однако непосредственно с азотом и кислородом он не реагирует.
Несмотря на крайнюю активность фтора, сегодня стали доступны методы его безопасной обработки и транспортировки. Элемент может храниться в емкостях из стали или монеля (богатого никелем сплава), так как на поверхности этих материалов образуются фториды, которые препятствуют дальнейшей реакции.
Фториды – это вещества, в которых фтор присутствует в виде отрицательно заряженного иона (F-) в сочетании с некоторыми положительно заряженными элементами. Соединения фтора с металлами являются одними из наиболее стабильных солей. При растворении в воде они делятся на ионы. Другими формами фтора являются комплексы, например, [FeF4]-, и H2F+.

Изотопы
Существует множество изотопов данного галогена, начиная от 14F и заканчивая 31F. Но изотопный состав фтора включает только один из них, 19F, который содержит 10 нейтронов, так как только он является стабильным. Радиоактивный изотоп 18F – ценный источник позитронов.
Биологическое воздействие
Фтор в организме в основном содержится в костях и зубах в виде ионов. Фторирование питьевой воды в концентрации менее одной части на миллион значительно снижает частоту кариеса — так считают в Национальном исследовательском совете Национальной академии наук США. С другой стороны, избыточное накопление фтора может привести к флюорозу, который проявляется в крапчатости зубов. Этот эффект обычно наблюдается в местностях, где содержание данного химического элемента в питьевой воде превышает концентрацию 10 промилле.
Элементарный фтор и фтористые соли токсичны и с ними следует обходиться с большой осторожностью. Контакта с кожей или глазами следует тщательно избегать. Реакция с кожным покровом производит фтористоводородную кислоту, которая быстро проникает через ткани и реагирует с кальцием в костях, повреждая их навсегда.
Фтор в окружающей среде
Ежегодная мировая добыча минерала флюорита составляет около 4 млн т, а общая мощность разведанных месторождений находится в пределах 120 млн т. Основными районами добычи этого минерала являются Мексика, Китай и Западная Европа.
В природе фтор встречается в земной коре, где его можно найти в горных породах, угле и глине. Фториды попадают в воздух при ветровой эрозии почв. Фтор является 13-м по распространенности химическим элементом в земной коре – его содержание равно 950 промилле. В почвах его средняя концентрация – примерно 330 промилле. Фтороводород может выделяться в воздух в результате процессов горения в промышленности. Фториды, которые находятся в воздухе, в конечном итоге выпадают на землю или в воду. Когда фтор образует связь с очень мелкими частицами, то может оставаться в воздухе в течение длительного периода времени.
В атмосфере 0,6 миллиардных долей данного химического элемента присутствуют в виде солевого тумана и органических соединений хлора. В городских условиях концентрация достигает 50 частей на миллиард.

Соединения
Фтор – это химический элемент, который образует широкий спектр органических и неорганических соединений. Химики могут заменить им атомы водорода, тем самым создавая множество новых веществ. Высокореактивный галоген образует соединения с благородными газами. В 1962 году Нил Бартлетт синтезировал гексафторплатинат ксенона (XePtF6). Фториды криптона и радона также были получены. Еще одним соединением является фторгидрид аргона, устойчивый лишь при экстремально низких температурах.
Промышленное применение
В атомарном и молекулярном состоянии фтор используется для плазменного травления в производстве полупроводников, плоских дисплеев и микроэлектромеханических систем. Плавиковая кислота применяется для травления стекла в лампах и других изделиях.
Наряду с некоторыми из его соединений, фтор – это важная составляющая производства фармацевтических препаратов, агрохимикатов, горюче-смазочных материалов и текстиля. Химический элемент необходим для получения галогенированных алканов (галоны), которые, в свою очередь, широко использовались в системах кондиционирования воздуха и охлаждения. Позже такое применение хлорфторуглеродов было запрещено, поскольку они способствуют разрушению озонового слоя в верхних слоях атмосферы.

Гексафторид серы – чрезвычайно инертный, нетоксичный газ, относящийся к веществам, вызывающим парниковый эффект. Без фтора невозможно производство пластмасс с низким коэффициентом трения, таких как тефлон. Многие анестетики (например, севофлуран, десфлуран и изофлуран) являются производными фторуглеводородов. Гексафторалюминат натрия (криолит) применяется в электролизе алюминия.
Соединения фтора, в том числе NaF, используются в зубных пастах для предотвращения кариеса. Эти вещества добавляются в системы муниципального водоснабжения для фторирования воды, однако из-за воздействия на здоровье человека эта практика считается спорной. При более высоких концентрациях NaF используются в качестве инсектицида, особенно для борьбы с тараканами.
В прошлом фториды применялись для снижения температуры плавления металлов и руд и повышения их текучести. Фтор – это важный компонент производства гексафторида урана, который применяется для разделения его изотопов. 18F, радиоактивный изотоп с периодом полураспада 110 минут, излучает позитроны и часто используется в медицинской позитронно-эмиссионной томографии.
Физические свойства фтора
Базовые характеристики химического элемента следующие:
- Атомная масса 18,9984032 г/моль.
- Электронная конфигурация 1s22s22p5.
- Степень окисления -1.
- Плотность 1,7 г/л.
- Температура плавления 53,53 К.
- Температура кипения 85,03 К.
- Теплоемкость 31,34 Дж/(К·моль).
Источник
Из уроков химии нам известно, что фтор (как простое вещество) – это газ бледно-желтого цвета, с резким запахом, сильно токсичный. Как элемент Периодической Системы, фтор обладает наивысшей активностью. В ряду электроотрицательности неметаллов, фтор занимает крайне правое положение, а это означает, что его окислительная активность даже выше чем у кислорода. Это очень легко доказать. Например, если поместить бумагу или древесину в атмосферу фтора, они самовоспламенятся и быстро сгорят. Многие металлы так же воспламеняются в атмосфере фтора (например, алюминий и цинк).
Zn+F2 = ZnF2
2AL+ 3F2 = 2ALF3
Даже вода, которую поджечь казалось бы невозможно, в атмосфере фтора послушно загорается синим пламенем:
2F2 + 2H2O → 4HF + O2
История открытия фтора, берет свое начало в 1771 г., когда Карл Шееле впервые синтезировал плавиковую кислоту (HF). Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 г., а выделен лишь 76 лет спустя Анри Муассаном, при электролизе жидкого фтороводорода, содержащего примеси кислого фторида калия (KHF2).
До этого, из-за крайней агрессивности фтора, попытки многих химиков получить данное вещество в чистом виде, заканчивались неудачно и даже трагично. Первой жертвой Фтора был Гемфри Дэви. Затем умерли ирландские химики братья Нокс, повредили свое здоровье Тенар и Гей-Люссак из Франции, а так же погиб профессор Луйе из Бельгии.
Немудрено, что название данного элемента, Фтор, произошло от древнегреческого слова Ftoros – Разрушающий, Наносящий вред, Порча.
Однако, многие соединения фтора, были известны людям давно и нашли широкое применение в деятельности человека, например:
Флюорит (CaF2) – минерал, который может быть окрашен в различные цвета (голубой, синий, зеленый, желтый и др.). Его окраска зависит от дефектов кристаллической структуры, которая весьма чувствительна к различным внешним факторам. За способность данного вещества делать металлы более легкоплавкими, его называют так же плавиковый шпат.
Криолит (Na3[AlF6]) – редкий минерал из класса природных фторидов, обладающий свойствами схожими с плавиковым шпатом. Его и сегодня применяют во всем мире при выплавки алюминия.
Фторуксусная кислота (FCH2COOH) – фторорганическая карбоновая кислота, очень токсичная. Известно, что индейцы смачивали этим ядом наконечники копий и стрел. Спустя много лет химики установили, что этот яд очень похож на уксусную кислоту, но с атомом фтора вместо водорода. В природе, похожее соединение, фторацетат натрия (FCH2COONa) содержится в некоторых растениях семейства Дихапеталовые. В южной Африки, представители этого семейства растений ответственны за 8% смертности крупного рогатого скота.
В наши дни, соединения фтора так же широко используются в производстве, к примеру:
Фреоны – техническое название группы фторсодержащих производных насыщенных углеводородов (CH3F – фторметан, CH2F2 – дифторметан, CHF3 – трифторметан, CF4 – тетрафторметан и др.). Это хладагенты, находящие широкое применение в холодильной технике и при производстве кондиционеров. Фреоны так же образуют аэрозоли в миллионах баллончиков с дезодорантами, лаками и им подобными косметическими средствами. Однако, фреоны вырвавшиеся наружу устремляются в верхние слои атмосферы и разрушают озоновый слой.
Фтор повинен в создание атомной бомбы, так как летучие фториды урана единственное вещество пригодное для разделения его изотопов. Однако, это значит, что при помощи фтора производится и топливо для атомных электростанций, играющих ключевую роль в мировой энергетики.
Конечно же, ни для кого не секрет, что фтор, а точнее его соединения, входят в состав зубных паст и придают зубам завидную прочность.
Поэтому, несомненно, фтор можно считать одним из самых противоречивых элементов, который с одной стороны причиняет много вреда, а с другой, несет неоценимую пользу. Когда то Парацельс сказал: «Всё есть яд и всё есть лекарство. Только доза делает лекарство ядом и яд лекарством». Так же и с Фтором, все зависит от того, кто и как его использует.
Источник
