Какие свойства у растворимости

Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Все вещества в той или иной степени растворимы в растворителях. В случае, когда растворимость слишком мала для измерения, говорят, что вещество нерастворимо.
Зависимость растворимости веществ от температуры выражается с помощью кривых растворимости. По кривым растворимости производят различные расчёты. Например, можно определить массу вещества, которое выпадет в осадок из насыщенного раствора при его охлаждении.
Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация играет огромную роль в природе — приводит к образованию некоторых минералов, участвует в процессах, протекающих в горных породах.
Способы выражения характеристик растворимости[править | править код]
Характеристики растворимости подразделяются на качественные и количественные.
Качественные характеристики определяют мнение исследователя в отношении растворимости данного вещества — хорошо растворимо, плохо растворимо, мало растворимо, нерастворимо и т. п., и являются субъективными. Попытка сделать их более объективными была сделана в Государственной фармакопее СССР для обозначения растворимости лекарственных средств, но она не получила распространения.
Количественные характеристики определяют количество вещества, растворённого в данном количестве растворителя при данных условиях и обычно имеют размерности концентрации (моль/л, г/100 г растворителя, г/100 г раствора, г/кг растворителя, мольная доля и т. д.).
Качественная и количественная растворимость приводится в справочной литературе.
Влияние условий на растворимость[править | править код]
Для определения качественной растворимости часто используется эмпирическое правило «подобное растворяется в подобном». Это правило разные источники объясняют немного по-разному: полярные вещества растворяются в полярных растворителях, вещества имеющие гидроксильные группы хорошо растворяются в растворителях с гидроксильными группами и т. п.
Растворимость зависит от
- растворяемого вещества,
- растворителя,
- температуры,
- давления,
- наличия в растворителе других веществ.
Растворимость большинства газов растет с ростом давления и уменьшается с ростом температуры. Для твёрдых и жидких веществ влияние давления на растворимость менее значимо, чем для газов. Температура имеет различное влияние на различные системы «растворяемое вещество — растворитель», но в большинстве случаев при увеличении температуры растёт растворимость (обратной зависимостью обладают, например, многие соли кальция). Так как растворяемое вещество часто увеличивает температуру кипения растворителя, растворимость при атмосферном давлении может быть измерена и выше температуры кипения растворителя. При повышенном давлении и температуре растворимость может сильно увеличиваться (например, в воде при высоком давлении и температуре относительно хорошо растворяются углеводороды и кварц, которые почти нерастворимы при обычных условиях).
Наличие в растворителе других веществ может сильно влиять на растворимость. Примеры:
- добавление солей в водный раствор неполярных веществ может привести к выделению неполярного вещества в осадок, за счет эффекта высаливания,
- наличие растворённого кислорода сильно влияет на растворимость ртути в воде за счет эффектов поверхностного окисления,
- наличие небольшого количества влаги в абсолютном этаноле может сильно изменить растворимость неполярных веществ.
Энергетические эффекты при растворении[править | править код]
Растворение веществ часто происходит с разогреванием или охлаждением раствора.
Способы измерения растворимости[править | править код]
Самым старым способом измерения растворимости является растворение вещества до его выпадения в осадок, выдерживание такой смеси при определенной температуре, отделение осадка и вычисление растворившегося вещества.
В современных условиях для измерения очень малых значений растворимости часто пользуются хроматографическими системами.
При измерениях растворимости важно учесть все факторы, которые могут повлиять на растворимость.
Литература[править | править код]
- Химическая энциклопедия. — Т. 4. — М.: Большая российская энциклопедия, 1995
См. также[править | править код]
- Таблица растворимости (рус.)
- Произведение растворимости
- Константа равновесия
- Ионная жидкость
- Растворимость газов (рус.)
- Растворимость некоторых газов в воде при нормальных условиях (рус.)
Источник
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:

здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблице приведена растворимость некоторых веществ в воде при 20oС:
Вещество | Растворимость, г на 100 г H2O | Вещество | Растворимость, г на 100 г H2O |
NH4NO3 | 177 | H3BO3 | 6 |
NaCl | 36 | CaCO3 | 0,0006 |
NaHCO3 | 10 | AgI | 0,0000002 |
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Растворимость твердых веществ в жидкостях зависит от структуры твердого вещества (от типа кристаллической решетки твердого вещества). Например, вещества с металлическими кристаллическими решетками (железо, медь и др.) очень мало растворимы в воде. Вещества с ионной кристаллической решеткой, как правило, хорошо растворимы в воде.
Есть замечательное правило: “подобное хорошо растворяется в подобном”. Вещества с ионным или полярным типом связи хорошо растворяются в полярных растворителях. Например, соли хорошо растворимы в воде. В то же время неполярные вещества, как правило, хорошо растворяются в неполярных растворителях.
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20oС растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Температура различным образом влияет на растворимость твердых веществ в воде. В большинстве случаев растворимость твердых веществ возрастает с повышением температуры. Например, растворимость нитрата натрия NaNO3 и нитрата калия КNO3 при нагревании увеличивается (процесс растворения протекает с поглощением теплоты). Растворимость NaCl при увеличении температуры возрастает незначительно, что связано с почти нулевым тепловым эффектом растворения поваренной соли.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mр.в. = mр-ра⋅ωр.в. = 100⋅0,24 = 24 г
Масса воды равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
Определяем растворимость:
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Ответ: χ = 31,6 г
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
Ответ: 5,49М
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
* Материалы портала onx.distant.ru
Источник
Ñïîñîáíîñòüþ âåùåñòâà ïåðåõîäèòü â ðàñòâîð (ðàñòâîðÿòüñÿ) ÿâëÿåòñÿ åãî ðàñòâîðèìîñòü (êîíöåíòðàöèÿ íàñûùåííîãî ðàñòâîðà). Íà ðàñòâîðèìîñòü âëèÿþò ìíîæåñòâåííûå ôàêòîðû: ïðèðîäà âåùåñòâà, õàðàêòåð ðàñòâîðèòåëÿ, âíåøíèå óñëîâèÿ (òåìïåðàòóðà, äàâëåíèå). Ðàçäåëÿþò:
- ìàëîðàñòâîðèìûå âåùåñòâà (ðàñòâîðèìîñòü ìåíåå 1 ã íà 100 ã âîäû). Îòíîñÿò ãèïñ, ãàøåíóþ èçâåñòü.
- íåðàñòâîðèìûå âåùåñòâà (ìåíåå 0,1 ã íà 100 ã âîäû). Îòíîñÿò: ñóëüôàò áàðèÿ, áðîìèä ñåðåáðà, êàðáîíàò êàëüöèÿ;
- ëåãêîðàñòâîðèìûå âåùåñòâà (áîëåå 10 ã íà 100 ã âîäû). Ê òàêèì îòíîñÿò: ïîâàðåííóþ ñîëü, ìåäíûé êóïîðîñ, àììèàê).
Íåîáõîäèìî ïîìíèòü, ÷òî àáñîëþòíî íåðàñòâîðèìûõ âåùåñòâ íå áûâàåò.
Âëèÿíèå ïðèðîäû íà ðàñòâîðèìîñòü âåùåñòâ.
Èçäàâíà ñóùåñòâîâàëî ïðàâèëî: ïîäîáíîå ðàñòâîðÿåòñÿ â ïîäîáíîì. Ò.å. ñïèðòû â ñïèðòàõ, âîäíûå ðàñòâîðû – â âîäå, ïîëÿðíûå ñîåäèíåíèÿ (àëüäåãèäû è ò.ä.) – â ïîëÿðíûõ ðàñòâîðàõ.
Ðàñòâîðèìîñòü ãàçîâûõ ñìåñåé â æèäêîñòÿõ âàðüèðóåòñÿ â øèðîêèõ äèàïàçîíàõ. Íàïðèìåð, â 100 îáúåìàõ âîäû ìîæåò ðàñòâîðèòüñÿ 2 îáúåìà H2, 3 îáúåìà O2 è 700 îáúåìîâ NH3.
Ðàñòâîðèìîñòü æèäêîñòåé â æèäêîñòÿõ çàâèñèò âñåöåëî îò ïðèðîäû âåùåñòâ. Ìîäíî âûäåëèòü 3 êëàññà æèäêîñòåé:
1. Æèäêîñòè, êîòîðûå íåîãðàíè÷åííî ðàñòâîðÿþòñÿ äðóã â äðóãå (âîäû – ñïèðò, âîäà – óêñóñíàÿ êèñëîòà);
2. Æèäêîñòè, êîòîðûå ïî÷òè íå ðàñòâîðÿþòñÿ äðóã â äðóãå (âîäà – ðòóòü, áåíçîë);
3. Æèäêîñòè, êîòîðûå îãðàíè÷åííî ðàñòâîðÿþòñÿ äðóã â äðóãå (âîäà – ýôèð, àìèí è ò.ä.).
Ðàñòâîðèìîñòü òâåðäûõ âåùåñòâ â æèäêèõ ñðåäàõ çàâèñèò îò õàðàêòåðà õèìè÷åñêîé ñâÿçè â êðèñòàëëè÷åñêîé ðåøåòêå. Ìîëåêóëÿðíûå ñòðóêòóðû èìåþò ìàëóþ ðàñòâîðèìîñòü â âîäå, êîâàëåíòíûå íåïîëÿðíûå ñîåäèíåíèÿ – íå ðàñòâîðèìû, à êîâàëåíòíûå ïîëÿðíûå – ðàñòâîðÿþòñÿ.
Íåîðãàíè÷åñêèå ñîëè èìåþò ðàçëè÷íóþ ðàñòâîðèìîñòü â âîäå. Íàïðèìåð, ñîëè àçîòíîé è àçîòèñòîé êèñëîò, ïîäàâëÿþùåå áîëüøèíñòâî ôòîðèäîâ, áðîìèäîâ è èîäèäîâ òàêæå õîðîøî ðàñòâîðèìû, à âîò ñîëè óãîëüíîé êèñëîòû (êðîìå ñîëåé ùåëî÷íûõ ìåòàëëîâ è NH4+) – èìåþò ìàëóþ ðàñòâîðèìîñòü.
Âëèÿíèå òåìïåðàòóðû íà ðàñòâîðèìîñòü âåùåñòâ.
Ñóùåñòâóåò îñíîâíîå ïðàâèëî: ñ ïîâûøåíèåì òåìïåðàòóðû ðàñòâîðèìîñòü âñåõ òâåðäûõ âåùåñòâ ïîâûøàåòñÿ.

Ïðèâåäåííàÿ çàâèñèìîñòü ïîêàçûâàåò, ÷òî ñ ïîâûøåíèåì òåìïåðàòóðû ðàñòâîðèìîñòü äàííûõ ñîäåé óâåëè÷èâàåòñÿ. Ðàñòâîðèìîñòü NaCl èçìåíÿåòñÿ ìàëî, î ÷åì ñâèäåòåëüñòâóåò ãðàôèê.
Âçàèìíàÿ ðàñòâîðèìîñòü òâåðäûõ âåùåñòâ è æèäêîñòåé ïîâûøàåòñÿ ñ óâåëè÷åíèåì òåìïåðàòóðû. Îãðàíè÷åííàÿ ðàñòâîðèìîñòü ìîæåò ïåðåéòè â íåîãðàíè÷åííóþ è íàîáîðîò.
Êðèòè÷åñêàÿ òåìïåðàòóðà ðàñòâîðåíèÿ – òàêàÿ òåìïåðàòóðà, âûøå èëè íèæå êîòîðîé æèäêîñòè ñìåøèâàþòñÿ ìåæäó ñîáîé â íåîãðàíè÷åííûõ êîëè÷åñòâàõ.
Ðàñòâîðèìîñòü ãàçîâ â æèäêîñòÿõ ñ ïîâûøåíèåì òåìïåðàòóðû óìåíüøàåòñÿ, à ñ ïîíèæåíèåì óâåëè÷èâàåòñÿ..
Ïðèìåðû ðàñòâîðèìîñòè ãàçîâ ïðè ðàçëè÷íûõ òåìïåðàòóðàõ.
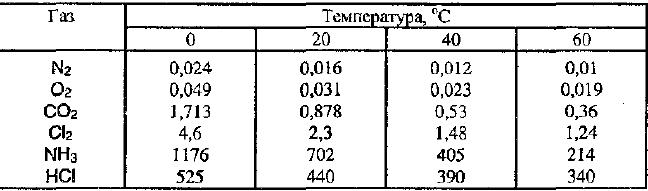
Âëèÿíèå äàâëåíèÿ íà ðàñòâîðèìîñòü âåùåñòâ.
Íà ðàñòâîðèìîñòü ãàçîâ áîëüøå âëèÿíèå îêàçûâàåò äàâëåíèå. Ïðè êîíêðåòíûõ òåìïåðàòóðå è äàâëåíèè ãàç ðàñòâîðÿåòñÿ äî òåõ ïîð, ïîêà ñêîðîñòü îòðûâà ìîëåêóë ãàçà îò ïîâåðõíîñòè íå ñòàíåò ðàâíîé ñêîðîñòè, ñ êîòîðîé ìîëåêóëû ãàçà ïðîíèêàþò â æèäêîñòü. Â ýòîò ìîìåíò óñòàíàâëèâàåòñÿ ðàâíîâåñèå, è æèäêîñòü ñòàíîâèòñÿ íàñûùåííûì ãàçîì.
Çàâèñèìîñòü ðàñòâîðèìîñòè ãàçîâ îïèñûâàåòñÿ çàêîíîì Ãåíðè:
Ïðè ïîñòîÿííîé òåìïåðàòóðå ðàñòâîðèìîñòü ãàçà â æèäêîñòè ïðÿìî ïðîïîðöèîíàëüíà åãî äàâëåíèþ íàä æèäêîñòüþ:
C(X) = Kr·P(X),
ãäå Ñ(Õ) – êîíöåíòðàöèÿ ãàçà â íàñûùåííîì ðàñòâîðå, ìîëü/ë;
Kr – ïîñòîÿííàÿ Ãåíðè ìîëü·ë-1·Ïà-1;
Ð(Õ) – äàâëåíèå ãàçà íàä ðàñòâîðîì, Ïà.
Òàêæå âåùåñòâà ìîãóò âçàèìíî âëèÿòü äðóã íà äðóãà. Åñëè ðàñòâîð ñîäåðæèò ýëåêòðîëèòû, òî âåùåñòâà ðàñòâîðÿþòñÿ íàìíîãî õóæå, ÷åì â ïðîñòîé âîäå.
Óìåíüøåíèå ðàñòâîðèìîñòè ãàçîâ â ïðèñóòñòâèå ýëåêòðîëèòîâ îáúÿñíÿåòñÿ ãèäðàòàöèåé èîíîâ, âñëåäñòâèå ÷åãî ïîíèæàåòñÿ êîíöåíòðàöèÿ ñâîáîäíûõ ìîëåêóë âîäû.
Источник
Ðàñòâîðèìîñòü – ñïîñîáíîñòü âåùåñòâà ïðè îïðåäåë¸ííûõ óñëîâèÿõ îáðàçîâûâàòü ñ äðóãèìè âåùåñòâàìè ãîìîãåííûå ñèñòåìû – ðàñòâîðû, â êîòîðûõ âåùåñòâà íàõîäèòñÿ â âèäå îòäåëüíûõ àòîìîâ, èîíîâ, ìîëåêóë èëè ÷àñòèö.
Ðàñòâîðèìîñòü çàâèñèò îò ïðèðîäû ðàñòâîð¸ííîãî âåùåñòâà è ðàñòâîðèòåëÿ, à òàêæå îò âíåøíèõ óñëîâèé (òåìïåðàòóðû, äàâëåíèÿ).
Ðàñòâîðèìîñòü õàðàêòåðèçóåòñÿ:
1. Êà÷åñòâåííûìè õàðàêòåðèñòèêàìè – ñïîñîáíîñòüþ ðàñòâîðÿòüñÿ â äàííîì ðàñòâîðèòåëå ïðè îïðåäåëåííûõ óñëîâèÿõ:
- õîðîøî ðàñòâîðèìî;
- ïëîõî ðàñòâîðèìî;
- ìàëî ðàñòâîðèìî;
- íåðàñòâîðèìî è ò.ï.
2. Êîëè÷åñòâåííûìè õàðàêòåðèñòèêàìè – êîíöåíòðàöèåé íàñûùåííîãî ðàñòâîðà äàííîãî âåùåñòâà ïðè çàäàííûõ òåìïåðàòóðå è äàâëåíèè.
Êîýôôèöèåíò ðàñòâîðèìîñòè ks – îòíîøåíèå ìàññû áåçâîäíîãî ðàñòâîð¸ííîãî âåùåñòâà ê ìàññå âîäû:
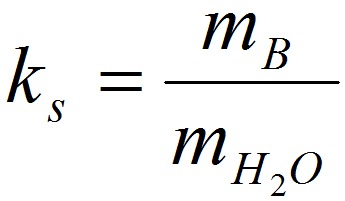
Ðàñòâîðèìîñòü íåêîòîðûõ âåùåñòâ â âîäå ïðè 20 o Ñ
Âåùåñòâî | Ðàñòâîðèìîñòü, ã íà 100 ã H2O |
NH4NO3 | 177 |
NaCl | 36 |
NaHCO3 | 10 |
H3BO3 | 6 |
CaCO3 | 0,0006 |
AgI | 0,0000002 |
Ðàñòâîðèìîñòü èîäèäà êàëèÿ â ðàçëè÷íûõ ðàñòâîðèòåëÿõ ïðè 20 o Ñ
Ðàñòâîðèòåëü | Ðàñòâîðèìîñòü, % (ìàññ.) |
Àììèàê (æèäê.) | 64 |
Âîäà | 59 |
Ìåòàíîë | 15 |
Àöåòîí | 1,3 |
Áóòàíîë | 0,2 |
Íèòðîáåíçîë | 0,0002 |
Òàáëèöà ðàñòâîðèìîñòè êèñëîò, ñîëåé è îñíîâàíèé â âîäå

Óñëîâíûå îáîçíà÷åíèÿ:
«Ð» – ðàñòâîðÿåòñÿ (>1 ã íà 100 ã H2O);
«Ì» – ìàëî ðàñòâîðÿåòñÿ (îò 0,1 ã äî 1 ã íà 100 ã H2O);
«Í» – íå ðàñòâîðÿåòñÿ (<0,01 ã íà 1000 ã H2O);
«–» – â âîäíîé ñðåäå ðàçëàãàåòñÿ.
Ìàññà âåùåñòâà â ðàñòâîðå, îíëàéí ðàñ÷åò | |
| Ðàñ÷åò ïàðàìåòðû ðàñòâîðà, òàêèå êàê ìàññà ðàñòâîðåííîãî âåùåñòâà, îáúåì, êîíöåíòðàöèþ è ìîëåêóëÿðíóþ ìàññó ðàñòâîðà. | |
| Ìàññà âåùåñòâà â ðàñòâîðå, îíëàéí ðàñ÷åò | |
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Источник
