Какие свойства у кислорода

Пожалуй, среди всех известных химических элементов, именно кислород занимает ведущее значение, ведь без него попросту было бы невозможным возникновение жизни на нашей планете. Кислород – самый распространенный химический элемент на Земле, на его долю приходится 49% от общей массы земной коры. Также он входит в состав земной атмосферы, состав воды и состав более 1400 различных минералов, таких как базальт, мрамор, силикат, кремнезем и т. д. Примерно 50-80% общей массы тканей, как животных, так и растений состоит из кислорода. И, разумеется, общеизвестна его роль для дыхания всего живого.
История открытия кислорода
Люди далеко не сразу постигли природу кислорода, хотя первые догадки о том, что в основе воздуха лежит некий химический элемент, появились еще в VIII веке. Однако в то далекое время не было ни подходящих технических инструментов для его изучения, ни возможности доказать существования кислорода, как газа, отвечающего в том числе за процессы горения.
Открытие кислорода состоялось лишь спустя тысячелетие, в ХVIII веке, благодаря совместной работе нескольких ученых.
- В 1771 шведский химик Карл Шееле опытным путем исследовал состав воздуха, и определил, что воздух состоит из двух основных газов: одним из этих газов был азот, а вторым, собственно кислород, правда на то время само название «кислород» еще не появилось в науке.
- В 1775 году французский ученый А. Лувазье дал название открытому Шееле газу – кислород, он же оксиген в латыни, само слово «оксиген» означает «рождающий кислоты».
- За год до официальных «именин кислорода», в 1774 году английский химик Пристли путем разложение ртутного оксида впервые получает чистый кислород. Его опыты подкрепляют открытие Шееле. К слову сам Шееле также пытался получить кислород в чистом виде путем нагревания селитры, но у него не получилось.
- Более чем через столетия в 1898 году английский физик Джозеф Томпсон впервые заставил общественность задуматься, о том, что запасы кислорода могут закончиться вследствие интенсивных выбросов углекислого газа в атмосферу.
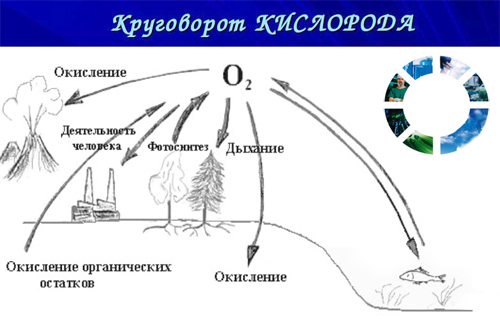
- В этом же году русский биолог Климент Тимирязев, исследователь фотосинтеза, открывает свойство растений выделять кислород.
Хотя растения и выделяют кислород в атмосферу, но проблема поставленная Томпсоном о возможной нехватки кислорода в будущем, остается актуальной и в наше время, особенно в связи с интенсивной вырубкой лесов (поставщиков кислорода), загрязнением окружающей среды, сжиганием отходов и прочая. Больше об этом мы писали в прошлой статье об экологических проблемах современности.
Значение кислорода в природе
Именно наличие кислорода, в сочетании с водой привело к тому, что на нашей планете стало возможным возникновение жизни. Как мы заметили выше, основными поставщиками этого уникального газа являются различные растения, в том числе наибольшее количество выделяемого кислорода приходится на подводные водоросли. Выделяют кислород и некоторые виды бактерий. Кислород в верхних слоях атмосферы образует озоновый шар, который защищает всех жителей Земли от вредного ультрафиолетового солнечного излучения.
Строение молекулы кислорода
Молекула кислорода состоит из двух атомов, химическая формула имеет вид О2. Как образуется молекула кислорода? Механизм ее образования ковалентный неполярный, другими словами за счет обобществления электроном каждого атома. Связь между молекулами кислорода также ковалентная и неполярная, при этом она двойная, ведь у каждого из атомов кислорода есть по два неспаренных электрона на внешнем уровне.

Так выглядит молекула кислорода, благодаря своим характеристикам она весьма устойчива. Для многих химических реакций с ее участием нужны специальные условия: нагревание, повышенное давление, применение катализаторов.
Физические свойства кислорода
- Прежде всего, кислород является газом, из которого состоит 21% воздуха.
- Кислород не имеет ни цвета, ни вкуса, ни запаха.
- Может растворяться в органических веществах, поглощаться углем и порошками металлов.
- Температура кипения кислорода составляет -183 С.
- Плотность кислорода равна 0,0014 г/см3
Химические свойства кислорода
Главным химическим свойством кислорода является, конечно же, его поддержка горения. То есть в вакууме, где нет кислорода, огонь не возможен. Если же в чистый кислород опустить тлеющую лучину, то она загорится с новой силой. Горение разных веществ это окислительно-восстановительный химический процесс, в котором роль окислителя принадлежит кислороду. Окислители же это вещества, «отбирающие» электроны у веществ восстановителей. Отличные окислительные свойства кислорода обусловлены его внешней электронной оболочкой.
Валентная оболочка у кислорода расположена близко к ядру и как следствие ядро притягивает к себе электроны. Также кислород занимает второе место после фтора по шкале электроотрицательности Полинга, по этой причине вступая в химические реакции со всеми другими элементами (за исключением фтора) кислорода выступает отрицательным окислителем. И лишь вступая в реакции со фтором кислород имеет положительное окислительное воздействие.
А так как кислород второй окислитель по силе среди всех химических элементов таблицы Менделеева, то это определяет и его химические свойства.
Получение кислорода
Для получения кислорода в лабораторных условиях применяют метод термической обработки либо пероксидов либо солей кислосодержащих кислот. Под действием высокой температуры они разлагаются с выделением чистого кислорода. Также кислород можно получить с помощью перекиси водорода, даже 3% раствор перекиси под действие катализатор мгновенно разлагается, выделяя кислород.
2KClO3 = 2KCl + 3O2↑ – вот так выглядит химическая реакция получения кислорода.
Также в промышленности в качестве еще одного способа получения кислорода применяют электролиз воды, во время которого молекулы воды раскладываются, и опять таки выделяется чистый кислород.
Использование кислорода в промышленности
В промышленности кислород активно применяется в таких сферах как:
- Металлургия (при сварке и вырезке металлов).
- Медицина.
- Сельское хозяйство.
- Как ракетное топливо.
- Для очищения и обеззараживания воды.
- Синтеза некоторых химических соединений, включая взрывчатые вещества.
Кислород, видео
И в завершение образовательное видео про кислород.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Oxygen.
Источник
Атомная масса – 16 а.е.м. Молекула кислорода двухатомна и имеет формулу – О2
Кислород относится к семейству p-элементов. Электронная конфигурация атома кислорода 1s22s22p4. В своих соединениях кислород способен проявлять несколько степеней окисления: «-2», «-1» (в пероксидах), «+2» (F2O). Для кислорода характерно проявление явления аллотропии – существования в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации кислорода – кислород O2 и озон O3.
Химические свойства кислорода
Кислород является сильным окислителем, т.к. для завершения внешнего электронного уровня ему не хватает всего 2-х электронов, и он легко их присоединяет. По химической активности кислород уступает только фтору. Кислород образует соединения со всеми элементами кроме гелия, неона и аргона. Непосредственно кислород нее вступает в реакции взаимодействия с галогенами, серебром, золотом и платиной (их соединения получают косвенным путем). Почти все реакции с участием кислорода – экзотермические. Характерная особенность многих реакций соединения с кислородом — выделение большого количества теплоты и света. Такие процессы называют горением.
Взаимодействие кислорода с металлами. Со щелочными металлами (кроме лития) кислород образует пероксиды или надпероксиды, с остальными – оксиды. Например:
4Li + O2 = 2Li2O;
2Na + O2 = Na2O2;
K + O2 = KO2;
2Ca + O2 = 2CaO;
4Al + 3O2 = 2Al2O3;
2Cu + O2 = 2CuO;
3Fe + 2O2 = Fe3O4.
Взаимодействие кислорода с неметаллами. Взаимодействие кислорода с неметаллами протекает при нагревании; все реакции экзотермичны, за исключением взаимодействия с азотом (реакция эндотермическая, происходит при 3000С в электрической дуге, в природе – при грозовом разряде). Например:
4P + 5O2 = 2P2O5;
S+ O2 = SO2;
С + O2 = СО2;
2Н2 + O2 = 2Н2О;
N2 + O2 ↔ 2NO – Q.
Взаимодействие со сложными неорганическими веществами. При горении сложных веществ в избытке кислорода образуются оксиды соответствующих элементов:
2H2S + 3O2 = 2SO2↑ + 2H2O (t);
4NH3 + 3O2 = 2N2↑ + 6H2O (t);
4NH3 + 5O2 = 4NO↑ + 6H2O (t, kat);
2PH3 + 4O2 = 2H3PO4 (t);
SiH4 + 2O2 = SiO2 + 2H2O;
4FeS2+11O2 = 2Fe2O3 +8 SO2↑ (t).
Кислород способен окислять оксиды и гидроксиды до соединений с более высокой степенью окисления:
2CO + O2 = 2CO2 (t);
2SO2 + O2 = 2SO3 (t, V2O5);
2NO + O2 = 2NO2;
4FeO + O2 = 2Fe2O3 (t).
Взаимодействие со сложными органическими веществами. Практически все органические вещества горят, окисляясь кислородом воздуха до углекислого газа и воды:
CH4 + 2O2 = CO2↑ +H2O.
Кроме реакций горения (полное окисление) возможны также реакции неполного или каталитического окисления, в этом случае продуктами реакции могут быть спирты, альдегиды, кетоны, карбоновые кислоты и другие вещества:
Окисление углеводов, белков и жиров служит источником энергии в живом организме.
Физические свойства кислорода
Кислород – самый распространенный элемент на земле (47% по массе). В воздухе содержание кислорода составляет 21% по объему. Кислород – составная часть воды, минералов, органических веществ. В растительных и животных тканях содержится 50 -85 % кислорода в виде различных соединений.
В свободном состоянии кислород представляет собой газ без цвета, вкуса и запаха, плохо растворимый в воде (в 100 л воды при 20С растворяется 3
л кислорода. Жидкий кислород голубого цвета, обладает парамагнитными свойствами (втягивается в магнитное поле).
Получение кислорода
Различают промышленные и лабораторные способы получения кислорода. Так, в промышленности кислород получают перегонкой жидкого воздуха, а к основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 + MnO2 + O2↑
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 +3 O2↑
2KNO3 = 2KNO2 + O2↑
2KClO3 = 2KCl +3 O2↑
Примеры решения задач
Источник
СТРОЕНИЕ кислорода
Кислород – наиболее распространенный в природе элемент, его содержание в атмосфере Земли составляет 21% (по объему), в земной коре в виде соединений его содержится около 50% (по массе) и в гидросфере – 88,8% (по массе). Кислород необходим для существования жизни на земле: животные и растения потребляют кислород в процессе дыхания, а растения выделяют кислород в процессе фотосинтеза. Живая материя содержит связанный кислород не только в составе жидкостей организма (в клетках крови и др.), но и в составе углеводов (сахар, целлюлоза, крахмал, гликоген), а также жиров и белков. Почва, глины, песок, горные породы состоят из силикатов и других кислородсодержащих неорганических соединений, таких, как оксиды, гидроксиды, карбонаты, сульфаты и нитраты.
Любой природный атом кислорода содержит 8 протонов в ядре, но число нейтронов может быть разным и равно 8, 9 или 10, поэтому кислород образует три соответствующих изотопа. Наиболее распространенный из трех изотопов кислорода (99,76%) – это $^{16}_8O$ (8 протонов и 8 нейтронов).
Итак, в атоме кислорода 8 электронов, при этом 2 электрона находятся на внутреннем уровне, а 6 электронов – на внешнем. Поэтому в химических реакциях кислород может принимать от доноров до двух электронов, достраивая свою внешнюю оболочку до 8 электронов и образуя избыточный отрицательный заряд. Характерная степень окисления кислорода в соединениях с другими элементами равна -2.
Кислород образует двухатомную молекулу, при образовании которой выделяется много энергии (490 кДж/моль) и соответственно столько же энергии необходимо затратить для разрушения двойной связи в молекуле.
Прочность связи O=O настолько высока, что при $2300^0C$ С только 1% молекул кислорода диссоциирует на атомы. С увеличением кратности связи ее прочность увеличивается. Так, при образовании молекулы азота $N_2$ прочность тройной связи N≡N составляет 710 кДж/моль.,
СВОЙСТВА кислорода
Молекулярный кислород реагирует практически со всеми простыми веществами (металлами и неметаллами), кроме благородных газов и является сильным окислителем. Однако при комнатных условиях только наиболее активные элементы реагируют с кислородом достаточно быстро. Наиболее активно реагируют с кислородом щелочные (Li, Na, K) и щелочноземельные (Ca, Sr, Ba) металлы с образованием пероксидов:
$2Na +O_2 longrightarrow Na2O2$
$Ba +O_2 longrightarrow BaO_2$
Остальные металлы и неметаллы реагируют с кислородом при нагревании с образованием соответствующих оксидов, например:
$S+ O_2 longrightarrow SO_2$
,
$2Cu+O_2 longrightarrow 2CuO$
Именно благодаря способности кислорода вступать в реакции окисления, большинство металлов встречается в природе в виде оксидов (руды).


ПРИМЕНЕНИЕ И ПОЛУЧЕНИЕ
Кислород хранят в танках и баллонах. Он используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах. Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна по методу Бессемера для быстрого и эффективного удаления примесей C, S и P. Сталь при кислородном дутье получается быстрее и качественнее, чем при воздушном. Кислород используется также для сварки и резки металлов (кислородно-ацетиленовое пламя). Применяют кислород и в медицине, например, для обогащения дыхательной среды пациентов с затрудненном дыханием.
Кислород можно получать различными химическими методами, некоторые из которых применяют для получения малых количеств чистого кислорода в лабораторной практике.
1. Наиболее эффективным промышленным методом получения кислорода является сжижение воздуха, из которого удаляют примеси, $CO_2$, пыль и т.д. химическими и физическими методами. Циклический процесс включает сжатие, охлаждение и расширение, что и приводит к сжижению воздуха. При медленном подъеме температуры (метод фракционной дистилляции) из жидкого воздуха испаряются сначала благородные газы (наиболее трудно сжижаемые), затем азот и остается жидкий кислород.
2. Одним из методов получения кислорода является электролиз воды, содержащей небольшие добавки NaOH или $H_2SO_4$ в качестве катализатора:
$2H_2O$ (г) $xrightarrow{cur} 2H_2 + O_2$
.
3. Важным лабораторным методом получения кислорода, является термический метод, предложенный Дж.Пристли, который заключается в термическом разложении оксидов тяжелых металлов, например оксида ртути:
$2HgO$ (r)$longrightarrow 2Hg + O_2$
.
4. Наиболее часто в лаборатории получают кислород разложением при нагревании таких веществ, в состав которых кислород входит в связанном виде, например перманганата калия (марганцовка), хлората калия (бертолетова соль), нитрата калия (селитра):
$2KMnO_4 longrightarrow K_2MnO_4 + MnO_2 +O_2$
.
Данная реакция является окислительно-восстановительной и относится к реакциям диспропорционирования.
$2KClO_3 longrightarrow 2KCl + 3O_2$
$2KNO_3 longrightarrow 2KNO_2 +O_2$
5. Кислород можно также получать разложением перекиси водорода:
$2H_2O_2 longrightarrow H_2O + O_2$
Раствор перекиси водорода применяется как дезинфицирующее средство при обработке царапин и мелких ран. Он мало устойчив и уже при стоянии медленно разлагается на кислород и воду. Выделяющийся атомарный кислород является очень сильным окислителем, поэтому убивает бактерии.
Источник
История кислорода
Открытие кислорода произошло дважды, во второй половине XVIII столетия с разницей в несколько лет. В 1771 году кислород получил швед Карл Шееле, нагревая селитру и серную кислоту. Полученный газ был назван «огненным воздухом». В 1774 английский химик Джозеф Пристли проводил процесс разложения оксида ртути в полностью закрытом сосуде и открыл кислород, но принял его за ингредиент воздуха. Только после того, как Пристли поделился своей находкой с французом Антуаном Лавуазье, стало понятно, что открыт новый элемент (calorizator). Пальма первенства данного открытия принадлежит Пристли потому, что Шееле опубликовал свой научный труд с описанием открытия лишь в 1777 году.
Общая характеристика кислорода
Кислород является элементом XVI группы II периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 8 и атомную массу 15,9994. Принято обозначать кислород символом О (от латинского Oxygenium – порождающий кислоту). В русском языке название кислород стало производным от кислоты, термина, который был введён М.В. Ломоносовым.

Нахождение в природе
Кислород является самым распространённым элементом по нахождению в земной коре и Мировом океане. Соединения кислорода (в основном – силикаты) составляют не менее 47% массы земной коры, кислород вырабатывается в процессе фотосинтеза лесами и всеми зелёными растениями, большая часть приходится на фитопланктон морских и пресных вод. Кислород – обязательная составная часть любых живых клеток, также находится в большинстве веществ органического происхождения.
Физические и химические свойства
Кислород – лёгкий неметалл, состоит в группе халькогенов, имеет высокую химическую активность. Кислород, как простое вещество, представляет собой газ без цвета, запаха и вкуса, имеет жидкое состояние – светло-голубая прозрачная жидкость и твёрдое – светло-синие кристаллы. Состоит из двух атомов кислорода (обозначается формулой О₂).
Полезные свойства кислорода и его влияние на организм
Кислород участвует в окислительно-восстановительных реакциях. Живые существа дышат кислородом воздуха. Широко используется кислород в медицине. При сердечнососудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном.

Биологическая роль кислорода
Кислород – основа основ жизнедеятельности всех живых организмов на Земле, является основным биогенным элементом. Находится в составе молекул всех важнейших веществ, которые отвечают за структуру и функции клеток (липиды, белки, углеводы, нуклеиновые кислоты). Каждый живой организм содержит гораздо больше кислорода, чем какого-либо элемента (до 70%). Для примера, организм взрослого среднестатического человека массой 70 кг содержит 43 кг кислорода.
Кислород поступает в живые организмы (растения, животные и человек) благодаря органам дыхания и поступлению воды. Помня о том, что в организме человека самый главный орган дыхания – это кожа, становится понятно, сколько кислорода может получать человек, особенно летом на берегу водоёма. Определить потребность человека в кислороде достаточно сложно, ведь она зависит от многих факторов – возраст, пол, масса и поверхность тела, система питания, внешняя среда и т.д.
Применение кислорода в жизни
Кислород применяется практически повсеместно – от металлургии до производства ракетного топлива и взрывчатых веществ, применяемых для дорожных работах в горах; от медицины до пищевой промышленности.
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E941, как пропеллент и упаковочный газ.
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
Источник

