Какие свойства твердых тел жидкостей и газов

Êíèãà: Ïðèðîäîâåäåíèå. Ïðèðîäà. Íåæèâàÿ è æèâàÿ. 5 êëàññ
§ 7. Ñâîéñòâà òâåðäûõ òåë, æèäêîñòåé è ãàçîâ
§ 7. Ñâîéñòâà òâåðäûõ òåë, æèäêîñòåé è ãàçîâ
Êàæäûé èç âàñ ñìîæåò íàçâàòü ìíîæåñòâî ðàçëè÷íûõ òâåðäûõ òåë. Èõ òâåðäîñòü âû îùóùàåòå ñðàçó æå, âçÿâ â ðóêè. Èç àëþìèíèÿ èçãîòîâèëè ïðÿìîóãîëüíûé áðóñîê. Êàê áû ìû åãî íè ðàñïîëàãàëè, îí áóäåò ñîõðàíÿòü ñâîè ôîðìó è îáúåì òàêèìè, êàêèå åìó áûëè ïðèäàíû ïðè èçãîòîâëåíèè (ðèñ. 26).
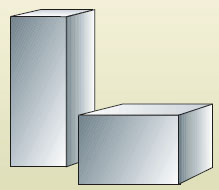
Ðèñ. 26. Òâåðäûå òåëà ñîõðàíÿþò íåèçìåíåííûìè ôîðìó è îáúåì
×òîáû èçìåíèòü åãî ôîðìó, íóæíî ïðèëîæèòü î÷åíü áîëüøîå óñèëèå. Ñëåäîâàòåëüíî, òâåðäûå òåëà ñïîñîáíû ñîõðàíÿòü íåèçìåííûìè ôîðìó è îáúåì. Ýòî îäíî èç ñâîéñòâ òâåðäûõ òåë. Ðàññìîòðèì ñâîéñòâà æèäêîñòåé, íàïðèìåð âîäû. Åñëè âîäó íàëèâàòü â ðàçíîîáðàçíûå ñîñóäû, òî êàæäûé ðàç îíà áóäåò ïðèíèìàòü ôîðìó ýòèõ åìêîñòåé (ðèñ. 27).
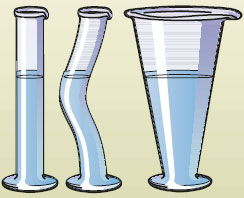
Ðèñ. 27. Æèäêîñòè íå ñîõðàíÿþò ôîðìó
Îáúåì æå âîäû áóäåò îñòàâàòüñÿ îäíèì è òåì æå. Åñëè ñîñóä ðàçáèòü, òî âîäà áåç ïîääåðæèâàþùèõ åå ñòåíîê ðàçîëüåòñÿ. Æèäêîñòè ñïîñîáíû ñîõðàíÿòü îáúåì, íî íå ñïîñîáíû ñîõðàíÿòü ôîðìó. Ñïîñîáíîñòü æèäêîñòè ïðèíèìàòü ôîðìó ñîñóäà øèðîêî èñïîëüçóåòñÿ è íà ïðîèçâîäñòâå, è â ïîâñåäíåâíîé æèçíè (íàïðèìåð, ïðè ëèòüå ìåòàëëîâ è ïðèãîòîâëåíèè ïèùè).
Ãàçû íå ñîõðàíÿþò ôîðìû è çàíèìàþò âåñü îáúåì, êîòîðûé èì ïðåäîñòàâëåí. Ñëåäîâàòåëüíî, ãàçû ïðèíèìàþò ôîðìó è çàíèìàþò îáúåì òîãî ñîñóäà èëè ïîìåùåíèÿ, â êîòîðîì îíè íàõîäÿòñÿ: çàêðûòîé áóòûëêè, çàêóïîðåííîé êîëáû, êîìíàòû, ñïåöèàëüíîãî áàëëîíà äëÿ ïåðåâîçêè è ò. ä. (ðèñ. 28).
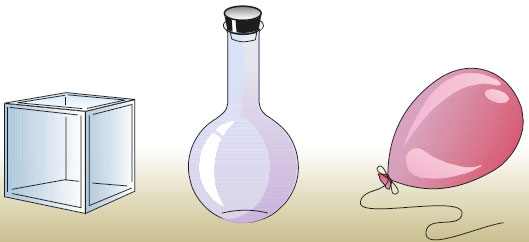
Ðèñ. 28. Ãàçû íå ñîõðàíÿþò ôîðìó è çàíèìàþò âåñü îáúåì, êîòîðûé èì ïðåäîñòàâëåí
Äåôîðìàöèÿ
Âîçüìèòå ðåçèíîâóþ ëåíòó è êàðàíäàøîì èëè ôëîìàñòåðîì ðàçìåòüòå åå íà ïîëîñêè ðàâíîé äëèíû. Åñëè îäèí êîíåö ëåíòû çàêðåïèòü, à ê äðóãîìó ïîäâåñèòü ãðóç, òî ëåíòà ðàñòÿíåòñÿ. Ïðè ýòîì êàæäàÿ èç ïîëîñîê íà íåé ñòàíåò äëèííåå (ðèñ. 29). Ïî÷åìó? Ïîä äåéñòâèåì ãðóçà âîçíèêàåò äâèæåíèå ÷àñòåé ëåíòû îòíîñèòåëüíî äðóã äðóãà.  ðåçóëüòàòå èçìåíÿþòñÿ åå äëèíà è îáúåì. Åñëè ïîâîðà÷èâàòü, êàê ïîêàçàíî íà ðèñóíêå, êîíöû ïîëîñêè èç ìÿãêîãî ìåòàëëà, êàðòîíà, áóìàãè, òî â ðåçóëüòàòå ïåðåìåùåíèÿ ÷àñòåé ïîëîñêè èçìåíèòñÿ åå ôîðìà. Îíà áóäåò èìåòü óæå äðóãîé âèä.
Òàêèì îáðàçîì, êîãäà âîçíèêàåò äâèæåíèå ÷àñòåé òåëà îòíîñèòåëüíî äðóã äðóãà, ïðîèñõîäèò èçìåíåíèå ôîðìû, ðàçìåðîâ è îáúåìà íå òîëüêî òåëà â öåëîì, íî è êàæäîé åãî îòäåëüíîé ÷àñòè.
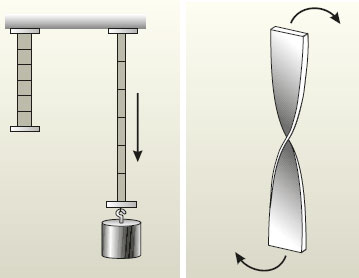
Ðèñ. 29. Äåôîðìàöèÿ òåë
Ëþáîå èçìåíåíèå ôîðìû, ðàçìåðîâ è îáúåìà òåëà íàçûâàåòñÿ äåôîðìàöèåé.
Åñëè â îïûòå ñ ðåçèíîâîé ëåíòîé óáðàòü ãðóç, òî îíà ïðèîáðåòåò ïåðâîíà÷àëüíûé âèä âîññòàíîâèò ñâîþ ôîðìó è ðàçìåðû. Ðåçèíà îáëàäàåò ñâîéñòâîì, êîòîðîå íàçûâàþò óïðóãîñòüþ.
Óïðóãîñòü ýòî ñâîéñòâî òåëà èçìåíÿòü ôîðìó è îáúåì ïîä äåéñòâèåì äðóãèõ òåë è âîññòàíàâëèâàòü èõ ïîñëå ïðåêðàùåíèÿ äåéñòâèÿ.
Îäíàêî íå âñå òåëà ïîñëå ïðîèçâåäåííîãî íà íèõ âîçäåéñòâèÿ âîçâðàùàþò ñâîå ïåðâîíà÷àëüíîå ñîñòîÿíèå. Ïóëþ äëÿ ïíåâìàòè÷åñêîãî ðóæüÿ èçãîòàâëèâàþò èç ñâèíöà. Åñëè âçÿòü åå â ðóêó è ñæàòü ïàëüöàìè, îíà èçìåíèò ôîðìó ñîìíåòñÿ è ïîñëå ðàçæàòèÿ ïàëüöåâ îñòàíåòñÿ äåôîðìèðîâàííîé. Ñëåäîâàòåëüíî, ñóùåñòâóþò òåëà, êîòîðûå èçìåíÿþò ôîðìó è çàòåì íå âîññòàíàâëèâàþò åå.
Ñâîéñòâî òåë ìåíÿòü ôîðìó ïîä äåéñòâèåì äðóãèõ òåë è ñîõðàíÿòü åå (â èçìåíåííîì âèäå) ïîñëå îêîí÷àíèÿ äåéñòâèÿ íàçûâàåòñÿ ïëàñòè÷íîñòüþ.
Âîñê, ñâèíåö, ñâåæàÿ îêîííàÿ çàìàçêà, ïëàñòèëèí âñå ýòî ïëàñòè÷íûå âåùåñòâà. Ïëàñòè÷íîñòü ìàòåðèàëîâ ñâîéñòâî, êîòîðîå èñïîëüçóåòñÿ äëÿ èçãîòîâëåíèÿ äåòàëåé ðàçíûõ ôîðì â òåõíèêå è áûòó.

1. Ïðèâåäèòå íåñêîëüêî ñâîèõ ïðèìåðîâ, êîãäà â ðåçóëüòàòå äâèæåíèÿ ÷àñòåé òåëà ìåíÿþòñÿ åãî ôîðìà è ðàçìåðû.
2. Êàêèå òåëà íàçûâàþòñÿ óïðóãèìè? Ïðèâåäèòå ïðèìåðû óïðóãèõ òåë.
3. Êàêèå òåëà íàçûâàþòñÿ ïëàñòè÷íûìè? Ïðèâåäèòå ïðèìåðû.
4. Êàêèìè ñâîéñòâàìè îáëàäàþò òâåðäûå òåëà?
5. Êàêèìè ñâîéñòâàìè îáëàäàþò ãàçû?
6. Êàêèìè ñâîéñòâàìè îáëàäàþò æèäêîñòè?
Ëàáîðàòîðíàÿ ðàáîòà ¹ 3
Îïðåäåëåíèå ôèçè÷åñêèõ ñâîéñòâ òâåðäûõ, æèäêèõ è ãàçîîáðàçíûõ òåë
1. Ïîëîæèòå êóáèê ëüäà â ñòàêàí. Èçìåíèëàñü ëè åãî ôîðìà? îáúåì? Ñäåëàéòå âûâîä, êàêîå ñâîéñòâî òâåðäûõ òåë âû íàáëþäàëè.
2. Âîçüìèòå ñòàêàí÷èê ñ âîäîé è ïåðåëåéòå âîäó â êîëáó. ×òî èçìåíèëîñü? Èçìåíèëñÿ ëè îáúåì âîäû? Ñäåëàéòå âûâîä, êàêîå ñâîéñòâî æèäêèõ òåë âû íàáëþäàëè.
3. Íà ñòåêëÿííóþ ïëàñòèíêó ïèïåòêîé íàíåñèòå íåñêîëüêî êàïåëü âîäû. Íàêëîíèòå ïëàñòèíêó. ×òî âû íàáëþäàåòå? Âñïîìíèòå èç êóðñà íà÷àëüíîé øêîëû, êàê íàçûâàåòñÿ íàáëþäàåìîå ñâîéñòâî âîäû.
4. Ñîæìèòå ëàñòèê â ðóêå è îòïóñòèòå. Èçìåíèëàñü ëè åãî ôîðìà? Îáúåì? Ñîæìèòå êóñî÷åê ïëàñòèëèíà è îòïóñòèòå. Èçìåíèëàñü ëè åãî ôîðìà? Ñðàâíèòå ðåçóëüòàòû îïûòîâ ñ ëàñòèêîì è ïëàñòèëèíîì. Ñäåëàéòå âûâîä, êàêèå ñâîéñòâà òâåðäûõ òåë âû íàáëþäàëè.
5. Íàäóéòå âîçäóøíûé øàðèê (íå î÷åíü ñèëüíî) è çàâÿæèòå åãî íèòêîé. Íàäàâèòå íà øàðèê è íàáëþäàéòå çà èçìåíåíèåì åãî ôîðìû è îáúåìà. Îòïóñòèòå ðóêó. ×òî ïðîèçîøëî ñ âîçäóõîì â øàðèêå? Ñäåëàéòå âûâîä, êàêîå ñâîéñòâî ãàçîîáðàçíûõ òåë âû íàáëþäàëè?
Источник
Вся неживая материя состоит из частиц, поведение которых может отличаться. Строение газообразных, жидких и твердых тел имеет свои особенности. Частицы в твердых телах удерживаются вместе, так как расположены очень тесно друг к другу, это делает их очень прочными. Кроме того, они могут держать определенную форму, так как их мельчайшие частицы практически не двигаются, а только вибрируют. Молекулы в жидкостях находятся довольно близко друг к другу, однако они могут свободно передвигаться, поэтому собственной формы они не имеют. Частицы в газах движутся очень быстро, вокруг них, как правило, много пространства, что предполагает их легкое сжатие.
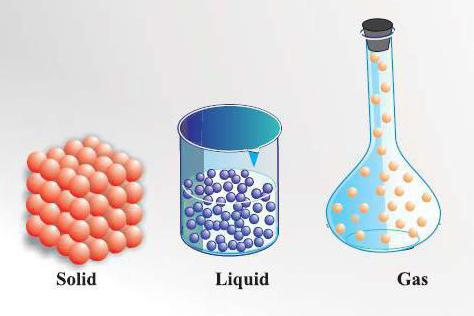
Свойства и строение твердых тел
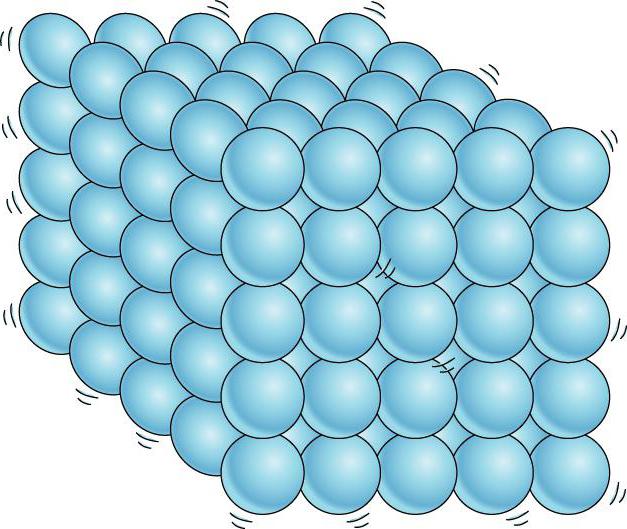
Какова структура и особенности строения твердых тел? Они состоят из частиц, которые расположены очень близко друг к другу. Они не могут перемещаться, и поэтому их форма остается фиксированной. Каковы свойства твердого тела? Оно не сжимается, но если его нагреть, то его объем будет увеличиваться с ростом температуры. Это происходит потому, что частицы начинают вибрировать и двигаться, что приводит к уменьшению плотности.

Одной из особенностей твердых тел является то, что они имеют неизменную форму. Когда твердое тело нагревается, средняя скорость движения частиц увеличивается. Быстрее движущиеся частицы сталкиваются более яростно, заставляя каждую частицу толкать своих соседей. Следовательно, повышение температуры обычно приводит к повышению прочности тела.

Кристаллическое строение твердых тел
Межмолекулярные силы взаимодействия между соседними молекулами твердого тела достаточно сильны, чтобы держать их в фиксированном положении. Если эти мельчайшие частицы находятся в высокоупорядоченной комплектации, то такие структуры принято называть кристаллическими. Вопросами внутренней упорядоченности частиц (атомов, ионов, молекул) элемента или соединения занимается специальная наука – кристаллография.

Химическое строение твердого тела также вызывает особый интерес. Изучая поведение частиц, того, как они устроены, химики могут объяснить и предсказать, как определенные виды материалов будут себя вести при определенных условиях. Мельчайшие частицы твердого тела расположены в виде решетки. Это так называемое регулярное расположение частиц, где немаловажное значение играют различные химические связи между ними.

Зонная теория строения твердого тела рассматривает твердое вещество как совокупность атомов, каждый их которых, в свою очередь, состоит из ядра и электронов. В кристаллическом строении ядра атомов находятся в узелках кристаллической решетки, для которой характерна определенная пространственная периодичность.

Что такое структура жидкости?
Строение твердых тел и жидкостей схоже тем, что частицы, из которых они состоят, находятся на близком расстоянии. Различие состоит в том, что молекулы жидкого вещества свободно перемещаются, так как сила притяжения между ними гораздо слабее, нежели в твердом теле.
Какими же свойствами обладает жидкость? Во-первых, это текучесть, во-вторых, жидкость будет принимать форму контейнера, в который ее помещают. Если ее нагреть, объем будет увеличиваться. Из-за близкого расположения частиц друг к другу жидкость не может быть сжата.

Какова структура и строение газообразных тел?
Частицы газа располагаются случайным образом, они находятся так далеко друг от друга, что между ними не может возникнуть сила притяжения. Какими свойствами обладает газ и каково строение газообразных тел? Как правило, газ равномерно заполняет все пространство, в которое он был помещен. Он легко сжимается. Скорость частиц газообразного тела увеличивается вместе с ростом температуры. При этом происходит также повышение давления.

Строение газообразных, жидких и твердых тел характеризуется разными расстояниями между мельчайшими частицами этих веществ. Частицы газа находятся гораздо дальше друг от друга, чем в твердом или жидком состоянии. В воздухе, например, среднее расстояние между частицами примерно в десять раз превышает диаметр каждой частицы. Таким образом, объем молекул занимает всего около 0,1 % от общего объема. Остальные 99,9 % составляет пустое пространство. В противоположность этому частицы жидкости заполняют около 70 % общего объема жидкости.
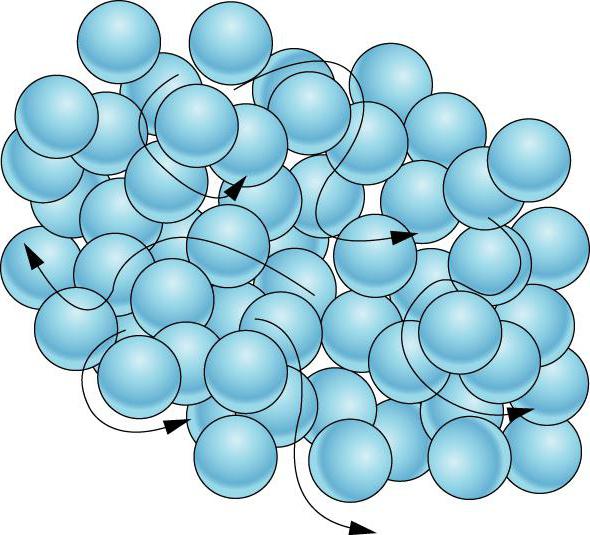
Каждая частица газа движется свободно по прямолинейному пути, пока она не столкнется с другой частицей (газа, жидкости или твердого тела). Частицы обычно движутся достаточно быстро, а после того как две из них сталкиваются, они отскакивают друг от друга и продолжают свой путь в одиночку. Эти столкновения меняют направление и скорость. Эти свойства газовых частиц позволяют газам расширяться, чтобы заполнить любую форму или объем.

Изменение состояния
Строение газообразных, жидких и твердых тел может меняться, если на них оказывается определенное внешнее воздействие. Они могут даже переходить в состояния друг друга при определенных условиях, например в процессе нагревания или охлаждения.
- Плавление. Под воздействием очень высоких температур организованная структура разрушается, и твердое тело становится жидким. Частицы по-прежнему располагаются близко друг к другу, но между ними появляется больше свободного пространства. Таким образом, когда твердое вещество плавится, оно, как правило, расширяется, чтобы заполнить несколько больший объем. Эта свобода передвижения позволяет, например, придать определенную форму жидкому металлу.

- Испарение. Строение и свойства жидких тел позволяют им при определенных условиях переходить в совершенно другое физическое состояние. Например, случайно пролив бензин при заправке автомобиля, можно довольно быстро почувствовать его резкий запах. Как это происходит? Частицы двигаются по всей жидкости, в итоге определенная их часть достигает поверхности. Их направленное движение может вынести эти молекулы за пределы поверхности в пространство над жидкостью, но притяжение будет затягивать их обратно. С другой стороны, если частица движется очень быстро, она может оторваться от других на приличное расстояние. Таким образом, при увеличении скорости частиц, которое случается обычно при нагревании, происходит процесс испарения, то есть преобразования жидкости в газ.
Поведение тел в разных физических состояниях
Строение газов, жидкостей, твердых тел главным образом обусловлено тем, что все эти вещества состоят из атомов, молекул или ионов, однако поведение этих частиц может быть совершенно разным. Частицы газа хаотичным образом удалены друг от друга, молекулы жидкости находятся близко друг к другу, но они не так жестко структурированы, как в твердом теле. Частицы газа вибрируют и передвигаются на высоких скоростях. Атомы и молекулы жидкости вибрируют, перемещаются и скользят мимо друг друга. Частицы твердого тела также могут вибрировать, но движение как таковое для них не свойственно.

Особенности внутренней структуры
Для того чтобы понять поведение материи, нужно сначала изучить особенности ее внутренней структуры. Каковы внутренние различия между гранитом, оливковым маслом и гелием в воздушном шарике? Простая модель структуры материи поможет найти ответ на этот вопрос.

Модель является упрощенным вариантом реального предмета или вещества. Например, до того как начинается непосредственное строительство, архитекторы сначала конструируют модель строительного проекта. Такая упрощенная модель не обязательно предполагает точное описание, но в то же время она может дать приблизительное представление того, что будет собой представлять та или иная структура.
Упрощенные модели
В науке, однако, моделями не всегда выступают физические тела. За последнее столетие наблюдался значительный рост человеческого понимания о физическом мире. Однако большая часть накопленных знаний и опыта основана на чрезвычайно сложных представлениях, например в виде математических, химических и физических формул.

Для того чтобы разобраться во всем этом, нужно быть достаточно хорошо подкованным в этих точных и сложнейших науках. Ученые разработали упрощенные модели для визуализации, объяснения и предсказания физических явлений. Все это значительным образом упрощает понимание того, почему некоторые тела имеют постоянную форму и объем при определенной температуре, а другие могут их менять и так далее.
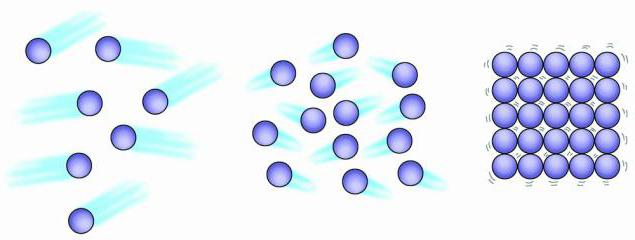
Вся материя состоит из мельчайших частиц. Эти частицы находятся в постоянном движении. Объем движения связан с температурой. Повышенная температура свидетельствует об увеличении скорости движения. Строение газообразных, жидких и твердых тел отличается свободой передвижения их частиц, а также тем, насколько сильно частицы притягиваются друг к другу. Физические свойства вещества зависят от его физического состояния. Водяной пар, жидкая вода и лед имеют одинаковые химические свойства, но их физические свойства значительно отличаются.
Источник
Агрега́тное состоя́ние вещества (от лат. aggrego «присоединяю») — физическое состояние вещества, зависящее от соответствующего сочетания температуры и давления.
Изменение агрегатного состояния может сопровождаться скачкообразным изменением свободной энергии, энтропии, плотности и других физических величин.[1]
Традиционно выделяют три агрегатных состояния: твёрдое, жидкое и газообразное. К агрегатным состояниям принято причислять также плазму[2], в которую переходят газы при повышении температуры и фиксированном давлении. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию. Существуют и другие агрегатные состояния.
Определения агрегатных состояний не всегда являются строгими. Так, существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью и способностью сохранять форму; жидкие кристаллы текучи, но при этом обладают некоторыми свойствами твёрдых тел, в частности, могут поляризовать проходящее через них электромагнитное излучение.
Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями.
Основным термодинамическим (феноменологическим) признаком различия видов агрегатного состояния вещества является наличие энергетической границы между фазами: теплота испарения как граница между жидкостью и её паром и теплота плавления как граница между твёрдым веществом и жидкостью[3].
Четыре основных состояния[править | править код]
Твёрдое тело[править | править код]
Кристаллические вещества: атомное разрешение изображения титаната стронция. Яркие атомы — Sr, темнее их Ti.
В твёрдом состоянии вещество сохраняет как форму, так и объём. При низких температурах все вещества замерзают — превращаются в твёрдые тела. Температура затвердевания может быть несколько повышена при увеличении давления. Твёрдые тела делятся на кристаллические и аморфные. С микроскопической точки зрения твёрдые тела характерны тем, что молекулы или атомы в них в течение длительного времени сохраняют своё среднее положение неизменным, только совершая колебания с небольшой амплитудой вокруг них. В кристаллах средние положения атомов или молекул строго упорядочены. Кристаллы характеризуются пространственной периодичностью в расположении равновесных положений атомов, которая достигается наличием дальнего порядка и носит название кристаллической решётки. Естественная форма кристаллов — правильные многогранники.
В аморфных телах атомы колеблются вокруг хаотически расположенных точек, у них отсутствует дальний порядок, но сохраняется ближний, при котором молекулы расположены согласованно на расстоянии, сравнимом с их размерами. Согласно классическим представлениям, устойчивым состоянием (с минимумом потенциальной энергии) твёрдого тела является кристаллическое. Частным случаем аморфного состояния является стеклообразное состояние. Аморфное тело находится в метастабильном состоянии и с течением времени должно перейти в кристаллическое состояние, однако время кристаллизации часто столь велико, что метастабильность вовсе не проявляется. Аморфное тело можно рассматривать как жидкость с очень большой (часто бесконечно большой) вязкостью. Кристаллические твёрдые тела имеют анизотропные свойства, то есть их отклик на приложенные внешние силы зависит от ориентации сил относительно кристаллографических осей. В твердотельном состоянии вещества могут иметь много фаз, которые отличаются составлением атомов или другими характеристиками, такими как упорядочение спинов в ферромагнетиках.
Жидкость[править | править код]
Структура классической одноатомной жидкости.
В жидком состоянии вещество сохраняет объём, но не сохраняет форму. Это означает, что жидкость может занимать только часть объёма сосуда, но также может свободно перетекать по всей поверхности сосуда. Жидкое состояние обычно считают промежуточным между твёрдым телом и газом.
Форма жидких тел может полностью или отчасти определяться тем, что их поверхность ведёт себя как упругая мембрана. Так, вода может собираться в капли. Но жидкость способна течь даже под своей неподвижной поверхностью, и это тоже означает изменение формы (внутренних частей жидкого тела).
Молекулы жидкости не имеют определённого положения, но в то же время им недоступна полная свобода перемещений. Между ними существует притяжение, достаточно сильное, чтобы удержать их на близком расстоянии.
Вещество в жидком состоянии существует в определённом интервале температур, ниже которого переходит в твёрдое состояние (происходит кристаллизация либо превращение в твердотельное аморфное состояние — стекло), выше — в газообразное (происходит испарение). Границы этого интервала зависят от давления.
Как правило, вещество в жидком состоянии имеет только одну модификацию. (Наиболее важные исключения — это квантовые жидкости и жидкие кристаллы.) Поэтому в большинстве случаев жидкость является не только агрегатным состоянием, но и термодинамической фазой (жидкая фаза).
Все жидкости принято делить на чистые жидкости и смеси. Некоторые смеси жидкостей имеют большое значение для жизни: кровь, морская вода и др. Жидкости могут выполнять функцию растворителей.
Как и газ, жидкости тоже в основном изотропные. Однако, существуют жидкости с анизотропными свойствами — жидкие кристаллы. Кроме изотропной, так называемой нормальной фазы, эти вещества, мезогены, имеют одну или несколько упорядоченных термодинамических фаз, которые называют мезофазы. Составление в мезофазы происходит благодаря особой форме молекул жидких кристаллов. Обычно это длинные узкие молекулы, которым выгодно укладываться так, чтобы их оси совпадали.
Газ[править | править код]
Основная статья: Газ
Промежутки между молекулами газа очень большие. Молекулы газа обладают очень слабыми связями. Молекулы в газе могут перемещаться свободно и быстро.
Газообразное состояние характерно тем, что оно не сохраняет ни форму, ни объём. Причем заполняет весь доступный ему объём. Это состояние, свойственное веществам с малой плотностью. Переход из жидкого в газообразное состояние называют испарением, а противоположный ему переход из газообразного состояния в жидкое — конденсацией. Переход из твёрдого состояния в газообразное, минуя жидкое, называют сублимацией или возгонкой. С микроскопической точки зрения газ — это состояние вещества, в котором его отдельные молекулы взаимодействуют слабо и движутся хаотически. Взаимодействие между ними сводится к спорадическим столкновениям. Кинетическая энергия молекул превышает потенциальную. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда). По химическим свойствам газы и их смеси весьма разнообразны — от малоактивных инертных газов до взрывчатых газовых смесей. Понятие «газ» иногда распространяют не только на совокупности атомов и молекул, но и на совокупности других частиц — фотонов, электронов, броуновских частиц, а также плазму. Некоторые вещества не имеют газообразного состояния. Это вещества со сложным химическим строением, которые при повышении температуры распадаются вследствие химических реакций раньше, чем становятся газом. Не существует различных газообразных термодинамических фаз одного вещества. Газам свойственна изотропия, то есть независимость характеристик от направления. В привычных для человека земных условиях, газ имеет одинаковую плотность в любой точке, однако это не является универсальным законом, во внешних полях, например в поле тяготения Земли, или в условиях различных температур плотность газа может меняться от точки к точке. Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется паром.
Плазма[править | править код]
Плазменная декоративная лампа.
Четвёртым агрегатным состоянием вещества часто называют плазму. Плазма является частично или полностью ионизированным газом и в равновесном состоянии обычно возникает при высокой температуре, от нескольких тысяч К[1] и выше. В земных условиях плазма образуется в газовых разрядах. Её свойства напоминают свойства газообразного состояния вещества, за исключением того факта, что для плазмы принципиальную роль играет электродинамика, то есть равноправной с ионами и электронами составляющей плазмы является электромагнитное поле.
Плазма — самое распространённое во Вселенной агрегатное состояние вещества. В этом состоянии находится вещество звёзд и вещество, наполняющее межпланетное, межзвёздное и межгалактическое пространство. Бо́льшая часть барионного вещества (по массе около 99,9 %) во Вселенной находится в состоянии плазмы.[4].
Фазовый переход[править | править код]
Фазовый переход по фазовой диаграмме при изменении её интенсивных параметров (температуры, давления и тому подобное) происходит, когда система пересекает линию, разделяющую две фазы. Поскольку разные термодинамические фазы описываются различными уравнениями состояния, всегда можно найти величину, которая скачкообразно меняется при фазовом переходе.
При фазовом переходе первого рода скачкообразно изменяются самые главные, первичные экстенсивные параметры: удельный объём, количество запасённой внутренней энергии, концентрация компонентов и т. п. Фазовые переходы второго рода происходят в тех случаях, когда меняется симметрия строения вещества (симметрия может полностью исчезнуть или понизиться).
Низкотемпературные состояния[править | править код]
Сверхтекучесть[править | править код]
Способность вещества в особом состоянии (квантовой жидкости), возникающем при понижении температуры к абсолютному нулю (термодинамическая фаза), протекать через узкие щели и капилляры без трения. До недавнего времени сверхтекучесть была известна только у жидкого гелия, однако в последние годы сверхтекучесть была обнаружена и в других системах: в разреженных атомных бозе-конденсатах, твёрдом гелии.
Сверхтекучесть объясняется следующим образом. Поскольку атомы гелия являются бозонами, квантовая механика допускает нахождение в одном состоянии произвольного числа частиц. Вблизи абсолютного нуля температур все атомы гелия оказываются в основном энергетическом состоянии. Поскольку энергия состояний дискретна, атом может получить не любую энергию, а только такую, которая равна энергетическому зазору между соседними уровнями энергии. Но при низкой температуре энергия столкновений может оказаться меньше этой величины, в результате чего рассеяния энергии попросту не будет происходить. Жидкость будет течь без трения.
Конденсат Бозе — Эйнштейна[править | править код]
Получается в результате охлаждения бозе-газа до температур, близких к абсолютному нулю. В таком сильно охлаждённом состоянии достаточно большое число атомов оказывается в своих минимально возможных квантовых состояниях и квантовые эффекты начинают проявляться на макроскопическом уровне. Конденсат Бозе — Эйнштейна проявляет ряд квантовых свойств, таких как сверхтекучесть и резонанс Фешбаха[en].
Фермионный конденсат[править | править код]
Представляет собой Бозе-конденсацию в режиме БКШ «атомных куперовских пар» в газах состоящих из атомов-фермионов.
(В отличие от традиционного режима бозе-эйнштейновской конденсации составных бозонов).
Такие фермионные атомные конденсаты являются «родственниками» сверхпроводников, но с критической температурой порядка комнатной и выше.
[5]
Вырожденный газ[править | править код]
Газ, на свойства которого существенно влияют квантовомеханические эффекты, возникающие вследствие тождественности его частиц. Вырождение наступает в условиях, когда расстояния между частицами газа становятся соизмеримыми с длиной волны де Бройля; в зависимости от спина частиц выделяются два типа вырожденных газов — ферми-газ, образованный фермионами (частицами с полуцелым спином) и бозе-газ, образованный бозонами (частицами с целым спином).
Сверхтекучее твёрдое тело[править | править код]
Термодинамическая фаза квантовой жидкости, представляющей собой твёрдое тело со свойствами сверхтекучей жидкости.
Высокоэнергетические состояния[править | править код]
Глазма[править | править код]
Состояние адронного поля[6], предшествующее при столкновениях кварк-глюонной плазме. Состоит из цветных токовых трубок.[7] Глазма является особенностью теоретической модели «конденсата цветового стекла» (англ. color glass condensate) — подхода к описанию сильного взаимодействия в условиях высоких плотностей[8].
Глазма образуется при столкновении адронов друг с другом (например, протонов с протонами, ионов с ионами, ионов с протонами). Считается также, что в эволюции Вселенной состояние глазмы предшествовало кварк-глюонной плазме, которая существовала в первые миллионные доли секунды сразу после Большого взрыва. Время существования глазмы — несколько иоктосекунд[9].
Кварк-глюонная плазма[править | править код]
Состояние вещества в физике высоких энергий и физике элементарных частиц, при котором адронное вещество переходит в состояние, аналогичное состоянию, в котором находятся электроны и ионы в обычной плазме. Ему предшествует состояние глазмы[10] (глазма термализуется, то есть разрушается, порождая множество хаотично движущихся кварков, антикварков и глюонов: кварк-глюонную плазму[11]).
Состояния при большом давлении[править | править код]
Нейтронное состояние[править | править код]
Принципиально отличное от других состояние вещества, состоящее только из нейтронов. В нейтронное состояние вещество переходит при сверхвысоком давлении, недоступном пока в лаборатории, но которое существует внутри нейтронных звезд. При переходе в нейтронное состояние, электроны вещества объединяются с протонами и превращаются в нейтроны. Для этого необходимо, чтобы силы гравитации сжали вещество настолько, чтобы преодолеть отталкивание электронов, обусловленное принципом Паули. В результате в нейтронном состоянии вещество полностью состоит из нейтронов и имеет плотность порядка ядерной. Температура вещества при этом не должна быть очень высокой (в энергетическом эквиваленте, в пределах от сотни МэВ).
Другие состояния[править | править код]
Тёмная материя[править | править код]
Форма материи, которая не испускает электромагнитного излучения и не взаимодействует с ним. Это свойство данной формы вещества делает невозможным её прямое наблюдение. Однако возможно обнаружить присутствие тёмной материи по создаваемым ею гравитационным эффектам.
Обнаружение природы тёмной материи поможет решить проблему скрытой массы, которая, в частности, заключается в аномально высокой скорости вращения внешних областей галактик.
Сверхкритический флюид[править | править код]
Состояние вещества, при котором исчезает различие между жидкой и газовой фазой. Любое вещество, находящееся при температуре и давлении выше критической точки, является сверхкритической жидкостью. Свойства вещества в сверхкритическом состоянии промежуточные между его свойствами в газовой и жидкой фазе. Так, СКФ обладает высокой плотностью, близкой к жидкости, низкой вязкостью и при отсутствии межфазных границ поверхностное натяжение также исчезает. Коэффициент диффузии при этом имеет промежуточное между жидкостью и газом значение. Вещества в сверхкритическом состоянии могут применяться в качестве заменителей органических растворителей в лабораторных и промышленных процессах. Наибольший интерес и распространение в связи с определёнными свойствами получили сверхкритическая вода и сверхкритический диоксид углерода.
Вырожденная материя[править | править код]
- Ферми-газ — 1-я стадия: электронно-вырожденный газ, наблюдается в белых карликах, играет важную роль в эволюции звёзд.
- 2-я стадия — нейтронное состояние: в него вещество переходит при сверхвысоком давлении, недостижимом пока в лаборатории, но существующем внутри нейтронных звёзд. При переходе в нейтронное состояние электроны вещества взаимодействуют с протонами и превращаются в нейтроны. В результате вещество в нейтронном состоянии полностью состоит из нейтронов и обладает плотностью порядка ядерной. Температура вещества при этом должна быть ниже триллиона градусов (в энергетическом эквиваленте не более сотни МэВ).
- При повышении температуры выше сотни МэВ в нейтронном состоянии начинают рождаться и аннигилировать разнообразные мезоны. При дальнейшем повышении температуры происходит деконфайнмент, и вещество переходит в состояние кварк-глюонной плазмы. Оно состоит уже не из адронов, а из постоянно рождающихся и исчезающих кварков и глюонов. Возможно[12], деконфайнмент происходит в два этапа.
- При дальнейшем неограниченном повышении давления без повышения температуры вещество коллапсирует в чёрную дыру.
- При одновременном повышении и давления, и температуры к кваркам и глюонам добавляются иные частицы. Что происходит с веществом, пространством и временем при температурах, близких к планковской, пока неизвестно.
См. также[править | править код]
- Тройная точка
- Нормальные и стандартные условия
Примечания[править | править код]
Литература[править | править код]
- Шульц М. М., Мазурин О. В. Современное представление о строении стёкол и их свойствах. — Л.: Наука, 1988. — ISBN 5-02-024564-X.
Источник
