Какие свойства соли и воды лежат в основе

- Отстаивание
- Центрифугирование
- Фильтрование
- Действие магнитом
- Выпаривание. Кристаллизация
- Дистилляция (перегонка)
Для получения чистых веществ используют различные способы разделения смесей.
| Способы разделения смесей | |
|---|---|
| неоднородных (гетерогенных) | однородных (гомогенных) |
| — Отстаивание — Фильтрование — Действие магнитом — Центрифугирование | — Выпаривание. Кристаллизация. — Дистилляция (перегонка) |
Процессы разделения смесей основаны на различных физических свойствах компонентов, образующих смесь.
Отстаивание
Отстаивание — это разделение неоднородной жидкой смеси на компоненты, путём её расслоения с течением времени под действием силы тяжести.
Отстаиванием можно разделить смесь нерастворимых в воде веществ, имеющих разную плотность.
Пример. Смесь из железных и древесных опилок можно разделить, если высыпать её в сосуд с водой (1), взболтать и дать отстояться. Железные опилки опустятся на дно сосуда, а древесные будут плавать на поверхности воды (2), и их вместе с водой можно будет слить в другой сосуд (3):

На этом же принципе основано разделение смесей малорастворимых друг в друге жидкостей.
Пример. Смеси бензина с водой, нефти с водой, растительного масла с водой быстро расслаиваются, поэтому их можно разделить с помощью делительной воронки:

Отстаиванием также можно разделить вещества, которые осаждаются в воде с различной скоростью.
Пример. Смесь из глины и песка можно разделить, если высыпать её в сосуд с водой (1), взболтать и дать отстояться. Песок оседает на дно значительно быстрее глины (2):

Этот способ используется для отделения песка от глины в керамическом производстве (производство глиняной посуды, красных кирпичей и др.).
Центрифугирование
Центрифугирование — это разделение неоднородных жидких смесей путём вращения.
Пример. Если компоненты неоднородной жидкой смеси очень малы, такие смеси разделяют центрифугированием. Такие смеси помещают в пробирки и вращают с большой скоростью в специальных аппаратах — центрифугах.

Перед центрифугированием частицы смеси распределены по объёму пробирки равномерно. После центрифугирования более лёгкие частицы всплывают наверх, а тяжёлые оседают на дно пробирки.
С помощью центрифугирования, к примеру, отделяют сливки от молока.
Фильтрование
Фильтрование — это разделение жидкой неоднородной смеси на компоненты, путём пропускания смеси через пористую поверхность. В роли пористой поверхности может выступать бумажная воронка, марля, сложенная в несколько слоёв, или любой другой пористый материал, способный задержать один или несколько компонентов смеси.
Фильтрованием можно разделить неоднородную смесь, состоящую из растворимых и нерастворимых в воде веществ.
Пример. Чтобы разделить смесь, состоящую из поваренной соли и песка, её можно высыпать в сосуд с водой, взболтать и затем эту смесь пропустить через фильтровальную бумагу. Песок остаётся на фильтровальной бумаге, а прозрачный раствор поваренной соли проходит через фильтр:

При необходимости, растворённую поваренную соль из воды можно выделить выпариванием.
Действие магнитом
С помощью магнита из неоднородной смеси выделяют вещества, способные к намагничиванию.
Пример. C помощью магнита можно разделить смесь, состоящую из порошков железа и серы:

Выпаривание. Кристаллизация
Выпаривание — это способ разделения жидких смесей путём испарения одного из компонентов. Скорость испарения можно регулировать с помощью температуры, давления и площади поверхности испарения.
Пример. Чтобы растворённую в воде поваренную соль выделить из раствора, последний выпаривают:

Вода испаряется, а в фарфоровой чашке остаётся поваренная соль. Иногда применяют упаривание, т. е. частичное испарение воды. В результате образуется более концентрированный раствор, при охлаждении которого растворённое вещество выделяется в виде кристаллов. Этот процесс получил название кристаллизации.
Дистилляция (перегонка)
Дистилляция (перегонка) — это способ разделения жидких однородных смесей путём испарения жидкости с последующим охлаждением и конденсацией её паров. Данный способ основан на различии в температурах кипения компонентов смеси.
Пример. При нагревании жидкой однородной смеси сначала закипает вещество с наиболее низкой температурой кипения. Образующиеся пары конденсируются при охлаждении в другом сосуде. Когда этого вещества уже не останется в смеси, температура начнёт повышаться, и со временем закипает другой жидкий компонент:

Таким способом получают, к примеру, дистиллированную воду.
Источник

ПРАКТИЧЕСКАЯ РАБОТА №3 «СПОСОБЫ РАЗДЕЛЕНИЯ СМЕСЕЙ. ОЧИСТКА ПОВАРЕННОЙ СОЛИ »
Учитель химии МАОУ « СОШ №12»
Г.Кунгура Фотеева В.А.

Давайте вспомним: Ч И С Т Ы Е В Е Щ Е С Т В А –это…
- Сахар, соль.
- Металлы
- Неметаллы
- СОСТОЯТ ИЗ МОЛЕКУЛ ДАННОГО ВЕЩЕСТВА
Например: дистиллированная вода
- Чистые вещества имеют постоянные физические свойства; t пл. t кип.
Смеси
Однородные Неоднородные

Однородные смеси
- Смеси,образованные хорошо растворимыми веществами друг в друге.
- 1.Вода + Сахар
- 2.Вода + Соль
- 3.Вода + Спирт
- 4.Воздух

Неоднородные смеси
Такие смеси образуются при смешивании веществ не растворимых между собой –ВЗВЕСИ:
1.Вода+масло;
2. Железо + Сера;
3.Вода + мел;
В смесях свойства веществ сохраняются.

С М Е С И М О Ж Н О Р А З Д Е Л И Т Ь:
- 1.Однородные:
- А)Выпаривание (стр.91)
- Б)Кристаллизация
- В)Хроматография

НЕОДНОРОДНЫЕ СМЕСИ МОЖНО РАЗДЕЛИТЬ:
- А) Намагничиванием
- Б)Отстаиванием
- В)Фильтрованием (стр.91)
- Г) Выпариванием (стр.91)
- Д) Дистилляцией (стр.80) и т.д.( стр.90,92,93)
- Часто разделение смеси происходит комплексно: Например: вода,песок,соль.
- 1.Отстаивание или фильтрование.
- 2.Выпаривание.

ПРАКТИЧЕСКАЯ РАБОТА №3 СПОСОБЫ РАЗДЕЛЕНИЯ СМЕСЕЙ. ОЧИСТКА ПОВАРЕННОЙ СОЛИ.

Цель работы:
1. ознакомиться со способами разделения смесей; 2.освоить простейшие способы очистки веществ; 3. отработать навыки работы с химическим оборудованием.

- Оборудование: ________________________________________________________________
- Реактивы: _________________________________________________________________________

Ход работы
Задание 1. Рассмотрите выданную смесь поваренной соли и песка. Какие физические свойства характерны для поваренной соли и песка? Заполните таблицу.
СВОЙСТВА
Поваренная соль
1. Агрегатное состояние
2. Цвет
Речной песок
3. Запах
4. Растворимость в воде

- Задание 2 . Растворение загрязненной поваренной соли в воде
- В химический стакан налейте 7 – 8 мл воды.
- Добавьте при помешивании загрязненную поваренную соль. Раствор помешивайте осторожно с помощью стеклянной палочки.
- Рассмотрите полученный раствор. Опишите, что вы наблюдаете (цвет, частицы в стакане и т. д.)

Задание 2 . Растворение загрязненной поваренной соли в воде
- В химический стакан налейте 7 – 8 мл воды.
- Добавьте при помешивании загрязненную поваренную соль. Раствор помешивайте осторожно с помощью стеклянной палочки.
- Рассмотрите полученный раствор. Опишите, что вы наблюдаете (цвет, частицы в стакане и т. д.)

Задание 3. Очистка неоднородного раствора соли фильтрованием .
1.Пользуясь указаниями учителя, приготовьте фильтр.
2.Фильтр поместите в воронку.
3.Налейте на фильтровальную бумагу, вставленную в воронку, немного воды , смочите весь фильтр.
4.Воронку с фильтром вставьте в отверстие колбы.
5.По стеклянной палочке наливайте загрязненный раствор поваренной соли.
ФИЛЬТРАТ
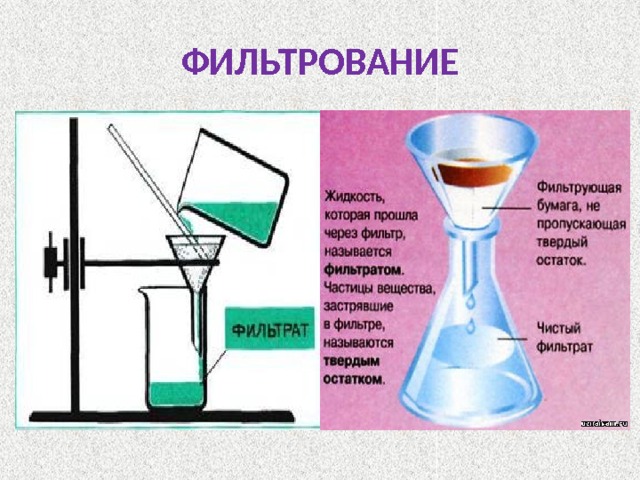
ФИЛЬТРОВАНИЕ

Ответьте на вопросы:
1) Что осталось на фильтре?
2)Каков внешний вид фильтрата?
3) В состав фильтрата входят: ….?
4)Какие свойства поваренной соли и песка лежат в основе проведенного способа разделения смеси?

Задание 4. Сделайте рисунок прибора для фильтрования, обозначьте его основные детали:
- воронка;
- фильтр;
- стеклянная палочка;
- колба;
- раствор загрязненной поваренной соли;
- фильтрат;
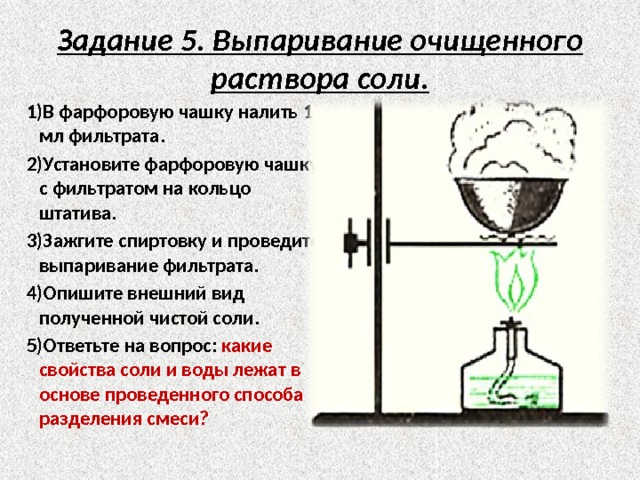
Задание 5. Выпаривание очищенного раствора соли.
1)В фарфоровую чашку налить 1 мл фильтрата.
2)Установите фарфоровую чашку с фильтратом на кольцо штатива.
3)Зажгите спиртовку и проведите выпаривание фильтрата.
4)Опишите внешний вид полученной чистой соли.
5)Ответьте на вопрос: какие свойства соли и воды лежат в основе проведенного способа разделения смеси?

- Приведите рабочее место в порядок.
- Оформите отчет о проделанной работе. При оформлении отчета используйте материал учебника: §25, рис. 82, 83.
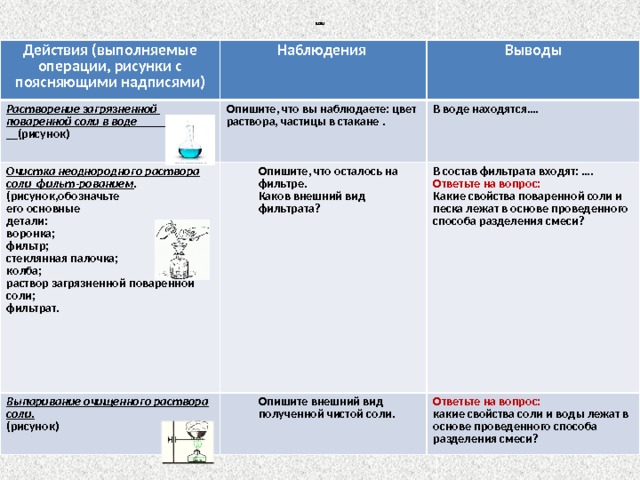
Отчет:
Действия (выполняемые операции, рисунки с поясняющими надписями)
Растворение загрязненной поваренной соли в воде (рисунок)
Наблюдения
Опишите, что вы наблюдаете: цвет раствора, частицы в стакане .
Выводы
Очистка неоднородного раствора соли фильт-рованием .
В воде находятся….
(рисунок,обозначьте его основные
Опишите, что осталось на фильтре.
Выпаривание очищенного раствора соли.
(рисунок)
Каков внешний вид фильтрата?
В состав фильтрата входят: ….
детали: воронка;
Опишите внешний вид полученной чистой соли.
фильтр;
Ответьте на вопрос:
Ответьте на вопрос:
Какие свойства поваренной соли и песка лежат в основе проведенного способа разделения смеси?
стеклянная палочка;
какие свойства соли и воды лежат в основе проведенного способа разделения смеси?
колба;
раствор загрязненной поваренной соли;
фильтрат.

Выводы по работе :
- 1.Какая смесь однородная или неоднородная вам была выдана? 2.Какие способы разделения смесей вы использовали на практической работе?
- 3.Закончите предложение: в результате … и … мы … загрязненную соль от примесей речного песка и получили … … соль.
- 4.Запишите химическую формулу и название полученного вами чистого вещества.

ДОМАШНЕЕ ЗАДАНИЕ
§23,стр.83-85.
Упр.4 стр.85.
Источник
Презентация на тему: ” Практическая работа 2 СПОСОБЫ РАЗДЕЛЕНИЯ СМЕСЕЙ. ОЧИСТКА ПОВАРЕННОЙ СОЛИ.” — Транскрипт:
1
Практическая работа 2 СПОСОБЫ РАЗДЕЛЕНИЯ СМЕСЕЙ. ОЧИСТКА ПОВАРЕННОЙ СОЛИ
2
Цель работы 1) ознакомиться со способами разделения смесей; 2) освоить простейшие способы очистки веществ; 3) отработать навыки работы с химическим оборудованием.
3
Инструкция к работе. Задание 1 Поваренная соль Песок 1. Агрегатное состояние 2. Цвет 3. Запах 4. Растворимость в воде Рассмотрите выданную смесь поваренной соли и песка. Какие физические свойства характерны для поваренной соли и песка? Заполните таблицу:
4
Инструкция к работе. Задание 2 Растворение загрязненной поваренной соли в воде В химический стакан налейте 7 – 8 мл воды. Добавьте при помешивании загрязненную поваренную соль. Раствор помешивайте осторожно с помощью стеклянной палочки. Рассмотрите полученный раствор. Опишите, что вы наблюдаете (цвет, частицы в стакане и т. д.)
5
Инструкция к работе. Задание 3 Очистка неоднородного раствора соли фильтрованием. Приготовьте фильтр. Фильтр поместите в воронку. Налейте на фильтровальную бумагу, вставленную в воронку, немного воды, смочите весь фильтр. Подставьте к концу воронки чистый стакан. По стеклянной палочке наливайте загрязненный раствор поваренной соли. Опишите, что осталось на фильтре. Каков внешний вид фильтрата? В состав фильтрата входят: ….? Какие свойства поваренной соли и песка лежат в основе проведенного способа разделения смеси?
6
Инструкция к работе. Задание 4 Сделайте рисунок прибора для фильтрования, обозначьте его основные детали: штатив; воронка; фильтр; стеклянная палочка; химический стакан; раствор загрязненной поваренной соли; фильтрат; кольцо.
7
Инструкция к работе. Задание 5 Выпаривание очищенного раствора соли. В фарфоровую чашку налить 1 мл фильтрата. Установите фарфоровую чашку с фильтратом на кольцо штатива. Зажгите спиртовку и проведите выпаривание фильтрата. Опишите внешний вид полученной чистой соли. Ответьте на вопрос: Какие свойства соли и воды лежат в основе проведенного способа разделения смеси? Приведите рабочее место в порядок. Оформите отчет о проделанной работе.
Источник
I. Новый материал
При подготовке урока использованы материалы автора: Н.К.Черемисиной,
учителя химии средней школы № 43
(г. Калининград), Источник
Мы живем среди химических веществ. Мы вдыхает воздух,
а это смесь газов (азота, кислорода и других), выдыхаем углекислый
газ. Умываемся водой – это еще одно вещество, самое распространенное
на Земле. Пьём молоко – смесь воды с мельчайшими капельками
молочного жира, и не только: здесь еще есть молочный белок казеин,
минеральные соли, витамины и даже сахар, но не тот, с которым
пьют чай, а особый, молочный – лактоза. Едим яблоки, которые состоят из
целого набора химических веществ – здесь и сахар, и яблочная кислота,
и витамины… Когда прожеванные кусочки яблока попадают в желудок, на
них начинают действовать пищеварительные соки человека, которые помогают
усваивать все вкусные и полезные вещества не только яблока, но и любой другой
пищи. Мы не только живем среди химических веществ, но и сами из
них состоим. Каждый человек – его кожа, мышцы, кровь, зубы, кости, волосы
построены из химических веществ, как дом из кирпичей. Азот, кислород, сахар,
витамины – вещества природного, естественного происхождения. Стекло, резина,
сталь – это тоже вещества, точнее, материалы (смеси веществ). И стекло,
и резина – искусственного происхождения, в природе их не было. Совершенно
чистые вещества в природе не встречаются или встречаются очень редко.
Чем же отличаются чистые вещества от смесей веществ?
Индивидуальное чистое вещество обладает определённым
набором характеристических свойств (постоянными физическими свойствами). Только
чистая дистиллированная вода имеет tпл = 0 °С, tкип= 100 °С, не имеет вкуса.
Морская вода замерзает при более низкой, а закипает при более высокой
температуре, вкус у нее горько-соленый. Вода Черного моря замерзает при более
низкой, а закипает при более высокой температуре, чем вода Балтийского моря.
Почему? Дело в том, что в морской воде содержатся другие вещества, например
растворенные соли, т.е. она представляет собой смесь различных веществ, состав
которой меняется в широких пределах, свойства же смеси не являются постоянными.
Определение понятия «смесь» было дано в XVII в. английским
ученым Робертом Бойлем: «Смесь – целостная система, состоящая из разнородных компонентов».
Сравнительная характеристика смеси и чистого вещества
Признаки сравнения | Чистое вещество | Смесь |
Состав | Постоянный | Непостоянный |
Вещества | Одно и то же | Различные |
Физические свойства | Постоянные | Непостоянные |
Изменение энергии при образовании | Происходит | Не происходит |
Разделение | С помощью химических реакций | Физическими методами |
Смеси отличаются друг от друга по внешнему виду.
Классификация смесей показана в таблице:

Приведём
примеры суспензий (речной песок + вода), эмульсий (растительное масло + вода) и
растворов (воздух в колбе, поваренная соль + вода, разменная монета: алюминий +
медь или никель + медь).
В суспензиях видны частицы твердого вещества, в эмульсиях – капельки
жидкости, такие смеси называются неоднородными (гетерогенными), а в растворах
компоненты не различимы, они являются однородными (гомогенными) смесями.
Способы разделения смесей
В природе
вещества существуют в виде смесей. Для лабораторных исследований, промышленных
производств, для нужд фармакологии и медицины нужны чистые вещества.
Для очистки
веществ применяются различные способы разделения смесей

Эти способы основаны на различиях в физических свойствах компонентов
смеси.
Рассмотрим
способы разделения гетерогенных и гомогенных смесей.
Пример смеси | Способ |
Суспензия – смесь речного песка с водой | Отстаивание Разделение отстаиванием Разделение |
Смесь песка и поваренной соли в воде | Фильтрование На чем основано разделение гетерогенных смесей с Разделение смеси крахмала и воды фильтрованием |
Смесь порошка железа и серы | Действие Порошок железа притягивался магнитом, а порошок серы Несмачивающийся порошок серы всплывал на поверхность Разделение смеси серы и железа с помощью |
Раствор соли в воде – гомогенная смесь | Выпаривание или Вода испаряется, а в фарфоровой чашке остаются Если же разделять смесь спирта и воды, то первым Разделение однородных смесей |
Особым методом разделения компонентов, основанным на
различной поглощаемости их определенным веществом, является хроматография.
Дома вы можете проделать следующий опыт. Подвесьте
полоску из фильтровальной бумаги над сосудом с красными чернилами, погружая в
них лишь конец полоски. Раствор впитывается бумагой и поднимается по ней. Но
граница подъема краски отстает от границы подъема воды. Так происходит
разделение двух веществ: воды и красящего вещества в чернилах.
С помощью хроматографии русский ботаник М. С. Цвет
впервые выделил хлорофилл из зеленых частей растений. В промышленности и
лабораториях вместо фильтровальной бумаги для хроматографии используют крахмал,
уголь, известняк, оксид алюминия. А всегда ли требуются вещества с одинаковой
степенью очистки?
Для различных целей необходимы вещества с различной
степенью очистки. Воду для приготовления пищи достаточно отстоять для удаления
примесей и хлора, используемого для ее обеззараживания. Воду для питья нужно
предварительно прокипятить. А в химических лабораториях для приготовления
растворов и проведения опытов, в медицине необходима дистиллированная вода,
максимально очищенная от растворенных в ней веществ. Особо чистые вещества,
содержание примесей в которых не превышает одной миллионной процента,
применяются в электронике, в полупроводниковой, ядерной технике и других точных
отраслях промышленности.
Прочитайте стихотворение Л. Мартынова «Дистиллированная
вода»:
Вода
Благоволила
Литься!
Она
Блистала
Столь чиста,
Что ни напиться,
Ни умыться.
И это было неспроста.
Ей не хватало
Ивы, тала
И горечи цветущих лоз,
Ей водорослей не хватало
И рыбы, жирной от стрекоз.
Ей не хватало быть волнистой,
Ей не хватало течь везде.
Ей жизни не хватало
Чистой –
Дистиллированной воде!
Применение дистиллированной воды
II. Задания для закрепления
1) Поработайте с тренажёрами №1-4 (необходимо загрузить тренажёр)
Тренажёр №1. Чистые вещества и смеси
Тренажёр №2. Смеси
Тренажёр №3. Смеси в природе
Тренажёр №4. Смеси в сельском хозяйстве
2) Решите задачу:
Дана смесь сахара, речного песка и железных опилок. Предложите способ разделения этой смеси.
3) Творческое задание:
Подготовьте электронную презентацию на тему “Чистые вещества и смеси, которые нас окружают”
Источник
