Какие свойства проявляют оксид и гидроксид кальция
Процессы глобализации, захватывающие население Земли, вынуждают человеческое общество создавать новую искусственную среду обитания – мегаполисы, все больше напоминающие гигантские пчелиные соты, стремительно растущие ввысь. Строительная индустрия становится одной из самых перспективных и выгодных отраслей производства, требуя для своих нужд наиболее дешевое и легкодоступное строительное сырье. Поэтому ежегодно во всем мире увеличивается добыча известняка, мела и портландита. Многотонные грузы горнодобывающей промышленности перерабатываются химическими предприятиями. В результате получают оксид кальция, гидроксид кальция и их соли, которые затем используют в строительстве.

Пригородные источники карбонатов
Оксид кальция – CaO – является исходным веществом в цепи получения важнейших строительных материалов, таких как гидроксид кальция, портландцемент, силикатный бетон. Для его производства используют широко распространенные на Земле осадочные породы, например, такие как известняк и мел, являющиеся природными разновидностями карбоната кальция.
Мудрая природа в течение миллионов лет трудилась, откладывая и сохраняя отмершие остатки водорослей, раковины двустворчатых и брюхоногих моллюсков, известковые скелеты колониальных морских животных – мшанок. Затем все это склеивалось частицами ила. Таким образом сформировались массивы осадочных пород в Крыму, Молдове, Казахстане, странах Средиземного моря, возраст которых датируется меловым периодом Мезозойской эры.

Названий много, а вещество одно
Чем старше возраст используемого человеком химического соединения, тем больше у него появляется различных названий. Кипелка, негашёная известь, жженая известь – все эти слова относятся к одному соединению – CaO. Кипелкой его называют потому, что в реакции с водой оксид кальция кипит, выделяя водяной пар, и смесь сильно разогревается. Это химическое соединение можно погасить водой и получить гашеную известь – гидроксид кальция, также имеющий название «пушонка» или «известковое тесто». Если же вещество не взаимодействует с водой, то имеет название «негашёная известь». Раствор гидроксида кальция называют известковым молоком. Термин «жженая известь» указывает на способ получения: выжиганием известняка или мела.
Промышленное производство соединений кальция
Технология выжигания известняка практически не изменилась со времен постройки пирамид в Гизе и сооружения первых православных храмов из «белого камня» на Руси. Белым камнем наши прародители называли известняк и портландит – минерал, содержащий гидроксид кальция. В специальных шахтных печах сырье и топливо, например, антрацит или кокс, загружают слоями и поджигают снизу. Важную роль в технологическом процессе играет вентиляция, она должна быть непрерывной. Это способствует удалению ненужного диоксида углерода и снижению температуры реакции что немаловажно с точки зрения экономичности и безопасности работы шахтной печи.

Продукт выжигания известняка CaO представляет собой белое, очень тугоплавкое кристаллическое вещество, температура плавления которого составляет 2627 °C. Он служит исходным материалом, из которого можно получить гидроксид кальция.
Ранее мы уже упоминали специфическую особенность CaO: если куски этого соединения залить водой, то происходит сильное разогревание и шипение. На глазах плотные куски превращаются в рыхлый порошок белого цвета – гидроксид кальция. Уравнение экзотермической реакции:
CaO+H2O =Ca(OH)2 ∆H= -64 кДж
Именно этой особенностью и объясняется название «пушонка», используемое в строительстве.
Осторожность не помешает
Прежде чем перейти к рассмотрению областей применения этих соединений кальция, самое время напомнить, что в классификационной таблице вредных химических веществ они находятся в 3 классе опасности. Это жидкости и суспензии (растворы твердых веществ с низкой растворимостью), выделяющие легковоспламеняющиеся пары, имеющие температуру вспышки 61°C и ниже. Поэтому в химических лабораториях гидроксид кальция хранят в специальных сейфах. Так как раствор обладает сильнощелочной реакцией и его рН>12, категорически запрещено попадание капель вещества на слизистую глаз, кожу лица и рук.

Если все же это произошло, следует немедленно промыть пораженный участок под струей холодной воды в течение 5-10 минут. Затем обработать его физиологическим (изотоническим) 0,9% раствором хлорида натрия NaCl или 1% раствором аскорбиновой кислоты. Если использовать во время работы защитные очки и перчатки, это может повысить безопасность и сохранить здоровье.
Применение гидроксида кальция в строительстве
Известковый строительный раствор (или, проще говоря, известь) используется в строительстве очень давно. Еще в цивилизациях ацтеков и майя, в период расцвета Вавилонского царства, древние зодчие применяли смесь извести, песка и воды для строительной кладки, связывая ею кирпичи и целые блоки, вытесанные из гранита или мрамора. Очень пластичное, жирное на ощупь известковое тесто, представляющее собой смесь Ca(OH)2 и воды в пропорции 1:3, используется для санации архитектурных композиций Москвы, Санкт-Петербурга и городов Золотого Кольца России. Реставрационные работы, выполняемые при очень сильных повреждениях исторических памятников, также не обходятся без использования известкового теста.

Другие отрасли применения соединений кальция
Хотя приоритетной отраслью, использующей соединения кальция, можно считать строительство, тем не менее, интересно и необычно применение их в других областях человеческий жизни.
Так, (CaOH)2 используется как пищевая добавка E 526. Например, в каждом килограмме сливочного масла присутствует 2 г этого соединения, выполняющего роль эмульгатора и регулятора кислотности, то есть предохраняющего пищевой продукт от быстрой порчи вследствие окисления. E 526 добавляют с такой же целью в фруктовые соки, вино, замороженные овощи, вяленую рыбу.
Врачи-стоматологи используют Ca(OH)2 в составе временных или постоянных пломб, а бактерицидные свойства позволяют применять его в качестве внутриканального наполнителя, а также для профилактики и лечения кариозных полостей.
Незаменима гашеная известь для удаления карбонатной жесткости питьевой воды, обусловленной присутствием в ней растворимых гидрокарбонатов. Их реакции с гидроксидом кальция в молекулярной и ионной форме имеют такой вид:
Ca(HCO3)2+Ca(OH)2 = 2CaCO3↓+2H2O
Ca2++2HCO3- + Ca(OH)2 →CaCO3↓+2H2O
Научно-технический прогресс не стоит на месте. С каждым годом ученые изобретают все больше новых и современных материалов на основе соединений кальция, например, композитов, обладающих более ценными качествами и свойствами.
Источник
Основные методы и формы
Проведения урока: Беседа, игра-соревнование, демонстрация опытов, работа в группах, работа с книгой, выполнение деференцированных заданий, взаимоконтроль, самоконтроль.
Ход урока
Организационный момент
Сообщение темы, целей и задач урока
Мотивация целей
На прошлом уроке мы изучили свойства кальция. Какие соединения образует кальций? Какие из этих соединений наиболее важные и имеют широкое применение в народном хозяйстве? Сегодня нам предстоит ответить на эти вопросы. А тем как применение зависит от свойств, то мы будем изучать свойства соединения кальция , его оксида и гидроксидов.
Актуализация опорных знаний
Интерактивная технология “Микрофон”
Какую валентность и степень окисления имеет кальций в соединениях?
При каких условиях кальций окисляется кислородом и что при этом образуется?
Техническое название оксида кальция?
Какие вещества образуются при взаимодействии кальция с водой?
Что представляет собой оксид и гидроксид кальция?
За правильный ответ ученик получает один балл
Игровые моменты
Найдите ошибку
- 1S22S22P63S23P2III период, II группа, главная подгруппа
- 1S22S22P63S23P64S2VI период, II группа, главная подгруппа
- 1S22S22P63S2 III период, II группа, главная подгруппа
“Крестики – нолики”
Соединить прямой линей формулы оксидов
CaO | SiO2 | P2O5 |
Na2O | CO2 | Al2O3 |
BaO | NO2 | ZnO |
Соединить прямой линей формулы щелочей
Mg(OH)2 | NaO | Al(OH)3 |
KOH | Ba(OH)2 | H2CrO4 |
Cu(OH)2 | Ca(OH)2 | LiOH |
“Кто быстрей”
Осуществить превращения, назвать вещества:


Игра проходит между двумя группами учащихся из 5 человек. За каждое правильное уравнение 1 балл. Каждый участник должен написать одно уравнение. Побеждает та команда, которая записала правильно все уравнения реакций.
Химический диктант
Закончить предложения:
Реакция с выделением тепла называется…
Основным оксидам соответствуют…
Щелочи – это…
Цвет фенолфталеина в растворе щелочи…
На воздухе негашеная известь поглощает…
Реакция основания с кислотой называется…
Изучение новой темы
Организация восприятия и понимания новой информации
Учитель зачитывает отрывок из романа Л. Буссенара “Похитители бриллиантов”, где описывается взрыв в пещере рудничного газа, в результате чего погибают бандиты: “Пожар пылал несколько часов подряд. Пещера превратилась в горящую печь по обжигу известняка. Неслыханной силы пламя обожгло весь известковый пласт, который представляет собой углекислую соль кальция. Под действием огня известняк разложился…, и получилось именно то, что называют негашеной известью. Осталось только, чтобы на нее попало известное количество воды. Так и случилось. Ливень, который последовал за грозой, залил всю эту огромную массу негашеный извести. Она разбухла, стала непреодолимой силой распирать сжимающий ее уголь и выталкивать его по направлению к пропасти. Скалы, деревья, клад, мумии – все исчезло в мгновение ока вместе с презренными негодяями”
Какие процессы произошли в пещере в результате взрыва газа СН4 и последующего ливня? Записать уравнение реакций. За выполнение задания – 2 балла. По желанию один ученик пишет уравнения на доске
Демонстрация опыта: взаимодействие негашеной извести с водой
Учащимся предлагается ответить на вопросы:
Почему происходит бурная реакция?
Какое вещество образуется?
Как определить характер этого вещества?
Самостоятельная работа
Зная, что СаО и Са(ОН)2 обладают основными свойствами, написать соответствующие уравнения реакций
Работа с книгой
Ответить на вопросы:
а) Чем отличается известковое молоко от известковой
воды?
б) Где применяются гашеная и негашеная известь?
После выполнения ответы озвучивают, учащимся предлагается осуществить самоконтроль (за правильный ответ – 1 балл)
Закрепление изученного материала.
Учащиеся делают выводы относительно нового изученного материала.
Самостоятельная работа
Средний уровень:
1) Осуществить преобразования:
Ca > CaO > > CaCO3 > CO2
2) При обжиге известняка массой 2,2 г получили 1,12 г кальций оксида.
Определить массовую долю кальций карбоната в известняке.
Достаточный уровень:
Осуществить преобразования:
CaO > Ca3(PO4)2 > H3PO4
Ca(OH)2 > Ca(NO3)2 > NaNO3
Известняк массой 1,5 кг с массовой долей кальций карбоната 90% прокалили в печи. К твердому остатку добавили избыток воды. Какая масса кальций гидроксида находится в полученном растворе?
Высокий уровень:
Записать цепочку преобразований и составить соответствующее уравнения реакций по следующей схеме:
металл > основной оксид > щелочь > соль > кислотный оксид > кислота
Массовая доля кальций карбоната в извести составляют 90%. Какую массу известняка нужно взять для получения гашеной извести массой 20 кг?
Домашние задание:
Изучит параграф 34
Выполнить упражнение 207 (достаточный уровень)
Решить задачу 211 (высокий уровень)
Подведение итогов
Учитель вместе с учащимися выставляет оценки. В течении урока за правильные ответы выдались жетоны (“1 балл”)
Ученики дают оценку уроку, высказывают свое мнение.
Источник
Гидроокись кальция — неорганическое соединение, щелочь кальция. Ее  формула Ca(OH)2. Так как это вещество известно человечеству с древнейших времен, то у него есть традиционные названия: гашеная известь, известковая вода, известковое молоко, пушенка.
формула Ca(OH)2. Так как это вещество известно человечеству с древнейших времен, то у него есть традиционные названия: гашеная известь, известковая вода, известковое молоко, пушенка.
Пушенка — тонкоизмельченный порошок. Известковое молоко — водная взвесь щелочи, непрозрачная белая жидкость. Известковая вода — прозрачный водный раствор щелочи, получается после фильтрации известкового молока.
Гашеная известь получила название по способу получения: негашеную известь (оксид кальция) заливают водой (гасят).
Свойства
 Мелкий кристаллический порошок белого цвета, без запаха. Очень плохо растворяется в воде, совсем не растворяется в спирте, легко растворяется в разбавленной азотной и соляной кислотах. Пожаробезопасен и даже препятствует возгоранию. При нагревании разлагается на воду и оксид кальция.
Мелкий кристаллический порошок белого цвета, без запаха. Очень плохо растворяется в воде, совсем не растворяется в спирте, легко растворяется в разбавленной азотной и соляной кислотах. Пожаробезопасен и даже препятствует возгоранию. При нагревании разлагается на воду и оксид кальция.
Сильная щелочь. Вступает в реакции нейтрализации с кислотами с образованием солей — карбонатов. При взаимодействии с металлами выделяется взрывоопасный и горючий водород. Вступает в реакции с оксидами углерода (IV) и (II), с солями.
Реакция получения гидроокиси кальция методом «гашения» происходит с большим выделением тепла, вода начинает кипеть, едкий раствор разбрызгивается в разные стороны — это надо учитывать при работе.
Меры предосторожности
Попадание на кожу частиц сухого порошка или капель раствора гидроокиси кальция вызывает раздражение, зуд, химический ожог, язвы, сильную боль. Повреждение глаз может вызвать потерю зрения. Проглатывание вещества вызывает ожог слизистой горла, рвоту, кровавую диарею, резкое снижение давления, повреждение внутренних органов. Вдыхание частиц пыли может привести к затрудняющей дыхание опухоли горла.
Перед тем, как вызвать «Скорую помощь»:
— при отравлении дать пострадавшему выпить молока или воды;
— если химикат попал в глаза или на кожу, то места повреждения нужно промывать большим количеством воды хотя бы в течение четверти часа;
— если реактив случайно вдохнули, то пострадавшего нужно вывести из помещения и обеспечить доступ свежего воздуха.
Работать с гидроокисью кальция следует в хорошо проветриваемых помещениях с применением средств защиты: резиновых перчаток, защитных очков и респираторов. Химические эксперименты должны проводиться в вытяжном шкафу.
Применение
— В строительной индустрии хим.реактив добавляют в связывающие растворы, штукатурку, белила, гипсовые растворы; на его основе изготавливают силикатный кирпич и бетон; с его помощью подготавливают почву перед укладкой дорожных покрытий. Побелка деревянных деталей конструкций и заборов придает им огнестойкие свойства и защищает от гниения.
— Для нейтрализации кислотных газов в металлургии.
— Для получения твердых масел и добавок к маслам — в нефтеперерабатывающей отрасли.
— В химпроме — для производства щелочей натрия и калия, хлорной извести («хлорки»), стеарата кальция, органических кислот.
— В аналитической химии известковая вода служит индикатором углекислого газа (поглощая его, она мутнеет).
— С помощью гидроокиси кальция очищают сточные и промышленные воды; нейтрализуют кислоты поступающей в водопроводы воды, чтобы снизить ее коррозионное воздействие; удаляют из воды карбонаты (умягчают воду).
— С помощью Ca(OH)2 удаляют волосяной покров со шкур в кожевенном деле.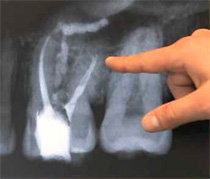
— Пищевая добавка Е526 в пищепроме: регулятор кислотности и вязкости, отвердитель, консервант. Используется при изготовлении соков и напитков, кондитерских и мучных изделий, маринадов, соли, детского питания. Применяется в сахарном производстве.
— В стоматологии известковое молоко используют для дезинфекции корневых каналов.
— Для лечения кислотных ожогов — в медицине.
— В сельском хозяйстве: средство для регулирования рН почв; в качестве натурального инсектицида от клещей, блох, жуков; для приготовления популярного фунгицида «бордосская жидкость»; для побелки стволов деревьев от вредителей и солнечных ожогов; как антимикробный и противогрибковый препарат для хранения овощей на складах; как минеральное удобрение.
— Гидроокись кальция снижает электросопротивление почвы, поэтому ею обрабатывают грунт при установке заземления.
— Хим.реактив используется при производстве эбонита, тормозных накладок, кремов для эпиляции.
Купить гашеную известь по хорошей цене, в розницу и оптом, с доставкой или самовывозом можно в химическом магазине PrimeChemicalsGroup.
Источник
Оксид и гидроксид магния
Особенности химии бериллия
Бериллий по своим свойствам значительно отличается от остальных элементов 2 группы Периодической системы химических элементов, ион Be2+ благодаря своему малому радиусу, высокой плотности заряда и большим значениям энергии ионизации устойчив только в газовой фазе. Поэтому химическая связь в бинарных соединениях бериллия обладает высокой долей ковалентности, поэтому соединения бериллия имеют довольно высокие температуры плавления и кипения.
По многим свойствам бериллий похож на алюминий («диагональное сходство»). Металлический бериллий пассивируется концентрированной азотной кислотой и проявляет амфотерные свойства, реагирует с кислотами и щелочами, выделяя водород. Оксид и гидроксид бериллия также реагируют с кислотами и щелочами:
BeO + 2HCl = BeCl2 + H2O;
BeO + 2NaOH + H2O = Na2[Be(OH)4] (в растворе);
BeO + 2NaOH = Na2BeO2 + H2O (в расплаве);
Be(OH)2 + 2HCl = BeCl2 + 2H2O;
Be(OH)2 + 2NaOH = Na2[Be(OH)4].
В отличие от солей щелочно-земельных металлов соли бериллия, подобно солям алюминия, легко гидролизуются:
BeCl2 + H2O = BeOHCl + HCl.
Бериллий образует более устойчивые комплексы, чем щелочно-земельные металлы:
BeSO4 + Na2SO4 = Na2[Be(SO4)2],
BeCO3 + (NH4)2CO3 = (NH4)2[Be(CO3)2].
Оксид магния MgO (жженая магнезия) – белое кристаллическое вещество, кристаллизуется в кубической гранецентрированной кристаллической решетке, структурный тип хлорида натрия. Температура плавления 2640°С, температура кипения 3600°С.
Мелкокристаллический оксид магния химически активен, медленно реагирует с водой:
MgO + H2O = Mg(OH)2;
поглощает углекислый газ:
MgO + CO2 = MgCO3;
растворяется в кислотах:
MgO + H2SO4 = MgSO4 +H2O.
Прокаленный оксид магния теряет химическую активность.
Получается при взаимодействии простых веществ:
2Mg + O2 = 2MgO;
при термическом разложении гидроксида и солей некоторых кислородсодержащих кислот:
MgCO3 = MgO + CO2.
Гидроксид магния Mg(OH)2 – белое кристаллическое вещество, имеет слоистую структуру, кристаллизуется в тригональной кристаллической решетке. При нагревании разлагается:
Mg(OH)2 = MgO + H2O.
В воде растворяется незначительно, является основанием средней силы. Реагирует с кислотами:
Mg(OH)2 + 2HCl = MgCl2 + 2H2O;
с оксидами неметаллов:
Mg(OH)2 + CO2 = MgCO3 + H2O;
участвует в реакциях обмена:
3Mg(OH)2 + 2FeCl3 = 2Fe(OH)3 + 3MgCl2;
Mg(OH)2 + 2NH4Cl = MgCl2 + 2NH3 + 2H2O.
Получается при растворении магния и оксида магния в воде, при взаимодействии солей магния со щелочами:
MgSO4 + 2NaOH = Mg(OH)2 + Na2SO4.
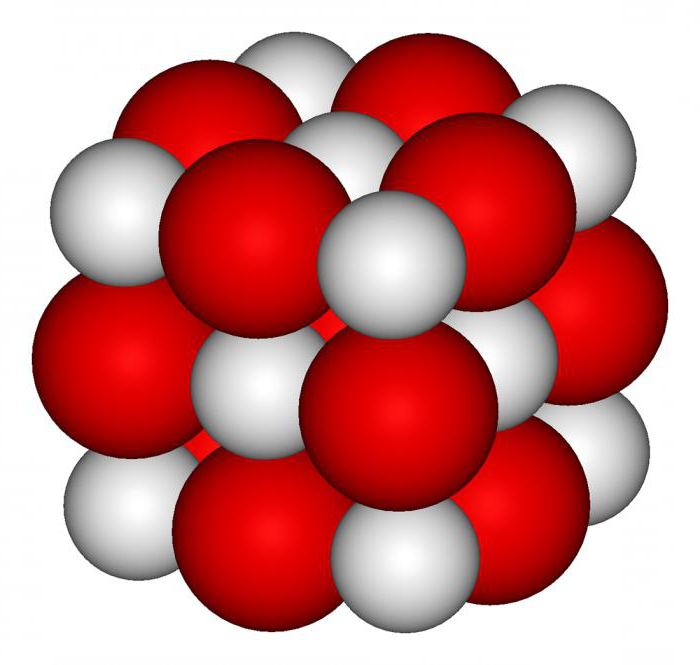
Оксид кальция СаO (негашеная известь) – белое кристаллическое вещество, кристаллизуется в кубической гранецентрированной кристаллической решетке, структурный тип хлорида натрия. Температура плавления 2627°С, температура кипения 2850°С.
Оксид кальция химически активен, энергично реагирует с водой, выделяя большое количество тепла:
СаO + H2O = Са(OH)2;
реагирует с оксидами неметаллов:
СаO + SO2 = CaSO3;
растворяется в кислотах:
CaO + 2HCl = CaCl2 +H2O.
Получается при взаимодействии простых веществ:
2Ca + O2 = 2CaO;
при термическом разложении гидроксида и солей некоторых кислородсодержащих кислот:
2Ca(NO3)2 = 2CaO + 4NO2 + O2.
Гидроксид кальция Ca(OH)2 (гашеная известь, пушонка) – белое кристаллическое вещество, кристаллизуется в гексагональной кристаллической решетке. При нагревании до 580°С разлагается:
Са(OH)2 = СаO + H2O.
В воде мало растворим, является сильным основанием. Реагирует с кислотами:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O;
с оксидами неметаллов:
Ca(OH)2 + 2CO2 = Ca(HCO3)2;
Ca(OH)2 + CO2 = CaCO3 + H2O;
участвует в реакциях обмена:
3Ca(OH)2 + 2FeCl3 = 2Fe(OH)3 + 3CaCl2;
Ca(OH)2 + 2NH4Cl = CaCl2 + 2NH3 + 2H2O.
Получается при растворении кальция и оксида кальция в воде, при взаимодействии солей кальция со щелочами:
Ca(NO3)2 + 2NaOH = Ca(OH)2 + 2NaNO3.
Источник
