Какие свойства проявляют металлы при взаимодействии с металлами

Среди металлов традиционно выделяют несколько групп. Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Простые вещества, обладающие металлическими свойствами, в химических реакциях всегда являются восстановителями. Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются свойства восстановителя).
Ряд активности металлов
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
активные металлы | металлы средней активности | неактивные металлы |
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять из растворов солей те металлы, которые в ряду активности стоят после него (правее).
3. Металлы, находящиеся в ряду активности левее водорода, способны вытеснять его из растворов кислот.
4. Щелочные и щелочноземельные металлы в любых водных растворах взаимодействуют прежде всего с водой.
Общие химические свойства металлов
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
Например, при взаимодействии магния с кислородом образуется оксид магния:
2Mg0+O02→2Mg+2O−2.
Видеофрагмент:
Обрати внимание!
Серебро, золото и платина с кислородом не реагируют.
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и иодом), образуя галогениды.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид натрия:
2Na0+Cl02→2Na+1Cl−1.
3. Металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка:
Zn0+S0→Zn+2S−2.
Видеофрагмент:
Взаимодействие цинка с серой
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
Например, при взаимодействии лития с азотом образуется нитрид лития:
6Li0+N02→2Li+13N−3.
При взаимодействии кальция с фосфором образуется фосфид кальция:
3Ca0+2P0→Ca+23P−32.
Взаимодействие со сложными веществами
1. Щелочные и щелочноземельные металлы взаимодействуют с водой при обычных условиях, образуя растворимое в воде основание (щёлочь) и водород.
Активный металл + вода → щёлочь + водород.
Например, при взаимодействии натрия с водой образуются гидроксид натрия и водород:
2Na0+2H+12O−2→2Na+1O−2H+1+H02.
Видеофрагмент:
Взаимодействие натрия с водой
Обрати внимание!
Некоторые металлы средней активности реагируют с водой при повышенной температуре, образуя оксид металла и водород.
Например, раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe_3O_4 и водород:
3Fe0+4H+12O−2→Fe+2O−2⋅Fe+32O−23+4H02.
2. Mеталлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот, образуя соль и водород.
Металл + кислота → соль + водород.
Например, при взаимодействии алюминия с серной кислотой образуются сульфат алюминия и водород:
2Al0+3H+12S+6O−24→Al+32(S+6O−24)3+3H02.
Видеофрагмент:
Реакция алюминия с серной кислотой
3. Металлы реагируют с солями менее активных металлов в растворе, образуя соль более активного металла и менее активный металл в свободном виде.
Более активный металл + соль → соль более активного металла + менее активный металл.
Например, при взаимодействии железа с сульфатом меди((II)) образуются сульфат железа((II)) и медь:
Fe0+Cu+2S+6O−24→Fe+2S+6O−24+Cu0.
Видеофрагмент:
Взаимодействие железа с сульфатом меди
Источник
Металлы – активные восстановители с положительной степенью окисления. Благодаря химическим свойствам металлы широко используются в промышленности, металлургии, медицине, строительстве.

Активность металлов
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
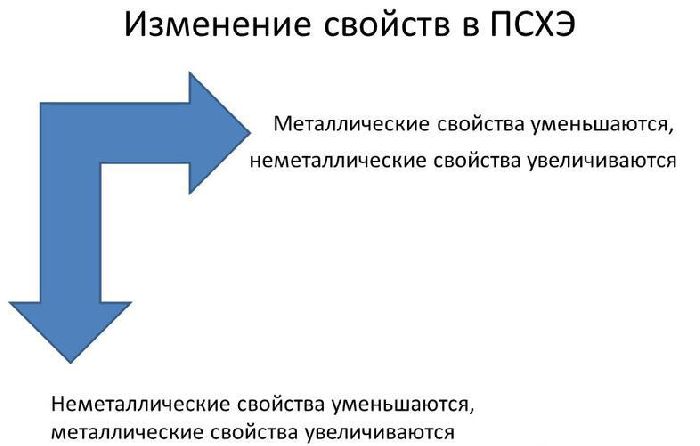
Рис. 1. Изменение металлических свойств в таблице Менделеева.
Активность простых веществ показана в электрохимическом ряду напряжений металлов. Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений. Они вступают в реакцию со многими веществами уже при комнатной температуре. За ними идут щелочноземельные металлы, входящие во II группу. Они реагируют с большинством веществ при нагревании. Металлы, находящиеся в электрохимическом ряду от алюминия до водорода (средней активности) требуют дополнительных условий для вступления в реакции.

Рис. 2. Электрохимический ряд напряжений металлов.
Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагирует только с некоторыми кислотами, замещая водород и образуя соль. Наиболее ярко выраженные двойственные свойства проявляют:
- алюминий;
- свинец;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей. Металлы, находящиеся слева от водорода, вытесняют его из разбавленных кислот.
Свойства
Особенности взаимодействия металлов с разными веществами представлены в таблице химических свойств металлов.
Реакция | Особенности | Уравнение |
С кислородом | Большинство металлов образует оксидные плёнки. Щелочные металлы самовоспламеняются в присутствии кислорода. При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина | – 4Li + O2 → 2Li2O; – 2Na + O2 → Na2O2; – K + O2 → KO2; – 4Al + 3O2 → 2Al2O3; – 2Cu + O2 → 2CuO |
С водородом | При комнатной температуре реагируют щелочные, при нагревании – щелочноземельные. Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление | – Sr + H2 → SrH2; – 2Na + H2 → 2NaH; – Mg + H2 → MgH2 |
С азотом | Только активные металлы. Литий вступает в реакцию при комнатной температуре. Остальные металлы – при нагревании | – 6Li + N2 → 2Li3N; – 3Ca + N2 → Ca3N2 |
С углеродом | Литий и натрий, остальные – при нагревании | – 4Al + 3C → Al3C4; – 2Li+2C → Li2C2 |
С серой | Не взаимодействуют золото и платина | – 2K + S → K2S; – Fe + S → FeS; – Zn + S → ZnS |
С фосфором | При нагревании | 3Ca + 2P → Ca3P2 |
С галогенами | Не реагируют только малоактивные металлы, медь – при нагревании | Cu + Cl2 → CuCl2 |
С водой | Щелочные и некоторые щелочноземельные металлы. При нагревании, в условиях кислой или щелочной среды реагируют металлы средней активности | – 2Na + 2H2O → 2NaOH + H2↑; – Ca + 2H2O → Ca(OH)2 + H2; – Pb + H2O → PbO + H2↑ |
С кислотами | Металлы слева от водорода. Медь растворяется в концентрированных кислотах | – Zn + 2HCl → ZnCl2 + 2H2↑; – Fe + H2SO4 → FeSO4 + H2↑; – Cu + 2H2SO4 → CuSO4 + SO2↑ +2H2O |
Со щелочами | Только амфотерные металлы | 2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2↑ |
С солями | Активные замещают менее активные металлы | 3Na + AlCl3 → 3NaCl + Al |
Металлы взаимодействуют между собой и образуют интерметаллические соединения – 3Cu + Au → Cu3Au, 2Na + Sb → Na2Sb.
Применение
Общие химические свойства металлов используются для создания сплавов, моющих средств, применяются в каталитических реакциях. Металлы присутствуют в аккумуляторах, электронике, в несущих конструкциях.
Основные отрасли применения указаны в таблице.
Отрасль | Производство | Металлы |
Химическая промышленность | Катализаторы, соли, щёлочи | Pt, Fe, Ni, K |
Пищевая промышленность | Поваренная соль (NaCl), сода (Na2CO3, NaHCO3) | Na, Ca, Ag |
Металлургия | Сплавы, покрытия, детали разной формы, проволока, облицовка, строительные материалы и инструменты | Fe, Cr, Ni, W, Mo |
Приборостроение | Микросхемы, фотоэлементы, датчики | Cs, Co, Ni, Cu |
Ювелирная промышленность | Украшения | Au, Pt, Ag |
Медицина | Протезы | Ti, Ni, Au |

Рис. 3. Висмут.
Что мы узнали?
Из урока 9 класса химии узнали об основных химических свойствах металлов. Возможность взаимодействовать с простыми и сложными веществами определяет активность металлов. Чем активнее металл, тем легче он вступает в реакцию при обычных условиях. Активные металлы реагируют с галогенами, неметаллами, водой, кислотами, солями. Амфотерные металлы взаимодействуют со щелочами. Малоактивные металлы не реагируют с водой, галогенами, большинством неметаллов. Кратко рассмотрели отрасли применения. Металлы используются в медицине, промышленности, металлургии, электронике.
Тест по теме
Оценка доклада
Средняя оценка: 4.4. Всего получено оценок: 364.
Источник
1. Щелочные (Li-Fr), щелочно-земельные (Ca-Ra) металлы, Mg
1) Реагируют с кислородом (подробнее)
Все Щ металлы, кроме Li, образуют не оксиды, а пероксиды:
2Li + O2 → 2Li2O
2Na + O2 → Na2O2
Оксиды получают взаимодействием пероксидов с металлом:
Na2O2 + 2Na → 2Na2O
2) Реагируют с водородом (подробнее)
3) Реагируют с водой (подробнее)
4) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
3Mg + 2P → Mg3P2 (t)
2Na + Cl2 → 2NaCl
Ca + 2C → CaC2 (t)
5) Реагируют с некоторыми кислотными оксидами:
CO2 + 2Mg → 2MgO + C
SiO2 + 2Mg → 2MgO + Si
SiO2 + 2Ca → 2CaO + Si
SiO2 + 2Ba → 2BaO + Si
6) Магний как восстановитель используется в производстве кремния и некоторых металлов:
2Mg + TiCl4 → 2MgCl2 + Ti (t)
7) Реакции Щ и ЩЗ металлов с растворами солей или кислот не рассматриваются, так как эти металлы очень бурно взаимодействуют с водой, и суммарная реакция изменится.
2. Алюминий
1) Реагирует с кислородом: 4Al + 3O2 → 2Al2O3
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с водой, если удалить оксидную пленку:
2Al + 6H2O → 2Al(OH)3 + 3H2
4) Реагирует с щелочами с выделением водорода (также Be и Zn):
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
5) Реагируют с галогенами, серой, азотом, фосфором, углеродом:
2Al + 3Cl2 → 2AlCl3
4Al + 3C → Al4C3
2Al + N2 → 2AlN (t)
6) Используется для восстановления менее активных металлов (алюмотермия):
3FeO + 2Al → 3Fe + Al2O3
Cr2O3 + 2Al → 2Cr + Al2O3
7) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Al + H2SO4 (р) → Al2(SO4)3 + H2
8) Вытесняет менее активные металлы из их солей:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
9) На холоде пассивируется концентрированными растворами серной и азотной кислот. При нагревании реагирует без выделения водорода.
3. Железо
1) Реагирует с кислородом:
3Fe + 2O2 → Fe3O4 (железная окалина)
В присутствии воды образуется ржавчина:
4Fe + 3O2 + 6H2O  → 4Fe(OH)3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Fe + H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
3Fe + 4H2O → Fe3O4 + 4H2 (t)
4) Не реагирует с щелочами
Fe + NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Fe + 3F2 → 2FeF3 (образуется соль Fe+3)
2Fe + 3Cl2 → 2FeCl3 (образуется соль Fe+3)
2Fe + 3Br2 → 2FeBr3 (образуется соль Fe+3)
Fe + I2 → FeI2 (образуется соль Fe+2)
Fe + S → FeS
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Fe + H2SO4 (р) → FeSO4 + H2 (образуется соль Fe+2)
Fe + 2HCl → FeCl2 + H2
7) Вытесняет менее активные металлы из их солей:
Fe + CuSO4 → FeSO4 + Cu (образуется соль Fe+2)
8) На холодe пассивируется концентрированными растворами серной и азотной кислот (т.е. реакция не протекает). При нагревании реагирует без выделения водорода:
Fe + 6HNO3(к) → Fe(NO3)3 + 3NO2 + 3H2O (образуется соль Fe+3)
2Fe + 6H2SO4(к) → Fe2(SO4)3 + 3SO2 + 6H2O (образуется соль Fe+3)
9) Соединения Fe+3 реагируют с железом, медью, восстанавливаясь до Fe+2:
2FeCl3 + Fe → 3FeCl2
Fe3O4 + Fe → 4FeO
Fe2O3 + Fe  → 3FeO
4. Хром
1) Реагирует с кислородом:
4Cr + 3O2 → 2Cr2O3
2) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Cr + H2 → реакция не идет
3) Реагирует с парами воды с образованием оксида:
2Cr + 3H2O → Cr2O3 + 3H2 (t)
4) Не реагирует с щелочами
Cr + NaOH → реакция не идет
5) Реагирует с кислородом, серой, галогенами при нагревании:
2Cr + 3Cl2 → 2CrCl3 (образуется соль Fe+3)
2Cr + 3Br2 → 2CrBr3 (образуется соль Fe+3)
Cr + S → Cr2S3 (образуется соль Fe+3)
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Cr + H2SO4 (р) → CrSO4 + H2 (образуется соль Cr+2)
Cr + 2HCl → CrCl2 + H2 (образуется соль Cr+2)
7) Пассивируется концентрированным и разбавленным растворами азотной кислоты (т.е. реакция не протекает).
5. Медь
1) Реагирует с кислородом:
2Cu + O2 → 2CuO
2) Реагирует с соединениями Cu+2 с образованием промежуточной степени окисления +1:
CuO + Cu → Cu2O
CuCl2 + Cu → 2CuCl
3) Не реагирует с водородом (только Щ и ЩЗ металлы взаимодействуют с водородом)
Cu + H2 → реакция не идет
4) Не реагирует с парами воды (так как находится в ряду напряжений после водорода):
Cu + H2O → реакция не идет
5) Не реагирует с щелочами
Cu + NaOH → реакция не идет
6) Реагирует с кислородом, серой, галогенами при нагревании:
Cu + Cl2 → CuCl2 (образуется соль Cu+2)
Cu + Br2 → CuBr2 (образуется соль Cu+2)
2Cu + I2 → 2CuI (образуется соль Cu+1)
Cu + S → CuS (образуется соль Cu+2)
7) Не реагирует с N2, C, Si.
8) Не реагирует с кислотами-неокислителями, так как находится правее водорода в ряду напряжений:
Cu + H2SO4(р) → реакция не идет.
9) Реагирует с кислотами-окислителями как слабый восстановитель:
Cu + 4HNO3(к) → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(р) → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
7. Цинк
1) Реагирует с кислородом: 2Zn + O2 → 2ZnO
2) Не реагирует с водородом (из металлов только Щ и ЩЗ металлы взаимодействуют с водородом)
3) Реагирует с парами воды, т.е. при сильном нагревании, с образованием оксида:
Zn + H2O → ZnO + H2
4) Реагирует с твердыми щелочами и растворами щелочей с выделением водорода (также Be и Al):
Zn + 2NaOH(тв.) → Na2ZnO2 + H2 (t)
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
5) Реагируют с галогенами, серой при нагревании:
Zn + Cl2 → ZnCl2
Zn + S → ZnS
6) Реагирует с кислотами-неокислителями, так как находится до водорода в ряду напряжений, с выделением водорода:
Zn + H2SO4 (р) → ZnSO4 + H2
8) Реагирует с кислотами-окислителями:
4Zn + 5H2SO4(к) → 4ZnSO4 + H2S + 4H2O
Так как Zn находится примерно в центре ряда напряжений, то в реакциях с азотной кислотой могут образовываться разные продукты:
Zn+4HNO3(к) → Zn(NO3)2 + 2NO2 + 2H2O
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O.
Источник
Положение в
периодической системе
1. Типичные металлы – s- элементы: IА-IIА группы (искл.Н)
2. Нетипичные металлы: р-элементы: IIIА гр. (кроме
В), IV гр – Ge, Sn,Pb; Vгр.- Sb,Bi; VI гр.-Po.
3. Переходные металлы: d-элементы – все элементы побочных
подгрупп; f- элементы: лантоноиды,
актиноиды.
У атомов металлов небольшое количество электронов (ē) на внешнем
энергетическом уровне и большие радиусы атомов (R)
Кристаллическая
решетка – металлическая: состоит из чередующихся в пространстве атомов и положительных ионов,
внутри-общие электроны– «электронный газ».
Тип
химической связи – металлическая.
Металлические
(восстановительные) свойства в группе (А п/гр) усиливаются (растет R атома, иэлектроны легче
отрываются), в периоде – ослабляются (растет заряд ядра, электроны внешнего
уровня сильнее удерживаются).
Восстановительные свойства уменьшаются (активность металлов уменьшается)
Li, Cs,Rb,K, Ba,
Ca, Na, Mg, Al, Mn, Cr, Zn,
Fe, Cd, Co, Sn,
Ni, Pb, H2, Cu, Ag,
Hg, Pt, Au
Физические свойства
Наличие
свободных электронов обуславливает:
- Металлический
блеск (непрозрачность)-ē отражают световые лучи, большинство металлов в порошкообразном состоянии теряют свой блеск, за исключением алюминия и магния. - Цвет Большинство металлов светло-серого цвета (Исключение: золото – желтое, медь- красная, цезий – светло-желтый)
- Электропроводность
(свободные ē приобретают направленное движение) Лучшие проводники электричества: Cu, Ag, далее Au,Al,Fe. С повышением
температуры – электропроводность понижается, т.к. усиливаются колебания атомов, электронам трудно
перемещаться. - Теплопроводность
- Пластичность
- Плотность ( Самый легкий – Li, самые тяжелые – Os и Ir)
- Температура плавления ( самый легкоплавкий – Hg −39 °C , самый тугоплавкий – W 3410 °C )
- Твердость (щелочные металлы можно резать ножом, самый твердый – Cr) Большинство металлов твердые, за исключением ртути и ,условно, франция.
Получение
·
Пирометаллургия- получение из руд при высоких температурах при взаимодействии с хорошими восстановителями (H2, CO,C и др.)
Выделяют два этапа: 1) Обжиг металлсодержащей руды; 2) Получение чистого металла
Cu2O+C=2Cu+CO; WO3+3H2= W+3H2O;
Fe3O4+ 4CO=3Fe+4CO2
· Металлотермия–
восстановление металлами (алюминотермия, кальцийтермия, магнийтермия и т.д.):
Cr2O3
+ 2Al= 2Cr + Al2O3
· Гидрометаллургия– соединения
металлов переводят в раствор и восстанавливают:
CuO+H2SO4=CuSO4+Н2О;
CuSO4+Fe =Cu+ FeSO4
·
Электрометаллургия – электролиз
растворов и расплавов:
В расплаве: 2NaCl→2Na +Cl2;
В растворе: 2NaCl + 2 H2O→2NaOH + H2↑+Cl2↑;
NiSO4+2Н2О→Ni +Н2↑+Н2SO4+
О2↑;
Запомнить: Алюминий получают из оксида (глинозема, бокситов и т.д.) в расплаве криолита Na3AlF6
2Al2O3 → 4Al + 3O2
Химические свойства
Металлы – это хорошие восстановители. Из-за небольшого числа электронов и большого радиуса, они легко отдают электроны: Ме – ē → Ме+n .
1. Взаимодействие с простыми веществами неметаллами:
Большинство металлов образуют основные или амфотерные оксиды.
С кислородом
кроме золота и платиныС галогенами С серой
кроме золота и платиныС азотом
только самые активныеС другими неметаллами 2Mg+О2 = 2MgO (t0);
4Li + O2 = 2Li2O
Запомнить:
2Na + O2 = Na2O2 (t0); (пероксид натрия Nа –O – O –Na);
K+ O2 = KO2 (надпероксид калия)
3Fe + 2 O2= Fe3O4Mg + Cl2 = MgCl2
2 Fe + 3 Cl2 = 2 FeCl3Fe + S = FeS 3Li + N2 = Li3N (взаимодействуют при обычных условиях, в отличии от всех остальных металлов) Ca + H2 = CaH2
2. Со сложными веществами
а) Взаимодействие металлов с водой (см ряд акт. Ме)
с активными металлами до Mn образуется соответствующий гидроксид: 2Na + 2H2O = 2NaOH + H2↑
с металлами средней активности – оксид: Zn + H2O = ZnO + H2↑
неактивные металлы с водой не взаимодействуют: Cu +H2O ≠
б) Взаимодействие с кислотами (см.
ряд напряжений): Zn +2HCl = ZnCl2 + H2 ↑
Запомнить: Металлы никогда не вытесняют из НNО3(к) H2SO4(к) водород; они пассивируют Al,Cr,Fe
H2SO4 (р-р – H2;
конц- H2S; S; SО2, ); Cu + 2H2SO4
= Cu SO4 + SO2 ↑+ 2Н2О.
НNО3 (NН3; NН4NО3;N2;;NO; NO2), но не H2; 4HNO3(конц) +Сu = Сu( NO3)2
+ 2NO2 + 2H2O
в) Взаимодействие с солями (более активные металлы вытесняют менее активные из растворов их солей)
CuCl2 + Fe = FeCl2
+ Cu;
– но
если металл взаимодействует с водой, то
CuCl2+2К +2H2 O = 2КCl+Cu(ОН)2↓+
Н2↑; т.к.: 1) 2К + 2H2O = 2КОН+ Н2
2) CuCl2 +2КОН= Cu(ОН)2↓+ 2КCl
г)Взаимодействуют с
оксидами металлов и неметаллов:Fe2O3 + 2Al = Al2O3
+2Fe (t0);2Mg + SiO2
= Si +2MgО(t0);2Mg+CO2=С+2MgО(t0)
д) Металлы, оксиды и
гидроксиды которых проявляют амфотерные свойства взаимодействуют с основаниями:2NaOH+Zn=Na2ZnO2+H2↑(сплав);
2NaOHконц.+Zn+2H2O=Na2[Zn(OH﴿4]+H2↑
е)Другое:
Между собой
образуют интерметаллические соединения, сплавы: Na2Sb
С
органическими веществами (со спиртами, фенолами, карбоновыми кислотами и др.)2СН3СН2ОН+2Na →2 СН3СН2ОNa +H2↑;
2СН3СООН+ Zn → (СН3СОО)2Zn + H2;
2СН3СН2Cl + 2Na → 2NaCl + СН2СН2
СН2СН3 – реакция Вюрца- удлинение цепи.
Источник
