Какие свойства проявляют металлы окислителей или восстановителей

Среди металлов традиционно выделяют несколько групп. Входящие в их состав представители характеризуются отличной от других металлов химической активностью. Такими группами являются:
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельные металлы (кальций, стронций, барий, радий).
Простые вещества, обладающие металлическими свойствами, в химических реакциях всегда являются восстановителями. Положение металла в ряду активности характеризует то, насколько активно данный металл способен вступать в химические реакции (т. е. то, насколько сильно у него проявляются свойства восстановителя).
Ряд активности металлов
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
активные металлы | металлы средней активности | неактивные металлы |
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять из растворов солей те металлы, которые в ряду активности стоят после него (правее).
3. Металлы, находящиеся в ряду активности левее водорода, способны вытеснять его из растворов кислот.
4. Щелочные и щелочноземельные металлы в любых водных растворах взаимодействуют прежде всего с водой.
Общие химические свойства металлов
Взаимодействие с простыми веществами-неметаллами
1. Металлы взаимодействуют с кислородом, образуя оксиды.
Металл + кислород → оксид.
Например, при взаимодействии магния с кислородом образуется оксид магния:
2Mg0+O02→2Mg+2O−2.
Видеофрагмент:
Обрати внимание!
Серебро, золото и платина с кислородом не реагируют.
2. Металлы взаимодействуют с галогенами (фтором, хлором, бромом и иодом), образуя галогениды.
Металл + галоген → галогенид металла.
Например, при взаимодействии натрия с хлором образуется хлорид натрия:
2Na0+Cl02→2Na+1Cl−1.
3. Металлы взаимодействуют с серой, образуя сульфиды.
Металл + сера → сульфид металла.
Например, при взаимодействии цинка с серой образуется сульфид цинка:
Zn0+S0→Zn+2S−2.
Видеофрагмент:
Взаимодействие цинка с серой
4. Активные металлы при нагревании реагируют с азотом, фосфором и некоторыми другими неметаллами.
Например, при взаимодействии лития с азотом образуется нитрид лития:
6Li0+N02→2Li+13N−3.
При взаимодействии кальция с фосфором образуется фосфид кальция:
3Ca0+2P0→Ca+23P−32.
Взаимодействие со сложными веществами
1. Щелочные и щелочноземельные металлы взаимодействуют с водой при обычных условиях, образуя растворимое в воде основание (щёлочь) и водород.
Активный металл + вода → щёлочь + водород.
Например, при взаимодействии натрия с водой образуются гидроксид натрия и водород:
2Na0+2H+12O−2→2Na+1O−2H+1+H02.
Видеофрагмент:
Взаимодействие натрия с водой
Обрати внимание!
Некоторые металлы средней активности реагируют с водой при повышенной температуре, образуя оксид металла и водород.
Например, раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe_3O_4 и водород:
3Fe0+4H+12O−2→Fe+2O−2⋅Fe+32O−23+4H02.
2. Mеталлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот, образуя соль и водород.
Металл + кислота → соль + водород.
Например, при взаимодействии алюминия с серной кислотой образуются сульфат алюминия и водород:
2Al0+3H+12S+6O−24→Al+32(S+6O−24)3+3H02.
Видеофрагмент:
Реакция алюминия с серной кислотой
3. Металлы реагируют с солями менее активных металлов в растворе, образуя соль более активного металла и менее активный металл в свободном виде.
Более активный металл + соль → соль более активного металла + менее активный металл.
Например, при взаимодействии железа с сульфатом меди((II)) образуются сульфат железа((II)) и медь:
Fe0+Cu+2S+6O−24→Fe+2S+6O−24+Cu0.
Видеофрагмент:
Взаимодействие железа с сульфатом меди
Источник
В химических реакциях металлы выступают в роли восстановителей и повышают степень окисления, превращаясь из простых веществ в катионы.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.

В этот ряд, составленный русским химиком Н.Н. Бекетовым, включен также неметалл водород. Активность металлов убывает слева направо:
Запомнить! Металлы, стоящие в ЭХ ряду после водорода, называют неактивными металлами.
Металлы, расположенные в ЭХ ряду до алюминия называют сильноактивными или активными металлами.
Общие химические свойства металлов
1) Многие металлы вступают в реакцию с типичными неметаллами – галогенами, кислородом, серой. При этом образуются соответственно хлориды, оксиды, сульфиды и другие бинарные соединения:
с азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании;
с серой металлы образуют сульфиды – соли сероводородной кислоты;
с водородом самые активные металлы образуют ионные гидриды (бинарные соединения, в которых водород имеет степень окисления -1);
с кислородом большинство металлов образует оксиды – амфотерные и основные. Основной продукт горения натрия – пероксид $Na_2O_2$; а калий и цезий горят с образованием надпероксидов $MeO_2$.
2) Следует обратить внимание на особенности взаимодействие металлов с водой:

Активные металлы, находящиеся в ряду активности металлов до Mg (включительно), реагируют с водой с образованием щелочей и водорода:$Ca + 2H_2O = Ca(OH)_2 + H_2uparrow$
Активные металлы (например, натрий и литий), взаимодействуют с водой со взрывом.
Металлы средней активности окисляются водой при нагревании до оксида:
$6Cr + 6H_2O xrightarrow[]{t, ^circ C} 2Cr_2O_3 + 3H_2uparrow$
Неактивные металлы (Au, Ag, Pt) – не реагируют с водой.
$hspace{1.5cm} xrightarrow []{[Li……Mg]} MOH +H_2uparrow$ активные металлы (до Al)
$H_2O + M xrightarrow []{[Al……Pb} M_xO_y +H_2uparrow$ среднеактивные металлы (от Al до H), только при нагревании
$hspace{1.5cm} xrightarrow []{[Bi……Au]} hspace{1cm} ne hspace{1cm}$ неактивные металлы (после Н)
Более подробно взаимодействие металлов с водой рассмотрено в темах, посвященных химии отдельных групп.
3) С разбавленными кислотами реагируют металлы, стоящие в ЭХР до водорода: происходит реакция замещения с образованием соли и газообразного водорода. При этом кислота проявляет окислительные свойства за счет наличия катиона водорода:
$mathrm{Mg} + 2mathrm{HCl} = mathrm{MgCl}_2 + mathrm{H}_2$
4) Взаимодействие азотной кислоты (любой концентрации) и концентрированной серной кислоты протекает с образованием других продуктов: кроме соли в этих реакциях образуется продукт восстановления серной (или азотной) кислоты. Подробнее см.тему “Взаимодействие азотной кислоты с металлами и неметаллами.
Запомнить! Все металлы, стоящие в ряду левее водорода, вытесняют его из разбавленных кислот, а металлы, расположенные справа от водорода, с растворами кислот не реагируют (азотная кислота – исключение).
5) Активность металлов также влияет на возможность протекания простого вещества металла с оксидом или солью другого металла. Металл вытесняет из солей менее активные металлы, стоящие правее его в ряду напряжений.
Запомнить! Для протекания реакции между металлом и солью другого требуется, чтобы соли, как вступающие в реакцию, так и образующиеся в ходе нее, были растворимы в воде. Металл вытесняет из соли только более слабый металл.
Например, для вытеснения меди из водного раствора сульфата меди подходит железо,
$mathrm{CuSO}_4 + mathrm{Fe} = mathrm{FeSO}_4 + mathrm{Cu}$
но не подходят свинец – так как он образует нерастворимый сульфат. Если опустить кусочек свинца в раствор сульфата меди, то с поверхности металла покроется тонким слоем сульфата, и реакция прекратится
$mathrm{CuSO}_4 + mathrm{Pb} = mathrm{PbSO}_4downarrow + mathrm{Cu}$
Другой пример: цинк легко вытесняет серебро из раствора нитрата серебра, однако реакция цинка со взвесью сульфида серебра, нерастворимого в воде, практически не протекает.
Общие химические свойства металлов обобщены в таблице:
| Уравнение реакции | Продукты реакции | Примечания |
|---|---|---|
| с простыми веществами – неметаллами | ||
| с кислородом | ||
$4Li + O_2 = 2Li_2O$ | оксиды $O^{-2}$ | |
$2Na + O_2 = Na_2O_2$ | пероксиды $(O_2)^{-2}$ | только натрий |
$K + O_2 = KO_2$ | надпероксиды $(O_2)^{-2}$ | надпероксиды при горении образуют K, Rb, Cs |
| с водородом | ||
$Ca + H_2 = CaH_2$ | гидриды | щелочные металлы 0 при комнатной температуре; остальные металлы – при нагревании |
| с галогенами | ||
$2Fe + 3Cl_2 =2Fe^{+3}Cl_3$ | хлориды и др. | при взаимодействии с хлором и бромом (сильные окислители) железо и хром образуют хлориды в степени окисления +3 |
| с серой | ||
$Fe + S = FeS$ | сульфиды | при взаимодействии с серой и иодом железо приобретает степень окисления +2 |
| с азотом и фосфором | ||
$3Mg + N_2 = Mg_3N_2 $ | нитриды | * при комнатной температуре с азотом реагируют только литий и магний |
$3Ca + 2P = Ca_3P_2$ | фосфиды | |
| с углеродом | ||
$4Al + 3C = Al_4C_3$ | карбиды | |
| с водой | ||
$2Na^0 + 2H_2O = 2NaOH + H_2 $ | Основание + $H_2$ | щелочные металлы |
$ Zn^0 + H_2O = ZnO + H_2$ | Оксид + $H_2$ | среднеактивные металлы, при нагревании |
$Au, Ag, Pt+ H_2O /ne $ | не реагируют | неактивные металлы (после Н) |
| с окисдами менее активных металлов | ||
| $2Al + 3ZnO = Al_2O_3 + 2Zn$ | др оксид + др.металл | |
| с солями менее активных металлов | ||
$Fe+ CuSO_4 = Cu + FeSO_4$ | Др. соль + др. металл |
|
| $Cu + AlCl_3 ne$ | ||
| с кислотами | ||
$Fe + 2HCl = FeCl_2 + H_2 $ $6Na + 2H_3PO_4 = 2Na_3PO_4 + 3H_2 $ | Др. соль +водород | Металлы, стоящие в электрохимическом ряду напряжений до H реагируют с разбавленными кислотами (кроме $HNO_3$) |
$Cu + 2H_3PO_4 ne$ | ||
Источник
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Общие химические свойства металлов представлены в таблице:

Видео “Самовоспламенение никеля на воздухе”
1). Металлы по – разному реагируют с водой:

Помните!!!
Алюминий реагирует с водой подобно активным металлам, образуя основание:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
2). Металлы особо реагируют с серной концентрированной и азотной кислотами:
H2SO4 (конц.) + Me = соль + H2O + Х
Щелочные и щелочноземельные | Fe, Cr, Al | Металлы до водорода Сd-Pb | Металлы после водорода (при t) | Au, Pt | |
X | H2S↑ могут S↓ или SO2↑ | 1)пассивируются на холоде; 2) при нагревании → SO2↑ | S↓ могут H2S илиSO2 | SO2↑ | – |
H2SO4 (разб) + Zn = ZnSO4 + H2↑
H2SO4 (разб) + Cu ≠
2H2SO4 (конц.) + Cu = CuSO4 + 2H2O + SO2↑
Внимание!
Pt, Au + H2SO4 (конц.) → реакции нет
Al, Fe, Cr + H2SO4 (конц.) холодная→ пассивация
Al, Fe, Cr + H2SO4 (конц.) t˚C→ SO2

4HNO3 (k) + Cu = Cu(NO3)2 + 4H2O + 2NO2↑
8HNO3 (p) + 3Cu = 3Cu(NO3)2 + 4H2O + 2NO↑
Внимание!
Pt, Au + HNO3 → реакции нет
Al, Fe, Cr + HNO3 (конц) холодная→ пассивация
Al, Fe, Cr + HNO3 (конц) t˚C→ NO2
Al, Fe, Cr + HNO3 (разб) → NO
3). С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Вытеснение металла из соли другим металлом
ВИДЕО-ОПЫТ
Fe + CuCl2 = FeCl2 + Cu
FeCl2 + Cu ≠
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым:
Вытеснение водорода металлами

от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Видео – Эксперимент «Взаимодействие хлорида олова (II) с цинком («Оловянный ежик»)»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Закончить уравнения практически осуществимых реакций, назвать продукты реакции
Li+ H2O =
Cu + H2O =
Al + H2O =
Ba + H2O =
Mg + H2O =
Ca + HCl=
Na + H2SO4(К)=
Al + H2S=
Ca + H3PO4=
HCl + Zn =
H2SO4 (к)+ Cu=
H2S + Mg =
HCl + Cu =
HNO3 (K)+ Сu =
H2S + Pt =
H3PO4 + Fe =
HNO3 (p)+ Na=
Fe + Pb(NO3)2 =
№2. Закончите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель):
Al + O2 =
Li + H2O =
Na + HNO3 (k) =
Mg + Pb(NO3)2 =
Ni + HCl =
Ag + H2SO4 (k) =
№3. Вставьте вместо точек пропущенные знаки (<, > или =)
заряд ядра | Li…Rb | Na…Al | Ca…K |
число энергетических уровней | Li…Rb | Na…Al | Ca…K |
число внешних электронов | Li…Rb | Na…Al | Ca…K |
радиус атома | Li…Rb | Na…Al | Ca…K |
восстановительные свойства | Li…Rb | Na…Al | Ca…K |
№4. Закончите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель):
K+ O2 =
Mg+ H2O =
Pb+ HNO3 (p) =
Fe+ CuCl2 =
Zn + H2SO4 (p) =
Zn + H2SO4 (k) =
№5. Решите тестовые задания
1.Выберите группу элементов, в которой находятся только металлы: А) Al, As, P; Б) Mg, Ca, Si; В) K, Ca, Pb 2. Выберите группу, в которой находятся только простые вещества – неметаллы: А) K2O, SO2, SiO2; Б) H2, Cl2, I2 ; В)Ca, Ba, HCl; 3. Укажите общее в строении атомов K и Li: А) 2 электрона на последнем электронном слое; Б) 1 электрон на последнем электронном слое; В) одинаковое число электронных слоев. 4. Металлический кальций проявляет свойства: А) окислителя; Б) восстановителя; В) окислителя или восстановителя в зависимости от условий. 5. Металлические свойства натрия слабее, чем у – А) магния; Б) калия; В) лития. 6. К неактивным металлам относятся: А) алюминий, медь, цинк; Б) ртуть, серебро, медь; В) кальций, бериллий, серебро. 7. Какое физическое свойство не является общими для всех металлов: А) электропроводность, Б) теплопроводность, В) твердое агрегатное состояние при нормальных условиях, Г) металлический блеск | ||
Часть В. Ответом к заданиям этой части является набор букв, которые следует записать Установите соответствие. С увеличением порядкового номера элемента в главной подгруппе II группы Периодической системы свойства элементов и образуемых ими веществ изменяются следующим образом:
|
Источник
Металлы – активные восстановители с положительной степенью окисления. Благодаря химическим свойствам металлы широко используются в промышленности, металлургии, медицине, строительстве.

Активность металлов
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
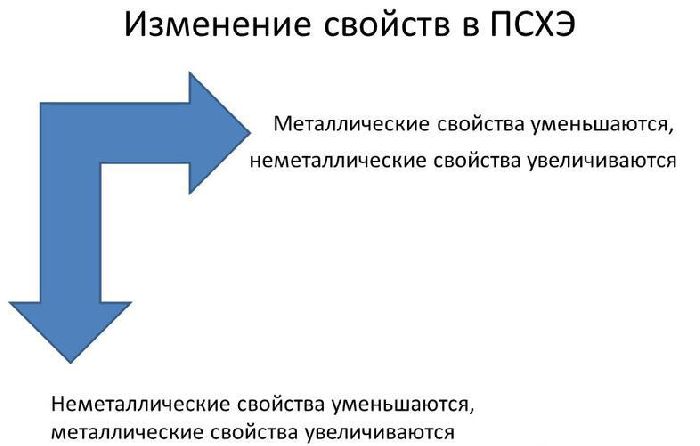
Рис. 1. Изменение металлических свойств в таблице Менделеева.
Активность простых веществ показана в электрохимическом ряду напряжений металлов. Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений. Они вступают в реакцию со многими веществами уже при комнатной температуре. За ними идут щелочноземельные металлы, входящие во II группу. Они реагируют с большинством веществ при нагревании. Металлы, находящиеся в электрохимическом ряду от алюминия до водорода (средней активности) требуют дополнительных условий для вступления в реакции.

Рис. 2. Электрохимический ряд напряжений металлов.
Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагирует только с некоторыми кислотами, замещая водород и образуя соль. Наиболее ярко выраженные двойственные свойства проявляют:
- алюминий;
- свинец;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей. Металлы, находящиеся слева от водорода, вытесняют его из разбавленных кислот.
Свойства
Особенности взаимодействия металлов с разными веществами представлены в таблице химических свойств металлов.
Реакция | Особенности | Уравнение |
С кислородом | Большинство металлов образует оксидные плёнки. Щелочные металлы самовоспламеняются в присутствии кислорода. При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина | – 4Li + O2 → 2Li2O; – 2Na + O2 → Na2O2; – K + O2 → KO2; – 4Al + 3O2 → 2Al2O3; – 2Cu + O2 → 2CuO |
С водородом | При комнатной температуре реагируют щелочные, при нагревании – щелочноземельные. Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление | – Sr + H2 → SrH2; – 2Na + H2 → 2NaH; – Mg + H2 → MgH2 |
С азотом | Только активные металлы. Литий вступает в реакцию при комнатной температуре. Остальные металлы – при нагревании | – 6Li + N2 → 2Li3N; – 3Ca + N2 → Ca3N2 |
С углеродом | Литий и натрий, остальные – при нагревании | – 4Al + 3C → Al3C4; – 2Li+2C → Li2C2 |
С серой | Не взаимодействуют золото и платина | – 2K + S → K2S; – Fe + S → FeS; – Zn + S → ZnS |
С фосфором | При нагревании | 3Ca + 2P → Ca3P2 |
С галогенами | Не реагируют только малоактивные металлы, медь – при нагревании | Cu + Cl2 → CuCl2 |
С водой | Щелочные и некоторые щелочноземельные металлы. При нагревании, в условиях кислой или щелочной среды реагируют металлы средней активности | – 2Na + 2H2O → 2NaOH + H2↑; – Ca + 2H2O → Ca(OH)2 + H2; – Pb + H2O → PbO + H2↑ |
С кислотами | Металлы слева от водорода. Медь растворяется в концентрированных кислотах | – Zn + 2HCl → ZnCl2 + 2H2↑; – Fe + H2SO4 → FeSO4 + H2↑; – Cu + 2H2SO4 → CuSO4 + SO2↑ +2H2O |
Со щелочами | Только амфотерные металлы | 2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2↑ |
С солями | Активные замещают менее активные металлы | 3Na + AlCl3 → 3NaCl + Al |
Металлы взаимодействуют между собой и образуют интерметаллические соединения – 3Cu + Au → Cu3Au, 2Na + Sb → Na2Sb.
Применение
Общие химические свойства металлов используются для создания сплавов, моющих средств, применяются в каталитических реакциях. Металлы присутствуют в аккумуляторах, электронике, в несущих конструкциях.
Основные отрасли применения указаны в таблице.
Отрасль | Производство | Металлы |
Химическая промышленность | Катализаторы, соли, щёлочи | Pt, Fe, Ni, K |
Пищевая промышленность | Поваренная соль (NaCl), сода (Na2CO3, NaHCO3) | Na, Ca, Ag |
Металлургия | Сплавы, покрытия, детали разной формы, проволока, облицовка, строительные материалы и инструменты | Fe, Cr, Ni, W, Mo |
Приборостроение | Микросхемы, фотоэлементы, датчики | Cs, Co, Ni, Cu |
Ювелирная промышленность | Украшения | Au, Pt, Ag |
Медицина | Протезы | Ti, Ni, Au |

Рис. 3. Висмут.
Что мы узнали?
Из урока 9 класса химии узнали об основных химических свойствах металлов. Возможность взаимодействовать с простыми и сложными веществами определяет активность металлов. Чем активнее металл, тем легче он вступает в реакцию при обычных условиях. Активные металлы реагируют с галогенами, неметаллами, водой, кислотами, солями. Амфотерные металлы взаимодействуют со щелочами. Малоактивные металлы не реагируют с водой, галогенами, большинством неметаллов. Кратко рассмотрели отрасли применения. Металлы используются в медицине, промышленности, металлургии, электронике.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Александр Котков
10/10

Лидия Маслова
10/10

Анна Богданова
10/10

Сергей Ефремов
7/10
Оценка доклада
Средняя оценка: 4.4. Всего получено оценок: 427.
Источник
Окислительно-восстановительные реакции могут проходить только при условии, что исходные компоненты содержат атомы, молекулы или ионы, обладающие противоположными способностями принимать или отдавать электроны.
5KCl+5O3+6P0 = 5KCl-1+3P2+5O5
В приведенной реакции хлор и фосфор изменяют свои степени окисления:
- P0-5e- → P+5, фосфор (P0) является восстановителем, окисляясь до P+5 (степень окисления фосфора повышается на 5 единиц от 0 до +5).
- Cl+5+6e- → Cl-1, хлор (Cl+5) является окислителем, восстанавливаясь до Cl-1 (степень окисления хлора понижается на 6 единиц – от +5 до -1).
В периодической таблице Менделеева четко прослеживается закономерность изменения окислительно-восстановительных свойств элементов:
- В периодах с увеличением порядкового номера элемента (слева-направо) нарастают окислительные свойства и убывают восстановительные – натрий самый сильный восстановитель в третьем периоде, а хлор – самый сильный окислитель.
- В главных подгруппах, в пределах одной главной подгруппы с повышением порядкового номера (по направлению сверху-вниз) нарастают восстановительные свойства элементов и убывают окислительные – в VIIа группе фтор является сильным окислителем, а астат в некоторых соединениях проявляет восстановительные свойства.
На рисунке ниже показана примерная принадлежность элементов к восстановителям (голубой цвет) и окислителям (красный цвет).

С окислительно-восстановительными свойствами элементов в периодической таблице в общем чертах понятно. Теперь скажем пару слов о ионах.
- Элементарные катионы металлов (Na+, Cu2+, Ca2+) являются окислителями и не проявляют восстановительных свойств, окислительные свойства снижаются по мере роста активности металла.
- Ионы металлов с промежуточными степенями окисления могут проявлять, как восстановительные, так и окислительные свойства (Fe2+ – восстановитель; Fe3+ – окислитель).
- Элементарные анионы (Cl-, Br-, I-) являются восстановителями.
- Сложные ионы являются окислителями, если содержат атомы элементов с высокой степенью окисления (Cr2O72-, ClO3-,NO3-), при этом окислительные свойства обусловлены всем анионом, но не конкретным атомом, имеющим высокую степень окисления.
А что же с окислительно-восстановительными свойствами сложных веществ?
При взаимодействии сложных веществ следует обращать внимание на те элементы, которые в ходе реакции меняют свою степень окисления (если таковых нет, то и реакция не является окислительно-восстановительной).
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в максимальной степени окисления – такое вещество может быть только окислителем, например перманганат калия, в котором марганец имеет максимальную степень окисления, т.е., может только принимать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в низшей степени окисления – такое вещество может быть только восстановителем, например, сульфат марганца (II), в котором марганец имеет низшую степень окисления, т.е., может только отдавать электроны.
- Если элемент, меняющий свою степень окисления, присутствует в исходном веществе в промежуточной степени окисления, – такое вещество может быть как окислителем, так и восстановителем – все зависит от других реагирующих веществ и условий протекания реакции.
Рассмотрим вкратце вещества, которые могут проявлять и восстановительные, и окислительные свойства, в зависимости от условий реакции и других взаимодействующих веществ.
Оксид серы (IV) в некоторых случаях играет роль восстановителя, например, окисляясь кислородом, но в металлургии оксид серы используют в реакции извлечения серы из отходящих газов, где оксид серы проявляет свойства окислителя:
2SO2+O2 = 2SO3
2CO+SO2 = S+2SO2
Пероксид водорода H2O2, как восстановитель применяется для дезинфекции, травления германиевых пластинок при изготовлении полупроводниковых приборов. Окислительные свойства пероксида водорода используют при отбеливании пуха, пера, мехов, тюли, волос.
Сернистая кислота в реакции с сероводородом играет роль окислителя, поскольку в молекуле H2S сера имеет степень окисления -2:
H2S+4O3+2H2S-2 = 3S0+3H2O
В реакции с кислородом сернистая кислота выступает восстановителем, поскольку кислород является более сильным окислителем:
2H2S+4O3+O20 = 2H2SO4
Не последнюю роль на окислительно-восстановительные свойства веществ оказывает среда, в которой протекает химическая реакция:
- I2+5H2O2 → 2HIO3+4H2O – при pH=1 пероксид водорода является окислителем;
- 2HIO3+5H2O2 → I2+6H2O+5O2 – при pH=2 пероксид водорода является восстановителем.
Оксид марганца (IV) является окислителем только в кислотной среде:
MnO2+4H++2e- → Mn2++2H2O
Перманганат калия KMnO4 является окислителем в любой среде:
- кислая среда: MnO4-+8H++5e- → Mn2++4H2O
- щелочная среда: MnO4-+1e- → MnO42-
- нейтральная среда: MnO4-+2H2O+3e- → MnO2+4OH-
См. далее:
- Типичные восстановители
- Типичные окислители
Окислители и восстановители любят “свою” среду – в кислотной среде сила окислителей увеличивается, а в щелочной – увеличивается сила восстановителей.
См. далее Элементы-восстановители
Источник
