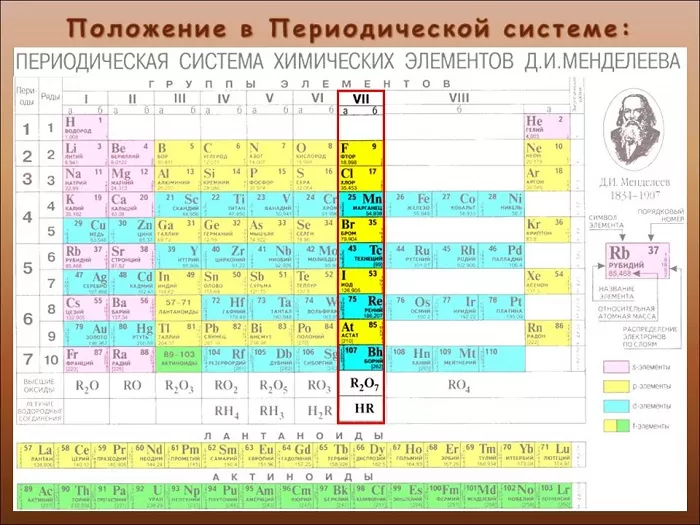
Какие свойства проявляют галогены

Галогены (греч. hals – соль + genes – рождающий) – химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством
других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.

Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np5:
- F – 2s22p5
- Cl – 3s23p5
- Br – 4s24p5
- I – 5s25p5
- At – 6s26p5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов
в возбужденном состоянии.

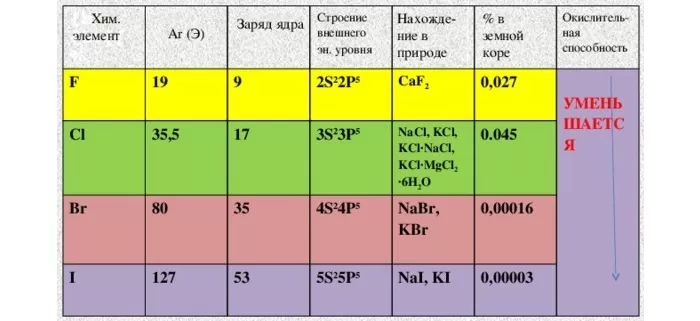
Природные соединения
- NaCl – галит (каменная соль)
- CaF2 – флюорит, плавиковый шпат
- NaCl*KCl – сильвинит
- 3Ca3(PO4)2*CaF2 – фторапатит
- MgCl2*6H2O – бишофит
- KCl*MgCl2*6H2O – карналлит

Простые вещества – F2, Cl2, Br2, I2
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают
электролизом водного раствора хлорида натрия.
NaCl + H2O → (электролиз) NaOH + H2↑ + Cl2↑
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте – HF – был впервые получен фтор.
HF → F2 + H2
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
Cl2 + KBr → Br2 + KCl
Cl2 + KI → I2 + KCl

В лабораторных условиях галогены могут быть получены следующими реакциями.
HCl + MnO2 → MnCl2 + Cl2 + H2O
HCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
Химические свойства
- Реакции с металлами
- Реакции с неметаллами
- Реакции с водой
- Реакции с щелочами
- Окислительные способности
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере
фтора самовоспламеняются.
Al + F2 → AlF3
Cu + Cl2 → CuCl2
Na + Br2 → NaBr
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
Cl2 + Si → SiCl4
Cl2 + H2 → HCl (на свету)

F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром – F-)
Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод – Br-)
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
H2O + F2 → HF + O2
Хлор реагирует с водой обратимо, образуя хлорную воду – смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.
Cl2 + H2O → HCl + HClO
H2O + Br2 → HBr + HBrO

Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами – только при
нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Cl2 + NaOH → (t) NaCl + NaClO3 + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KCl + F2 → KF + Cl2
KBr + Cl2 → KCl + Br2
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF – фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl – хлороводород (газ), соляная кислота (жидкость)
- HBr – бромоводород, бромоводородная кислота
- HI – йодоводород, йодоводородная кислота
- HAt – астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI – газы, хорошо растворимые в воде.
Получение
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
H2 + Cl2 → HCl
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
NaCl + H2SO4 → NaHSO4 + HCl↑
CaF2 + H2SO4 → CaSO4 + HF
PBr3 + H2O → HBr↑ + H3PO3
H2S + I2 → S + HI
Химические свойства
- Кислотные свойства
- С солями
- Восстановительные свойства
- Реакция с оксидом кремния
HF – является слабой кислотой, HCl, HBr, HI – сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить
водород из кислоты.
Mg + HBr → MgBr2 + H2↑
Zn + HCl → ZnCl2 + H2↑

Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
Na2O + HCl → NaCl + H2O
ZnO + HI → ZnI2 + H2O
KOH + HCl → KCl + H2O (реакция нейтрализации)

Cr(OH)3 + HCl → CrCl3 + H2O
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
AgNO3 + HCl → AgCl + HNO3
Li2CO3 + HBr → LiBr + H2CO3
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
HI + MnO2 → I2 + MnI2 + H2O
HI + H2SO4 → I2 + H2S + H2O
HI + O2 → H2O + I2
HI + Br2 → HBr + I2
HCl + H2SO4 → Cl2 + SO2 + H2O

В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с
плавиковой кислотой.
SiO2 + HF → SiF4 + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Электронная конфигурация внешнего энергетического уровня галогенов ns2np5. Поскольку, до завершения энергетического уровня галогенам не хватает всего 1-го электрона, в ОВР они чаще всего проявляют свойства окислителей. Степени окисления галогенов: от «-1» до «+7». Единственный элемент группы галогенов – фтор – проявляет только одну степень окисления «-1» и является самым электроотрицательным элементом. Молекулы галогенов двухатомны: F2, Cl2, Br2, I2.
Химические свойства галогенов
С ростом заряда ядра атома химического элемента, т.е. при переходе от фтора к йоду окислительная способность галогенов снижается, что подтверждается способностью вытеснения нижестоящих галогенов вышестоящими из галогеноводородных кислот и их солей:
Br2 + 2HI = I2 + 2HBr;
Cl2 + 2KBr = Br2 + 2KCl.
Наибольшей химической активностью обладает фтор. Большинство химических элементов даже при комнатной температуре взаимодействует с фтором, выделяя большое количество теплоты. Во фторе горит даже вода:
2H2O + 2F2 = 4HF + O2↑.
Свободный хлор менее реакционноспособен, чем фтор. Он непосредственно не реагирует с кислородом, азотом и благородными газами. Со всеми остальными веществами он взаимодействует подобно фтору:
2Fe + Cl2 = 2FeCl3;
2P + 5Cl2 = 2PCl5.
При взаимодействии хлора с водой на холоде происходит обратимая реакция:
Cl2 + H2O↔HCl +HClO.
Смесь, представляющую собой продукты реакции, называют хлорной водой.
При взаимодействии хлора с щелочами на холоде образуются смеси хлоридов и гипохлоритов:
Cl2 + Ca(OH)2 = Ca(Cl)OCl + H2O.
При растворении хлора в горячем растворе щелочи происходит реакция:
3Cl2 + 6KOH = 5KCl +KClO3+3H2O.
Бром, как и хлор растворяется в воде и, частично реагируя с ней, образует так называемую «бромную воду», тогда как йод в воде практически нерастворим.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие йода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Н2 + I2 = 2HI — 53 кДж.
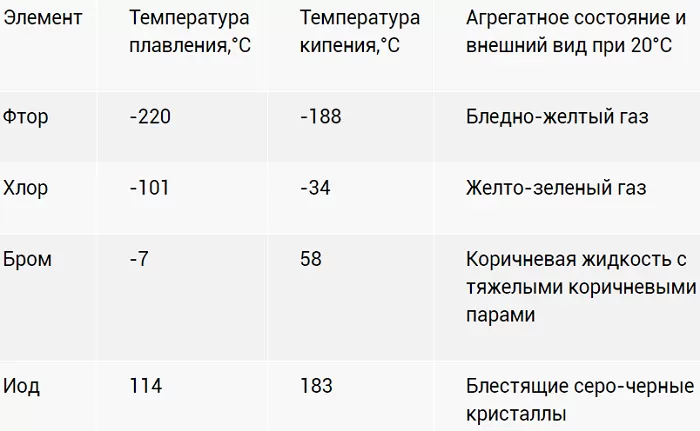
Физические свойства галогенов
При н.у. фтор – газ светло-желтого цвета, обладающий резким запахом. Ядовит. Хлор – газ светло-зеленого цвета, также как и фтор имеет резкий запах. Сильно ядовит. При повышенном давлении и комнатной температуре легко переходит в жидкое состояние. Бром – тяжелая жидкость красно-бурого цвета с характерным неприятным резким запахом. Жидкий бром, а также его пары сильно ядовиты. Бром плохо растворяется в воде и хорошо в неполярных растворителях. Йод – твердое вещество темно-серого цвета с металлическим блеском. Пары йода имеют фиолетовый цвет. Йод легко возгоняется, т.е. переходит в газообразное состояние из твердого, при этом минуя жидкое состояние.
Получение галогенов
Галогены можно получить при электролизе растворов или расплавов галогенидов:
MgCl2 = Mg + Cl2 (расплав).
Наиболее часто галогены получают по реакции окисления галогенводородных кислот:
MnO2 + 4HCl = MnCl2 + Cl2↑ +2H2O;
K2Cr2O7 + 14HCl = 3Cl2↑ + 2KCl +2CrCl3 +7H2O;
2KMnO4 +16HCl = 2MnCl2 +5Cl2↑ +8H2O +2KCl.
Применение галогенов
Галогены используют в качестве сырья для получения различных продуктов. Так, фтор и хлор используют для синтеза различных полимерных материалов, хлор также является сырьем при производстве соляной кислоты. Бром и йод нашли широкое применение в медицине, бром также используется лакокрасочной промышленности.
Примеры решения задач
Источник
Не все знают, что под пугающим названием «галогены» зачастую скрываются распространенные в быту вещества. Не в чистом виде, но все-таки. Отдельными представителями «семейства» ежедневно пользуется каждый человек.
Приведём примеры:
На упаковке любой зубной пасты имеется словосочетание со словом «фтор». Полезен для зубной эмали.
Хлор знаком любой домохозяйке и сотруднику клининговой компании. А уж его запах знают все, кто посещал бассейн или лечебные учреждения России. Не пустой звук для советских школьников. Даже не из курса химии, а из уроков химзащиты в рамках начальной военной подготовки (НВП).
Про «бром» ходили легенды среди военнослужащих СССР. Насколько сведения достоверны – неизвестно.
Темно-коричневая бутылочка с «йодом» – постоянный спутник любителя поиграть с котенком и непоседливого ребенка. Распространенный антисептик.
Что такое галогены
Определяют, как элементы 17-ой группы таблицы Менделеева. Сторонники «старой школы» выразились бы: «главной подгруппы VII группы».
Название представляет собой компиляцию греческих слов. Означает приблизительно «солерождающий». Такое определение было дано в XIX веке британским ученым Гэмфри Дэви.
Перечень и общая характеристика галогенов

С первыми четырьмя элементами из списка некоторое знакомство имеется. Надо заметить, что вещества хоть и достаточно распространенные, но в чистом виде в природе не встречаются. Только в составе соединений.
Астат – элемент не просто редкий, а самый редкий из всех встречающихся на планете. Его «запасы» оцениваются в 1 г. Свойства доподлинно не известны. Так как из-за радиоактивности и мизерной «продолжительности жизни» в достаточных количествах выделить не получилось.
Теннессин существует скорее теоретически. На Земле, по крайней мере, не нашли. Рекордное зафиксированное (и признанное) в лаборатории количество – 6 ядер. Включая изотоп.
Зато точно известен общий принцип построения наружного энергетического уровня: ns2np5. Под «n» понимается период расположения элемента.
Легко заметить, что до «идеальных» инертов не хватает всего-то электрончика. А так хочется. Не удивительно, что так агрессивны.
Физические свойства
Галогены – ярко выраженные неметаллы. Летучи, с характерно едким «ароматом». Причем для йода (I2) жидкое агрегатное состояние вообще не характерно. При разогреве просто испаряется фиолетовым дымком.
Хлор – настоящее боевое отравляющее вещество. И применялось в таком качестве. Попадая в незащищенные глаза и органы, образует кислоты. С соответствующими последствиями. Для летального исхода достаточно концентрации в воздухе 2 мг/л.
Насыщенность цветов с «утяжелением» ядер возрастает. Активность, напротив, падает.
В воде растворимость ограничена. Лучше ведёт себя с органическими растворителями. Растворы оригинально окрашены: от слабо желтого до фиолетового.
Химические свойства галогенов
Галогены (Hal) – мощные окислители, а фтор агрессивен настолько, что вступает в реакцию с собратьями. Происходит это при подогреве. Степень окисления «пострадавших» оказывается +1.
Общее уравнение:
![]()
Можно сказать, что F реагирует со всеми простыми субстанциями, кроме отдельных благородных газов. А так (с облучением):
![]()
Остальные элементы ряда не взаимодействуют с:
O;
N;
С (в модификации алмаза);
Pt, Au;
Xe, Kr.
С неметаллами
Водород окисляет фтор при любых условиях, со взрывом. Cl с подсветкой УФ или подогревом. Но тоже громко. Остальные только с нагреванием. Но уравнение едино:
![]()
С фосфором взаимодействуют совершенно по-разному:
∗ F до получения пентафторида. Единственный, без нагревания:
![]()
∗ хлор и бром, в зависимости от концентрации:
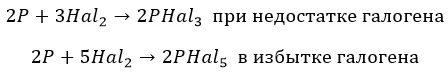
∗ йод – недостаточно мощный окислитель:
![]()
∗ с серой также не все очевидно. Но только не с фтором. Окисление максимально, но с нагревом:
![]()
∗ бром и хлор реагируют нетипично и «неохотно»:
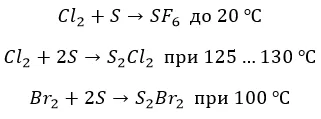
С металлами
Перед фтором ничто не устоит. Даже благородный класс, хоть и с нагревом:
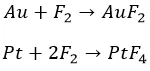
Остальные металлы прочим галогенам по силам. Не без подогрева:
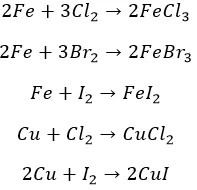
Реакции замещения
Агрессивные вытесняют «тяжелых» соседей по группе:
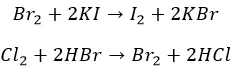
И с неметаллами не церемонятся:
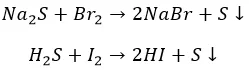
Хлор, как более активный, ведет себя несколько по-другому:
![]()
С водой
Фтор в своем репертуаре. Вода будет пылать синим пламенем и норовить плюнуть плавиковой кислотой:
![]()
Хлор с бромом гораздо спокойнее. Да и процессы нестабильны, обратимы:
![]()
Йод с водой в видимые взаимодействия не вступает.
С растворами щелочей
И в этом случае фтор проявляется как резкий окислитель:
![]()
Остальные ведут себя, как с водой. Но процесс при разных температурах проходит по разным сценариям:
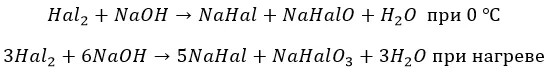
Йод реагирует только по второму варианту.
Получение
Выделить вещество настолько активное, что норовит прореагировать со всем окружающим, не так просто.
Фтор
Обычно получают из сложных солей. При интенсивном нагреве (термолиз) провоцируется распад на более простые и нужный газ.

Или электролизом KF*3HF. Аналогичный метод применяется в промышленности.
Хлор
Из соляной кислоты. Неприятно и опасно даже в условиях лаборатории:
![]()
Индустриально добывают из распространенной поваренной соли при помощи электролиза:
![]()
Бром и йод
«На коленке» – из солей. Окислителями, в кислом же окружении:
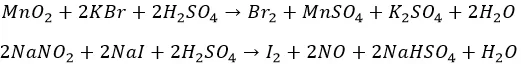
Химзаводам за сырьем ходить не надо. Морская вода, скважные жидкости. Остатки сожженных океанских/морских водорослей – настоящая йодная руда.
Применение галогенов
Как уже упоминалось, фтор применяется в лечебных и профилактических средствах. Соединения необходимы для изготовления алюминия.

Основная часть производимого хлора используется для синтеза соляной кислоты. Необходим в химической индустрии. Для сельскохозяйственных, бытовых ядохимикатов, чистящих средств, отбеливателей. Для очистителей воды.
Бром и йод применяются для медикаментов и в химической отрасли.
Заключение
О свойствах галогенов можно писать бесконечно. В данной статье не затрагивались темы взаимодействий с органическими веществами, например.
А ведь без них невозможен, скажем, фотосинтез. Одна из основ жизни. Без соляной кислоты невозможно пищеварение высших животных. Об этом мы расскажем в следующих публикациях.
Источник
Галогены в периодической таблице расположены слева от благородных газов. Эти пять токсических неметаллических элементов входят в 7 группу периодической таблицы. К ним относятся фтор, хлор, бром, йод и астат. Хотя астат радиоактивен и имеет только короткоживущие изотопы, он ведет себя, как йод, и его часто причисляют к галогенам. Поскольку галогенные элементы имеют семь валентных электронов, им необходим лишь один дополнительный электрон для образования полного октета. Эта характеристика делает их более активными, чем другие группы неметаллов.
Общая характеристика
Галогены образуют двухатомные молекулы (вида Х2, где Х обозначает атом галогена) – устойчивую форму существования галогенов в виде свободных элементов. Связи этих двухатомных молекул являются неполярными, ковалентными и одинарными. Химические свойства галогенов позволяют им легко вступать в соединение с большинством элементов, поэтому они никогда не встречаются в несвязанном виде в природе. Фтор – наиболее активный галоген, а астат – наименее.
Все галогены образуют соли I группы с похожими свойствами. В этих соединениях галогены присутствуют в виде галоидных анионов с зарядом -1 (например, Cl-, Br-). Окончание -ид указывает на наличие галогенид-анионов; например Cl- называется «хлорид».
Кроме того, химические свойства галогенов позволяют им действовать в качестве окислителей – окислять металлы. Большинство химических реакций, в которых участвуют галогены – окислительно-восстановительные в водном растворе. Галогены образуют одинарные связи с углеродом или азотом в органических соединениях, где степень их окисления (СО) равна -1. Когда атом галогена замещён ковалентно-связанным атомом водорода в органическом соединении, префикс гало- может быть использован в общем смысле, или префиксы фтор-, хлор-, бром- , йод- – для конкретных галогенов. Галогенные элементы могут иметь перекрёстную связь с образованием двухатомных молекул с полярными ковалентными одинарными связями.
Хлор (Cl2) стал первым галогеном, открытым в 1774 г., затем были открыты йод (I2), бром (Br2), фтор (F2) и астат (At, обнаружен последним, в 1940 г.). Название «галоген» происходит от греческих корней hal- («соль») и -gen («образовывать»). Вместе эти слова означают «солеобразующий», подчёркивая тот факт, что галогены, вступая в реакцию с металлами, образуют соли. Галит – это название каменной соли, природного минерала, состоящего из хлорида натрия (NaCl). И, наконец, галогены используются в быту – фторид содержится в зубной пасте, хлор обеззараживает питьевую воду, а йод содействует выработке гормонов щитовидной железы.

Химические элементы
Фтор – элемент с атомным номером 9, обозначается символом F. Элементарный фтор впервые был обнаружен в 1886 г. путем выделения его из плавиковой кислоты. В свободном состоянии фтор существует в виде двухатомной молекулы (F2) и является наиболее распространенным галогеном в земной коре. Фтор – наиболее электроотрицательный элемент в периодической таблице. При комнатной температуре является бледно-жёлтым газом. Фтор также имеет относительно небольшой атомный радиус. Его СО – -1, за исключением элементарного двухатомного состояния, в котором его степень окисления равна нулю. Фтор чрезвычайно химически активен и непосредственно взаимодействует со всеми элементами, кроме гелия (He), неона (Ne) и аргона (Ar). В растворе H2O, плавиковой кислоты (HF) является слабой кислотой. Хотя фтор сильно электроотрицателен, его электроотрицательность не определяет кислотность; HF является слабой кислотой в связи с тем, что ион фтора основной (рН> 7). Кроме того, фтор производит очень мощные окислители. Например, фтор может вступать в реакцию с инертным газом ксеноном и образует сильный окислитель дифторид ксенона (XeF2). У фтора множество применений.

Хлор – элемент с атомным номером 17 и химическим символом Cl. Обнаружен в 1774 г. путём выделения его из соляной кислоты. В своём элементарном состоянии он образует двухатомную молекулу Cl2. Хлор имеет несколько СО: -1, +1, 3, 5 и 7. При комнатной температуре он является светло-зеленым газом. Так как связь, которая образуется между двумя атомами хлора, является слабой, молекула Cl2 обладает очень высокой способностью вступать в соединения. Хлор реагирует с металлами с образованием солей, которые называются хлориды. Ионы хлора являются наиболее распространенными ионами, они содержатся в морской воде. Хлор также имеет два изотопа: 35Cl и 37Cl. Хлорид натрия является наиболее распространенным соединением из всех хлоридов.
Бром – химический элемент с атомным номером 35 и символом Br. Впервые был обнаружен в 1826 г. В элементарной форме бром является двухатомной молекулой Br2. При комнатной температуре представляет собой красновато-коричневую жидкость. Его СО – -1, + 1, 3, 4 и 5. Бром более активен, чем йод, но менее активен, чем хлор. Кроме того, бром имеет два изотопа: 79Вг и 81Вг. Бром встречается в виде солей бромида, растворённых в морской воде. За последние годы производство бромида в мире значительно увеличилось благодаря его доступности и продолжительному времени жизни. Как и другие галогены, бром является окислителем и очень токсичен.

Йод – химический элемент с атомным номером 53 и символом I. Йод имеет степени окисления: -1, +1, +5 и +7. Существует в виде двухатомной молекулы, I2. При комнатной температуре является твёрдым веществом фиолетового цвета. Йод имеет один стабильный изотоп – 127I. Впервые обнаружен в 1811 г. с помощью морских водорослей и серной кислоты. В настоящее время ионы йода, могут быть выделены в морской воде. Несмотря на то что йод не очень хорошо растворим в воде, его растворимость может возрасти при использовании отдельных йодидов. Йод играет важную роль в организме, участвуя в выработке гормонов щитовидной железы.

Астат – радиоактивный элемент с атомным номером 85 и символом At. Его возможные степени окисления: -1, +1, 3, 5 и 7. Единственный галоген, не являющийся двухатомной молекулой. В нормальных условиях является металлическим твёрдым веществом чёрного цвета. Астат является очень редким элементом, поэтому о нём известно немного. Кроме того, астат имеет очень короткий период полураспада, не дольше нескольких часов. Получен в 1940 г. в результате синтеза. Полагают, что астат похож на йод. Отличается металлическими свойствами.
В таблице ниже показано строение атомов галогенов, структура внешнего слоя электронов.
Галоген | Конфигурация электронов |
Фтор | 1s2 2s2 2p5 |
Хлор | 3s2 3p5 |
Бром | 3d10 4s2 4p5 |
Иод | 4d10 5s2 5p5 |
Астат | 4f14 5d10 6s2 6p5 |
Подобное строение внешнего слоя электронов обусловливает то, что физические и химические свойства галогенов похожи. Вместе с тем при сопоставлении этих элементов наблюдаются и различия.
Периодические свойства в группе галогенов
Физические свойства простых веществ галогенов изменяются с повышением порядкового номера элемента. Для лучшего усвоения и большей наглядности мы предлагаем вам несколько таблиц.
Точки плавления и кипения в группе возрастают по мере роста размера молекулы (F <Cl <Br <I <At). Это увеличение означает увеличение силы Ван-дер-Ваальса.
Таблица 1. Галогены. Физические свойства: точки плавления и кипения
Галоген | Т плавления (˚C) | Т кипения (˚C) |
Фтор | -220 | -188 |
Хлор | -101 | -35 |
Бром | -7.2 | 58.8 |
Иод | 114 | 184 |
Астат | 302 | 337 |
- Атомный радиус увеличивается.
Размер ядра увеличивается (F < Cl < Br < I < At), так как увеличивается число протонов и нейтронов. Кроме того, с каждым периодом добавляется всё больше уровней энергии. Это приводит к большей орбитали, и, следовательно, к увеличению радиуса атома.
Таблица 2. Галогены. Физические свойства: атомные радиусы
Галоген | Ковалентный радиус (пм) | Ионный (X-) радиус (пм) |
Фтор | 71 | 133 |
Хлор | 99 | 181 |
Бром | 114 | 196 |
Иод | 133 | 220 |
Астат | 150 |
- Энергия ионизации уменьшается.
Если внешние валентные электроны не находятся вблизи ядра, то для их удаления от него не потребуется много энергии. Таким образом, энергия, необходимая для выталкивания внешнего электрона не столь высока в нижней части группы элементов, так как здесь больше энергетических уровней. Кроме того, высокая энергия ионизации заставляет элемент проявлять неметаллические качества. Йод и дисплей астат проявляют металлические свойства, потому что энергия ионизации снижается (At < I < Br < Cl < F).
Таблица 3. Галогены. Физические свойства: энергия ионизации
Галоген | Энергия ионизации (кДж/моль) |
фтор | 1681 |
хлор | 1251 |
бром | 1140 |
йод | 1008 |
астат | 890±40 |
- Электроотрицательность уменьшается.
Число валентных электронов в атоме возрастает с увеличением уровней энергии при прогрессивно более низких уровнях. Электроны прогрессивно дальше от ядра; Таким образом, ядро и электроны не как притягиваются друг к другу. Увеличение экранирования наблюдается. Поэтому Электроотрицательность уменьшается с ростом периода (At < I < Br < Cl < F).
Таблица 4. Галогены. Физические свойства: электроотрицательность
Галоген | Электроотрицательность |
фтор | 4.0 |
хлор | 3.0 |
бром | 2.8 |
иод | 2.5 |
астат | 2.2 |
- Сродство к электрону уменьшается.
Так как размер атома увеличивается с увеличением периода, сродство к электрону, как правило, уменьшается (В < I < Br < F < Cl). Исключение – фтор, сродство которого меньше, чем у хлора. Это можно объяснить меньшим размером фтора по сравнению с хлором.
Таблица 5. Сродство галогенов к электрону
Галоген | Сродство к электрону (кДж/моль) |
фтор | -328.0 |
хлор | -349.0 |
бром | -324.6 |
иод | -295.2 |
астат | -270.1 |
- Реактивность элементов уменьшается.
Реакционная способность галогенов падает с ростом периода (At <I <Br <Cl <F). Это связано с увеличением радиуса атома с возрастанием уровней энергии электронов. Это снижает притяжение валентных электронов других атомов, снижая реакционную способность. Это уменьшение также происходит из-за падения электроотрицательности с увеличением периода, что также снижает притяжение электронов. Кроме того, с увеличением размера атома снижается и окислительная способность.

Неорганическая химия. Водород + галогены
Галогенид образуется, когда галоген реагирует с другим, менее электроотрицательным элементом с образованием бинарного соединения. Водород реагирует с галогенами, образуя галогениды вида НХ:
- фтороводород HF;
- хлороводород HCl;
- бромоводород HBr;
- иодоводород HI.
Галогениды водорода легко растворяются в воде с образованием галогенводородной (плавиковой, соляной, бромистоводородной, иодистоводородной) кислоты. Свойства этих кислот приведены ниже.
Кислоты образуются следующей реакцией: HX (aq) + H2O (l) → Х- (aq) + H3O+ (aq).
Все галоидоводороды образуют сильные кислоты, за исключением HF.
Кислотность галогеноводородных кислот увеличивается: HF <HCl <HBr <HI.
Плавиковая кислота способна гравировать стекло и некоторые неорганические фториды длительное время.
Может показаться нелогичным, что HF является самой слабой галогенводородной кислотой, так как фтор обладает самой высокой электроотрицательностью. Тем не менее связь Н-F очень сильна, в результате чего кислота очень слабая. Сильная связь определяется короткой длиной связи и большой энергией диссоциации. Из всех галогенидов водорода HF имеет самую короткую длину связи и самую большую энергию диссоциации связи.
Галогенные оксокислоты
Галогенные оксокислоты представляют собой кислоты с атомами водорода, кислорода и галогена. Их кислотность может быть определена с помощью анализа структуры. Галогенные оксокислоты приведены ниже:
- Хлорноватистая кислота HOCl.
- Хлористая кислота HClO2.
- Хлорноватая кислота HClO3.
- Хлорная кислота HClO4.
- Бромноватистая кислота HOBr.
- Бромноватая кислота HBrO3.
- Бромная кислота HBrO4.
- Иодноватистая кислота HOI.
- Йодноватая кислота HIO3.
- Метайодная кислота HIO4, H5IO6.
В каждой из этих кислот протон связан с атомом кислорода, поэтому сравнение длин связей протонов здесь бесполезно. Доминирующую роль здесь играет электроотрицательность. Активность кислотны возрастает с увеличением числа атомов кислорода, связанный с центральным атомом.
Внешний вид и состояние вещества
Основные физические свойства галогенов кратко можно выразить в следующей таблице.
Состояние вещества (при комнатной температуре) | Галоген | Внешний вид |
твёрдое | йод | фиолетовый |
астат | чёрный | |
жидкое | бром | красно-коричневый |
газообразное | фтор | бледно-жёлто-коричневый |
хлор | бледно-зелёный |
Объяснение внешнего вида
Цвет галогенов является результатом поглощения видимого света молекулами, что вызывает возбуждение электронов. Фтор поглощает фиолетовый свет, и, следовательно, выглядит светло-жёлтым. Йод, наоборот, поглощает жёлтый свет и выглядит фиолетовым (жёлтый и фиолетовый – дополняющие цвета). Цвет галогенов становится темнее с ростом периода.

В закрытых ёмкостях жидкий бром и твёрдый йод находятся в равновесии со своими парами, которые можно наблюдать в виде цветного газа.
Хотя цвет астата неизвестен, предполагается, что он должен быть темнее йода (т. е. черным) в соответствии с наблюдаемой закономерностью.
Теперь, если вас попросят: «Охарактеризуйте физические свойства галогенов», вам будет что сказать.
