Какие свойства проявляют бинарные соединения

Бина́рные соедине́ния — химические вещества, образованные двумя химическими элементами[1]. Многоэлементные вещества, в формульной единице которых одна из составляющих содержит несвязанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения.
Бинарные соединения, несмотря на кажущуюся простоту их химического состава, представляют собой следующий после простых веществ принципиально важный объект изучения природы вещества. С химической точки зрения, этот класс веществ обладает и качественно иными характеристиками, с которыми не приходится сталкиваться при изучении простых веществ. Во-первых, помимо внешних факторов, влияющих на состояние и свойства вещества (температура и давление), здесь появляется и внутренний фактор — состав, и связанная с ним проблема постоянства и переменности состава, имеющая фундаментальное значение в химии. Во-вторых, при описании бинарных соединений впервые формируются такие базисные понятия, как валентность, степень окисления, поляризация химической связи. Здесь, в отличие от простых веществ, появляются гетерополярная составляющая химической связи и все эффекты, связанные с разностью электроотрицательностей компонентов.
Исключительно важную роль играют бинарные соединения с классификационной точки зрения. Многие из них относятся и к так называемым характеристическим соединениям, отражающим типичные степени окисления и их сравнительную стабильность. К таким соединениям относятся прежде всего оксиды, летучие водородные соединения, а также галогениды.
Номенклатура[править | править код]
Бинарные соединения — это собирательная группа веществ, которые имеют различное химическое строение. Поэтому их номенклатура может варьироваться в зависимости от генетической принадлежности.
Названия простых бинарных веществ, как правило, образуются добавлением к названию более электроотрицательного элемента суффикса -ид. При необходимости к названиям элементов добавляют кратные приставки или указывают в скобках степень окисления электроположительного элемента без пробела:
- SiC — карби́д кре́мния;
- KBr — броми́д ка́лия;
- Fe2O3 — окси́д желе́за(III);
- CS2 — дисульфи́д углеро́да или сульфи́д углеро́да(IV).
В сложных бинарных соединениях суффикс -ид добавляется к названиям элементов, находящихся в низших степенях окисления:
- PCl3O — окси́д-трихлори́д фо́сфора, или оксихлори́д фо́сфора, трихлорокси́д фосфора(V);
- CrO2Cl2 — диокси́д-дихлори́д хро́ма;
- СCl2O — окси́д-дихлори́д углеро́да или хлорангидрид угольной кислоты, больше известный как фосге́н.
Многие широко известные бинарные соединения носят тривиальные названия, среди них уже приведённый выше фосген, вода H2O, аммиак NH3, веселящий газ N2O и другие.
Свойства[править | править код]
Группа бинарных соединений включает в себя очень большое число веществ, и, естественно, все эти вещества различаются по физическим свойствам. Среди бинарных соединений есть представляющие собой при нормальных условиях газы (например, аммиак, фосфин), жидкости (например, тетрахлорид титана TiCl4, дисульфид углерода CS2) и твёрдые вещества (например, нитрид бора BN, карбид кремния SiC)
Химическая связь в бинарных соединениях — ковалентная полярная (в соединениях неметаллов и некоторых амфотерных элементов) или ионная (в солях бескислородных кислот).
Многие бинарные соединения гидролизуются водой, например фосфин или хлорид алюминия.
Получение[править | править код]
Часто бинарные соединения можно получить прямым взаимодействием простых веществ между собой:
- N2 + 3H2 ⇆ 2NH3 (p, T, кат.)
- 2Na + Cl2 = 2NaCl
Другие бинарные вещества могут получаться более сложным путём — через реакции обмена или окислительно-восстановительные реакции:
- AgNO3(р.) + NaBr(р.) = AgBr↓ + NaNO3(р.)
- NH4NO3 = N2O + 2H2O (до 250 °C)
Применение[править | править код]
В силу того, что к данной группе веществ можно отнести очень большое их количество, можно сказать, что бинарные соединения применяются практически во всех областях деятельности человека, от приготовления пищи до использования в качестве сырья для крупнотоннажных производств. Ниже приведены примеры использования некоторых веществ, относящихся к бинарным соединениям.
Аммиак[править | править код]
В химической промышленности аммиак используется в качестве прекурсора для получения азотной кислоты и для производства химических удобрений. Кроме того, аммиак используется в большом количестве разнообразных химических синтезов, в том числе в тонком органическом синтезе. В жидком аммиаке химически растворяются многие вещества, например, калий, натрий, сера. Аммиак применялся в качестве хладагента в первых холодильниках, и до недавнего времени превалировал в промышленных холодильных установках.
Гексафторид урана[править | править код]
Летучий гексафторид урана UF6 применяется для разделения изотопов урана в процессе его обогащения, а также как фторирующий агент.
Карбид вольфрама[править | править код]
Карбид вольфрама в силу своей исключительной твердости находит очень широкое применение в производстве разнообразного режущего инструмента, а в силу своей химической инертности — в производстве оборудования для работы в агрессивных средах (печи, ножи, лабораторное оборудование).
Оксид диазота[править | править код]
«Веселящий газ» N2O в смесях с кислородом применяется в медицине как агент для ингаляционного общего наркоза.
Хлороводород[править | править код]
Водный раствор хлороводорода (соляная кислота) широко используется для получения хлоридов, для травления металлов, очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамата натрия, соды, хлора и других продуктов. Также применяется в органическом синтезе.
Примечания[править | править код]
Литература[править | править код]
Андреева Л. Л., Лидин Р. А., Молочко В. А. Химические свойства неорганических веществ. Учебное пособие для вузов. — М.: Химия, 1996.
Источник
Бинарные соединения – это вещества, которые образованы двумя различными химическими элементами. Этот термин применяют при обозначении качественного и количественного состава неорганических соединений.
Бинарные химические соединения считаются важным объектом в изучении природы веществ. При их описании используют следующие понятия: поляризация связи, степень окисления, валентность. Данные химические термины позволяют понять суть образования химической связи, особенности строения неорганических веществ.
Рассмотрим основные классы бинарных соединений, особенности их химического строения и свойства, некоторые области их промышленного применения.

Оксиды
Данный класс неорганических веществ является самым распространенным в природе. Среди известных представителей этой группы соединений выделим:
- оксид кремния (речной песок);
- оксид водорода (вода);
- углекислый газ;
- глина (оксид алюминия);
- железняки (оксиды железа).
Такие бинарные соединения – это сложные вещества, в составе которых обязательно присутствует кислород, проявляющий степень окисления -2.
Агрегатное состояние оксидов
Соединения меди, кальция, железа являются кристаллическими твердыми веществами. Такое же агрегатное состояние имеют оксиды некоторых неметаллов, например шестивалентной серы, пятивалентного фосфора, кремния. Жидкостью при нормальных условиях является вода. Подавляющее большинство кислородных соединений неметаллов являются газами.
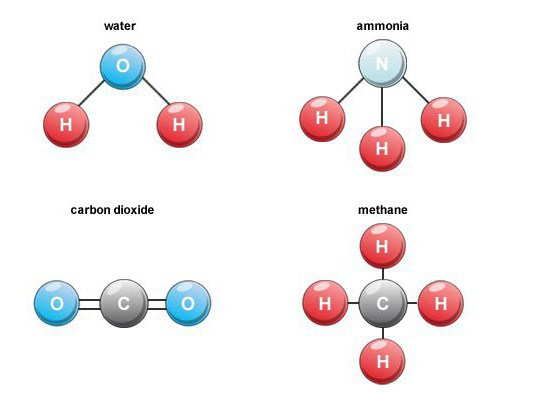
Особенности образования
Многие бинарные кислородные соединения образуются в природе. Например, при сгорании топлива, дыхании, гниении органических веществ формируется углекислый газ (оксид углерода 4). В воздухе его объемное содержание составляет около 0,03 процентов.
Подобные бинарные соединения – это продукты деятельности вулканов, а также составная часть минеральной воды. Углекислый газ не поддерживает горения, поэтому данное химическое соединение применяется для тушения пожаров.
Летучие водородные соединения
Такие бинарные соединения – это важная группа веществ, в составе которых присутствует водород. Среди представителей, имеющих промышленное значение, отметим метан, воду, сероводород, аммиак, а также галогеноводороды.
Часть летучих водородных соединений присутствует в почвенных водах, живых организмах, поэтому можно вести речь об их геохимической и биохимической роли.
Чтобы составлять бинарные соединения такого вида, на первое место ставят водород, имеющий валентность. В качестве второго элемента выступает неметалл, имеющий отрицательную степень окисления.
Для расстановки индексов в бинарном соединении между валентностями определяется наименьшее общее кратное. Количество атомов каждого элемента определяют путем деления его на валентности каждого элемента, входящего в состав соединения.
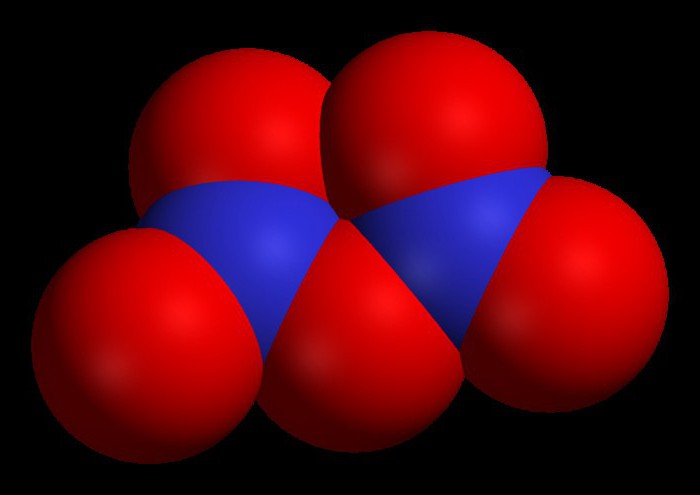
Хлороводород
Рассмотрим формулы бинарных соединений: хлороводорода и аммиака. Именно эти вещества имеют значение для современной химической промышленности. HCl при нормальных условиях является газообразным соединением, хорошо растворимым в воде. После растворения газообразного хлороводорода образуется соляная кислота, используемая во многих химических процессах и производственных цепочках.
Это бинарное соединение содержится в желудочном соке человека и животных, является барьером для болезнетворных микробов, проникающих с пищей в желудок.
Среди основных областей применения соляной кислоты выделим получение хлоридов, синтез хлорсодержащих продуктов, травление металлов, очистку труб от оксидов и карбонатов, кожевенное производство.
Аммиак, имеющий формулу NH3, является бесцветным газом, обладающим специфическим резким запахом. Его неограниченная растворимость в воде позволяет получать нашатырный спирт, востребованный в медицине. В природе данное бинарное соединение образуется в процессе гниения органических продуктов, в составе которых присутствует азот.

Классификация оксидов
Кислородсодержащее бинарное соединение металла, имеющего валентность 1 или 2, является основным оксидом. Например, к этой группе относят оксиды щелочных и щелочноземельных металлов.
Оксиды неметаллов, а также металлов с валентностью больше 4, являются кислотными соединениями.
В зависимости от химических свойств представителей данного класса делят на солеобразующие и несолеобразующие группы.
Среди типичных представителей второй группы отметим угарный газ (CO), оксид азота 1 (NO).
Формирование систематических названий соединений
Среди заданий, предлагаемых выпускникам, сдающим государственный экзамен по химии, есть и такое: «Составьте молекулярные формулы возможных бинарных кислородных соединений серы (азота, фосфора)». Для того чтобы справиться с поставленной задачей, необходимо иметь представление не только об алгоритме, но и об особенностях номенклатуры данного класса неорганических веществ.
При формировании наименования бинарного соединения, первоначально указывают тот элемент, который в формуле располагается справа, добавляя суффикс «ид». Далее указывают название первого элемента. Для ковалентных соединений добавляют приставки, по которым можно установить количественное соотношение между составными частями бинарного соединения.
Например, SO3 – триоксид серы, N2O4 – тетроксид диазота, I2CL6 – гексахлорид диода.
Если в бинарном соединении присутствует химический элемент, способный проявлять разные степени окисления, после названия соединения в круглых скобках указывают состояние окисления.
К примеру, два соединения железа отличаются по названию: FeCL3 – оксид железа (3), FeCL2 – оксид железа (2).
Для гидридов, в частности неметаллических элементов, пользуются тривиальными названиями. Так, H2O – вода, HCL – хлороводород, HI – йодоводород, HF – плавиковая кислота.
Катионы
Положительным ионам тех элементов, которые способны образовывать только один устойчивый ион, дают такие же названия, как и у самих символов. К ним относятся все представители первой и второй групп периодической системы Менделеева.
Например, катионы натрия и магния имеют вид: Na+, Mg2+. Переходные элементы способны образовывать несколько видов катионов, поэтому в названии необходимо указывать валентность, проявляемую в каждом отдельном случае.
Анионы
У простых (одноатомных) и комплексных (многоатомных) анионов применяется суффикс –ид.
Распространенным оксоанионом определенного элемента является суффикс –ам. Для оксоаниона элемента, находящегося в формуле с меньшей степенью окисления, применяется суффикс –ит. Для минимального состояния окисления используется приставка гипо-, а для максимального значения – пер-. Например, ион О2- является оксид-ионом, а О- – пероксидом.
Существуют и разнообразные тривиальные названия гидридов. Например, N2H4 именуют гидразином, а PH3 называют фосфином.
Серосодержащие оксоанионы имеют следующие названия:
- SO42- – сульфат;
- S2O32- – тиосульфат;
- NCS- – тиоцианат.
Соли
Во многих итоговых тестах по химии предлагается следующее задание: «Составьте формулы бинарных соединений металлов». Если в составе таких соединений есть анионы хлора, брома, йода, такие соединения называют галогенидами, относят к классу солей. При составлении формул этих бинарных соединений на первое место ставится металл, затем соответствующий галогенид-ион.
Для определения количества атомов каждого элемента находят наименьшее кратное между валентностями, при делении получают индексы.
У таких соединений высокая температура плавления и кипения, хорошая растворимость в воде, при нормальных условиях они являются твердыми веществами. Например, хлориды натрия и калия входят в состав морской воды.
Поваренную соль люди применяют с древних времен. В настоящее время использование этого бинарного соединения не ограничивается употреблением в пищу. При электролизе водного раствора хлорида натрия получают металлический натрий и газообразный хлор. Эти продукты используются в различных производственных процессах, например для получения гидроксида натрия, хлороводорода.
Значение бинарных соединений
К данной группе относится огромное количество веществ, поэтому можно с уверенностью говорить о масштабности их использования в разных сферах человеческой деятельности. Аммиак в химической промышленности применяют в качестве прекурсора при изготовлении азотной кислоты, производстве минеральных удобрений. Именно это бинарное соединение применяют в тонком органическом синтезе, долгое время использовали в холодильных установках.
Благодаря уникальной твердости карбида вольфрама, это соединение нашло применение в изготовлении многообразного режущего инструмента. Химическая инертность этого бинарного соединения позволяет применять его в агрессивных средах: лабораторном оборудовании, печах.
«Веселящий газ» (оксид азота 1) в смеси с кислородом используется в медицине для общего наркоза.
Все бинарные соединения имеют ковалентный либо ионный характер химической связи, молекулярную, ионную или атомную кристаллическую решетку.
Заключение
При составлении формул бинарных соединений необходимо соблюдать определенный алгоритм действий. Сначала записывается элемент, который проявляет положительную степень окисления (имеет меньшее значение электрической отрицательности). При определении значения степени окисления у второго элемента из восьми вычитают номер группы, в котором он находится. Если полученные числа отличаются между собой, определяется наименьшее общее кратное, затем вычисляются индексы.
Помимо оксидов, к данным соединениям причисляют карбиды, силициды, пероксиды, гидриды. Карбиды алюминия и кальция используют для лабораторного получения метана и ацетилена, пероксиды используют в химической промышленности в качестве сильных окислителей.
Такой галогенид, как фтороводород (плавиковая кислота), используется в электротехнике при паянии. Среди самых важных бинарных соединений, без которых трудно представить себе существование живых организмов, лидирует вода. Особенности строения этого неорганического соединения подробно изучаются в школьном курсе химии. Именно на ее примере ребята получают представления о последовательности действий при составлении формул бинарных соединений.
В заключение отметим, что сложно найти такую сферу современной промышленности, область человеческой жизни, где бы ни применялись разнообразные бинарные соединения.
Источник
ÐинаÌÑнÑе ÑоединеÌÐ½Ð¸Ñ â Ñ Ð¸Ð¼Ð¸ÑеÑкие веÑеÑÑва, обÑазованнÑе двÑÐ¼Ñ Ñ Ð¸Ð¼Ð¸ÑеÑкими ÑлеменÑами[1]. ÐногоÑлеменÑнÑе веÑеÑÑва, в ÑоÑмÑлÑной единиÑе коÑоÑÑÑ Ð¾Ð´Ð½Ð° из ÑоÑÑавлÑÑÑÐ¸Ñ ÑодеÑÐ¶Ð¸Ñ Ð½ÐµÑвÑзаннÑе Ð¼ÐµÐ¶Ð´Ñ Ñобой аÑÐ¾Ð¼Ñ Ð½ÐµÑколÑÐºÐ¸Ñ ÑлеменÑов, а Ñакже одноÑлеменÑнÑе или многоÑлеменÑнÑе гÑÑÐ¿Ð¿Ñ Ð°Ñомов (кÑоме гидÑокÑидов и Ñолей), ÑаÑÑмаÑÑиваÑÑ ÐºÐ°Ðº бинаÑнÑе ÑоединениÑ.
ÐинаÑнÑе ÑоединениÑ, неÑмоÑÑÑ Ð½Ð° кажÑÑÑÑÑÑ Ð¿ÑоÑÑоÑÑ Ð¸Ñ Ñ Ð¸Ð¼Ð¸ÑеÑкого ÑоÑÑава, пÑедÑÑавлÑÑÑ Ñобой ÑледÑÑÑий поÑле пÑоÑÑÑÑ Ð²ÐµÑеÑÑв пÑинÑипиалÑно важнÑй обÑÐµÐºÑ Ð¸Ð·ÑÑÐµÐ½Ð¸Ñ Ð¿ÑиÑÐ¾Ð´Ñ Ð²ÐµÑеÑÑва. С Ñ Ð¸Ð¼Ð¸ÑеÑкой ÑоÑки зÑениÑ, ÑÑÐ¾Ñ ÐºÐ»Ð°ÑÑ Ð²ÐµÑеÑÑв Ð¾Ð±Ð»Ð°Ð´Ð°ÐµÑ Ð¸ каÑеÑÑвенно инÑми Ñ Ð°ÑакÑеÑиÑÑиками, Ñ ÐºÐ¾ÑоÑÑми не пÑÐ¸Ñ Ð¾Ð´Ð¸ÑÑÑ ÑÑалкиваÑÑÑÑ Ð¿Ñи изÑÑении пÑоÑÑÑÑ Ð²ÐµÑеÑÑв. Ðо-пеÑвÑÑ , помимо внеÑÐ½Ð¸Ñ ÑакÑоÑов, влиÑÑÑÐ¸Ñ Ð½Ð° ÑоÑÑоÑние и ÑвойÑÑва веÑеÑÑва (ÑемпеÑаÑÑÑа и давление), здеÑÑ Ð¿Ð¾ÑвлÑеÑÑÑ Ð¸ внÑÑÑенний ÑакÑÐ¾Ñ â ÑоÑÑав, и ÑвÑÐ·Ð°Ð½Ð½Ð°Ñ Ñ Ð½Ð¸Ð¼ пÑоблема поÑÑоÑнÑÑва и пеÑеменноÑÑи ÑоÑÑава, имеÑÑÐ°Ñ ÑÑндаменÑалÑное знаÑение в Ñ Ð¸Ð¼Ð¸Ð¸. Ðо-вÑоÑÑÑ , пÑи опиÑании бинаÑнÑÑ Ñоединений впеÑвÑе ÑоÑмиÑÑÑÑÑÑ Ñакие базиÑнÑе понÑÑиÑ, как валенÑноÑÑÑ, ÑÑÐµÐ¿ÐµÐ½Ñ Ð¾ÐºÐ¸ÑлениÑ, полÑÑизаÑÐ¸Ñ Ñ Ð¸Ð¼Ð¸ÑеÑкой ÑвÑзи. ÐдеÑÑ, в оÑлиÑие Ð¾Ñ Ð¿ÑоÑÑÑÑ Ð²ÐµÑеÑÑв, поÑвлÑÑÑÑÑ Ð³ÐµÑеÑополÑÑÐ½Ð°Ñ ÑоÑÑавлÑÑÑÐ°Ñ Ñ Ð¸Ð¼Ð¸ÑеÑкой ÑвÑзи и вÑе ÑÑÑекÑÑ, ÑвÑзаннÑе Ñ ÑазноÑÑÑÑ ÑлекÑÑооÑÑиÑаÑелÑноÑÑей компоненÑов.
ÐÑклÑÑиÑелÑно важнÑÑ ÑÐ¾Ð»Ñ Ð¸Ð³ÑаÑÑ Ð±Ð¸Ð½Ð°ÑнÑе ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ Ñ ÐºÐ»Ð°ÑÑиÑикаÑионной ÑоÑки зÑениÑ. Ðногие из Ð½Ð¸Ñ Ð¾ÑноÑÑÑÑÑ Ð¸ к Ñак назÑваемÑм Ñ Ð°ÑакÑеÑиÑÑиÑеÑким ÑоединениÑм, оÑÑажаÑÑим ÑипиÑнÑе ÑÑепени окиÑÐ»ÐµÐ½Ð¸Ñ Ð¸ Ð¸Ñ ÑÑавниÑелÑнÑÑ ÑÑабилÑноÑÑÑ. Ð Ñаким ÑоединениÑм оÑноÑÑÑÑÑ Ð¿Ñежде вÑего окÑидÑ, леÑÑÑие водоÑоднÑе ÑоединениÑ, а Ñакже галогенидÑ.
ÐоменклаÑÑÑа[ | ]
ÐинаÑнÑе ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ â ÑÑо ÑобиÑаÑелÑÐ½Ð°Ñ Ð³ÑÑппа веÑеÑÑв, коÑоÑÑе имеÑÑ ÑазлиÑное Ñ Ð¸Ð¼Ð¸ÑеÑкое ÑÑÑоение. ÐоÑÑÐ¾Ð¼Ñ Ð¸Ñ Ð½Ð¾Ð¼ÐµÐ½ÐºÐ»Ð°ÑÑÑа Ð¼Ð¾Ð¶ÐµÑ Ð²Ð°ÑÑиÑоваÑÑÑÑ Ð² завиÑимоÑÑи Ð¾Ñ Ð³ÐµÐ½ÐµÑиÑеÑкой пÑинадлежноÑÑи.
ÐÐ°Ð·Ð²Ð°Ð½Ð¸Ñ Ð¿ÑоÑÑÑÑ Ð±Ð¸Ð½Ð°ÑнÑÑ Ð²ÐµÑеÑÑв, как пÑавило, обÑазÑÑÑÑÑ Ð´Ð¾Ð±Ð°Ð²Ð»ÐµÐ½Ð¸ÐµÐ¼ к Ð½Ð°Ð·Ð²Ð°Ð½Ð¸Ñ Ð±Ð¾Ð»ÐµÐµ ÑлекÑÑооÑÑиÑаÑелÑного ÑлеменÑа ÑÑÑÑикÑа -ид. ÐÑи Ð½ÐµÐ¾Ð±Ñ Ð¾Ð´Ð¸Ð¼Ð¾ÑÑи к названиÑм ÑлеменÑов добавлÑÑÑ ÐºÑаÑнÑе пÑиÑÑавки или ÑказÑваÑÑ Ð² ÑÐºÐ¾Ð±ÐºÐ°Ñ ÑÑÐµÐ¿ÐµÐ½Ñ Ð¾ÐºÐ¸ÑÐ»ÐµÐ½Ð¸Ñ ÑлекÑÑоположиÑелÑного ÑлеменÑа без пÑобела:
- SiC â каÑбиÌд кÑеÌмниÑ;
- KBr â бÑомиÌд каÌлиÑ;
- Fe2O3 â окÑиÌд желеÌза(III);
- CS2 â диÑÑлÑÑиÌд ÑглеÑоÌда или ÑÑлÑÑиÌд ÑглеÑоÌда(IV).
Ð ÑложнÑÑ Ð±Ð¸Ð½Ð°ÑнÑÑ ÑоединениÑÑ ÑÑÑÑÐ¸ÐºÑ -ид добавлÑеÑÑÑ Ðº названиÑм ÑлеменÑов, Ð½Ð°Ñ Ð¾Ð´ÑÑÐ¸Ñ ÑÑ Ð² низÑÐ¸Ñ ÑÑепенÑÑ Ð¾ÐºÐ¸ÑлениÑ:
- PCl3O â окÑиÌд-ÑÑÐ¸Ñ Ð»Ð¾ÑиÌд ÑоÌÑÑоÑа, или окÑÐ¸Ñ Ð»Ð¾ÑиÌд ÑоÌÑÑоÑа, ÑÑÐ¸Ñ Ð»Ð¾ÑокÑиÌд ÑоÑÑоÑа(V);
- CrO2Cl2 â диокÑиÌд-Ð´Ð¸Ñ Ð»Ð¾ÑиÌд Ñ ÑоÌма;
- СCl2O â окÑиÌд-Ð´Ð¸Ñ Ð»Ð¾ÑиÌд ÑглеÑоÌда или Ñ Ð»Ð¾ÑангидÑид ÑголÑной киÑлоÑÑ, болÑÑе извеÑÑнÑй как ÑоÑгеÌн.
Ðногие ÑиÑоко извеÑÑнÑе бинаÑнÑе ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ Ð½Ð¾ÑÑÑ ÑÑивиалÑнÑе названиÑ, ÑÑеди Ð½Ð¸Ñ Ñже пÑиведÑннÑй вÑÑе ÑоÑген, вода H2O, аммиак NH3, веÑелÑÑий газ N2O и дÑÑгие.
СвойÑÑва[ | ]
ÐÑÑппа бинаÑнÑÑ Ñоединений вклÑÑÐ°ÐµÑ Ð² ÑÐµÐ±Ñ Ð¾ÑÐµÐ½Ñ Ð±Ð¾Ð»ÑÑое ÑиÑло веÑеÑÑв, и, еÑÑеÑÑвенно, вÑе ÑÑи веÑеÑÑва ÑазлиÑаÑÑÑÑ Ð¿Ð¾ ÑизиÑеÑким ÑвойÑÑвам. СÑеди бинаÑнÑÑ Ñоединений еÑÑÑ Ð¿ÑедÑÑавлÑÑÑие Ñобой пÑи ноÑмалÑнÑÑ ÑÑловиÑÑ Ð³Ð°Ð·Ñ (напÑимеÑ, аммиак, ÑоÑÑин), жидкоÑÑи (напÑимеÑ, ÑеÑÑÐ°Ñ Ð»Ð¾Ñид ÑиÑана TiCl4, диÑÑлÑÑид ÑглеÑода CS2) и ÑвÑÑдÑе веÑеÑÑва (напÑимеÑ, ниÑÑид боÑа BN, каÑбид кÑÐµÐ¼Ð½Ð¸Ñ SiC)
ХимиÑеÑÐºÐ°Ñ ÑвÑÐ·Ñ Ð² бинаÑнÑÑ ÑоединениÑÑ â коваленÑÐ½Ð°Ñ Ð¿Ð¾Ð»ÑÑÐ½Ð°Ñ (в ÑоединениÑÑ Ð½ÐµÐ¼ÐµÑаллов и некоÑоÑÑÑ Ð°Ð¼ÑоÑеÑнÑÑ ÑлеменÑов) или Ð¸Ð¾Ð½Ð½Ð°Ñ (в ÑолÑÑ Ð±ÐµÑкиÑлоÑоднÑÑ ÐºÐ¸ÑлоÑ).
Ðногие бинаÑнÑе ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ Ð³Ð¸Ð´ÑолизÑÑÑÑÑ Ð²Ð¾Ð´Ð¾Ð¹, напÑÐ¸Ð¼ÐµÑ ÑоÑÑин или Ñ Ð»Ð¾Ñид алÑминиÑ.
ÐолÑÑение[ | ]
ЧаÑÑо бинаÑнÑе ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ Ð¼Ð¾Ð¶Ð½Ð¾ полÑÑиÑÑ Ð¿ÑÑмÑм взаимодейÑÑвием пÑоÑÑÑÑ Ð²ÐµÑеÑÑв Ð¼ÐµÐ¶Ð´Ñ Ñобой:
- N2 + 3H2 â 2NH3 (p, T, каÑ.)
- 2Na + Cl2 = 2NaCl
ÐÑÑгие бинаÑнÑе веÑеÑÑва могÑÑ Ð¿Ð¾Ð»ÑÑаÑÑÑÑ Ð±Ð¾Ð»ÐµÐµ ÑложнÑм пÑÑÑм â ÑеÑез ÑеакÑии обмена или окиÑлиÑелÑно-воÑÑÑановиÑелÑнÑе ÑеакÑии:
- AgNO3(Ñ.) + NaBr(Ñ.) = AgBrâ + NaNO3(Ñ.)
- NH4NO3 = N2O + 2H2O (до 250 °C)
ÐÑименение[ | ]
Ð ÑÐ¸Ð»Ñ Ñого, ÑÑо к данной гÑÑппе веÑеÑÑв можно оÑнеÑÑи оÑÐµÐ½Ñ Ð±Ð¾Ð»ÑÑое Ð¸Ñ ÐºÐ¾Ð»Ð¸ÑеÑÑво, можно ÑказаÑÑ, ÑÑо бинаÑнÑе ÑÐ¾ÐµÐ´Ð¸Ð½ÐµÐ½Ð¸Ñ Ð¿ÑименÑÑÑÑÑ Ð¿ÑакÑиÑеÑки во вÑÐµÑ Ð¾Ð±Ð»Ð°ÑÑÑÑ Ð´ÐµÑÑелÑноÑÑи Ñеловека, Ð¾Ñ Ð¿ÑигоÑÐ¾Ð²Ð»ÐµÐ½Ð¸Ñ Ð¿Ð¸Ñи до иÑполÑÐ·Ð¾Ð²Ð°Ð½Ð¸Ñ Ð² каÑеÑÑве ÑÑÑÑÑ Ð´Ð»Ñ ÐºÑÑпноÑоннажнÑÑ Ð¿ÑоизводÑÑв. Ðиже пÑÐ¸Ð²ÐµÐ´ÐµÐ½Ñ Ð¿ÑимеÑÑ Ð¸ÑполÑÐ·Ð¾Ð²Ð°Ð½Ð¸Ñ Ð½ÐµÐºÐ¾ÑоÑÑÑ Ð²ÐµÑеÑÑв, оÑноÑÑÑÐ¸Ñ ÑÑ Ðº бинаÑнÑм ÑоединениÑм.
Ðммиак[ | ]
Ð Ñ Ð¸Ð¼Ð¸ÑеÑкой пÑомÑÑленноÑÑи аммиак иÑполÑзÑеÑÑÑ Ð² каÑеÑÑве пÑекÑÑÑоÑа Ð´Ð»Ñ Ð¿Ð¾Ð»ÑÑÐµÐ½Ð¸Ñ Ð°Ð·Ð¾Ñной киÑлоÑÑ Ð¸ Ð´Ð»Ñ Ð¿ÑоизводÑÑва Ñ Ð¸Ð¼Ð¸ÑеÑÐºÐ¸Ñ ÑдобÑений. ÐÑоме Ñого, аммиак иÑполÑзÑеÑÑÑ Ð² болÑÑом колиÑеÑÑве ÑазнообÑазнÑÑ Ñ Ð¸Ð¼Ð¸ÑеÑÐºÐ¸Ñ ÑинÑезов, в Ñом ÑиÑле в Ñонком оÑганиÑеÑком ÑинÑезе. Ржидком аммиаке Ñ Ð¸Ð¼Ð¸ÑеÑки ÑаÑÑвоÑÑÑÑÑÑ Ð¼Ð½Ð¾Ð³Ð¸Ðµ веÑеÑÑва, напÑимеÑ, калий, наÑÑий, ÑеÑа. Ðммиак пÑименÑлÑÑ Ð² каÑеÑÑве Ñ Ð»Ð°Ð´Ð°Ð³ÐµÐ½Ñа в пеÑвÑÑ Ñ Ð¾Ð»Ð¾Ð´Ð¸Ð»ÑÐ½Ð¸ÐºÐ°Ñ , и до недавнего вÑемени пÑевалиÑовал в пÑомÑÑленнÑÑ Ñ Ð¾Ð»Ð¾Ð´Ð¸Ð»ÑнÑÑ ÑÑÑÐ°Ð½Ð¾Ð²ÐºÐ°Ñ .
ÐекÑаÑÑоÑид ÑÑана[ | ]
ÐеÑÑÑий гекÑаÑÑоÑид ÑÑана UF6 пÑименÑеÑÑÑ Ð´Ð»Ñ ÑÐ°Ð·Ð´ÐµÐ»ÐµÐ½Ð¸Ñ Ð¸Ð·Ð¾Ñопов ÑÑана в пÑоÑеÑÑе его обогаÑениÑ, а Ñакже как ÑÑоÑиÑÑÑÑий агенÑ.
ÐаÑбид волÑÑÑама[ | ]
ÐаÑбид волÑÑÑама в ÑÐ¸Ð»Ñ Ñвоей иÑклÑÑиÑелÑной ÑвеÑдоÑÑи Ð½Ð°Ñ Ð¾Ð´Ð¸Ñ Ð¾ÑÐµÐ½Ñ ÑиÑокое пÑименение в пÑоизводÑÑве ÑазнообÑазного ÑежÑÑего инÑÑÑÑменÑа, а в ÑÐ¸Ð»Ñ Ñвоей Ñ Ð¸Ð¼Ð¸ÑеÑкой инеÑÑноÑÑи â в пÑоизводÑÑве обоÑÑÐ´Ð¾Ð²Ð°Ð½Ð¸Ñ Ð´Ð»Ñ ÑабоÑÑ Ð² агÑеÑÑивнÑÑ ÑÑÐµÐ´Ð°Ñ (пеÑи, ножи, лабоÑаÑоÑное обоÑÑдование).
ÐкÑид диазоÑа[ | ]
«ÐеÑелÑÑий газ» N2O в ÑмеÑÑÑ Ñ ÐºÐ¸ÑлоÑодом пÑименÑеÑÑÑ Ð² медиÑине как Ð°Ð³ÐµÐ½Ñ Ð´Ð»Ñ Ð¸Ð½Ð³Ð°Ð»ÑÑионного обÑего наÑкоза.
ХлоÑоводоÑод[ | ]
ÐоднÑй ÑаÑÑÐ²Ð¾Ñ Ñ Ð»Ð¾ÑоводоÑода (ÑолÑÐ½Ð°Ñ ÐºÐ¸ÑлоÑа) ÑиÑоко иÑполÑзÑеÑÑÑ Ð´Ð»Ñ Ð¿Ð¾Ð»ÑÑÐµÐ½Ð¸Ñ Ñ Ð»Ð¾Ñидов, Ð´Ð»Ñ ÑÑÐ°Ð²Ð»ÐµÐ½Ð¸Ñ Ð¼ÐµÑаллов, оÑиÑÑки повеÑÑ Ð½Ð¾ÑÑи ÑоÑÑдов, Ñкважин Ð¾Ñ ÐºÐ°ÑбонаÑов, обÑабоÑки ÑÑд, пÑи пÑоизводÑÑве каÑÑÑков, глÑÑамаÑа наÑÑиÑ, ÑодÑ, Ñ Ð»Ð¾Ñа и дÑÑÐ³Ð¸Ñ Ð¿ÑодÑкÑов. Также пÑименÑеÑÑÑ Ð² оÑганиÑеÑком ÑинÑезе.
ÐÑимеÑаниÑ[ | ]
ÐиÑеÑаÑÑÑа[ | ]
ÐндÑеева Ð. Ð., Ðидин Ð . Ð., ÐолоÑко Ð. Ð. ХимиÑеÑкие ÑвойÑÑва неоÑганиÑеÑÐºÐ¸Ñ Ð²ÐµÑеÑÑв. УÑебное поÑобие Ð´Ð»Ñ Ð²Ñзов. â Ð.: ХимиÑ, 1996.
Источник
