Какие свойства проявляют аминокислоты свойства кислот

Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
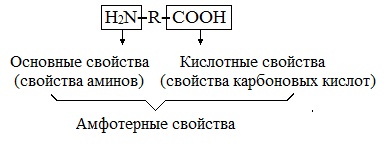
Кислотно-основное равновесие в водных растворах
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
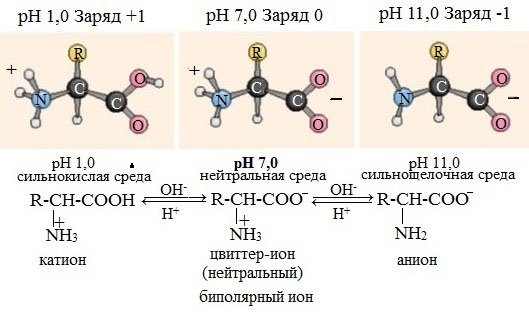
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
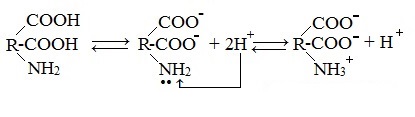
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
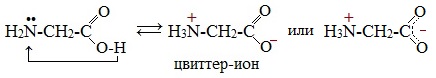
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН<7 (кислая среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток ионов водорода Н+.
в) диаминомонокарбоновые кислоты (основные аминокислоты)
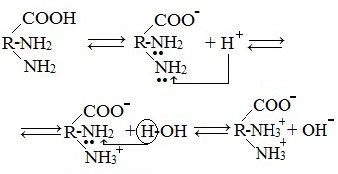
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН— .
2. Взаимодействие с основаниями и кислотами
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
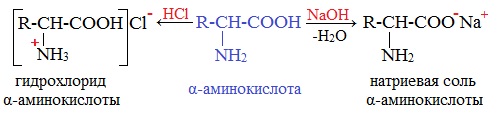
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
Образуются соли:
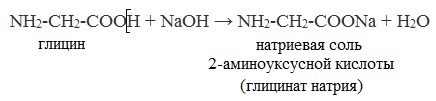
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
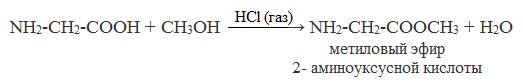
в) взаимодействие с аммиаком
Образуются амиды:
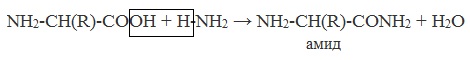
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
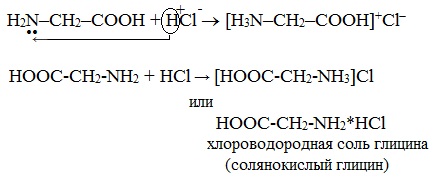
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
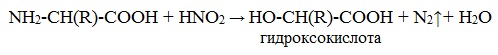
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.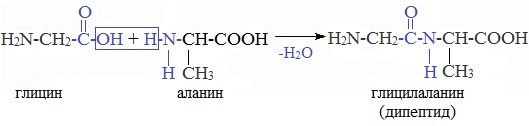
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
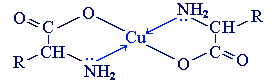
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Аминокислоты
Источник
Аминокислоты относятся к гетерофункциональным соединениям, т.е. вещества, проявляющим свойства двух классов соединений. В неорганической химии такие соединения называют амфотерными.
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений.
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной. $alpha$-аминокислоты являются амфотерными электролитами. Имея как минимум две диссоциирующие и противоположно заряженные группировки, аминокислоты в растворах с нейтральным значением рН практически всегда находятся в виде биполярных ионов, или цвиттер-ионов, в которых противоположные заряды пространственно разделены, например $H_3^+N—CH_2—CH_2—COO^-$.
Именно амфотерность аминокислот обуславливает их наиболее характерные свойства.
1. Кислотные свойства аминокислот проявляются по карбоксильной группе в их способности взаимодействовать, например, с щелочами:

или вступать в реакцию этерификации со спиртами с образованием сложных эфиров:

2. Основные свойства аминокислот проявляются по аминогруппе в их способности взаимодействовать с кислотами, образуя комплексные ионы по донорно-акцепторному механизму:

3. Амфотерность аминокислот проявляется также в их способности образовывать в растворе в результате диссоциации биполярный ион — внутреннюю соль, а самое главное, за счет амфотерности аминокислоты могут вступать друг с другом в реакции поликонденсации. образуя полипептиды и белки:

КАЧЕСТВЕННЫЕ (ЦВЕТНЫЕ) РЕАКЦИИ НА АМИНОКИСЛОТЫ И БЕЛКИ
Качественные цветные реакции можно подразделить на два типа: универсальные и специфические. К универсальным реакциям относятся те, которые дают окрашивание в присутствии любых белков.

Специфические реакции доказывают наличие какой-то определенной аминокислоты. Все качественные реакции можно наблюдать на примере раствора яичного белка, представляющего собой многокомпонентную смесь аминокислот:

УНИВЕРСАЛЬНЫЕ ЦВЕТНЫЕ РЕАКЦИИ
1. Биуретовая реакция – универсальная реакция на все белки и пептиды, так как является реакцией на пептидную связь. Представляет собой взаимодействие щелочного раствора биурета ($(H_2NC(O))_2NH$ с раствором сульфата меди в присутствии гидроксида натрия (реактив Фелинга).

В реакцию, подобную биуретовой, вступают многие вещества, содержащие в молекуле не менее двух амидных группировок, амиды и имиды аминокислот и некоторые другие соединения. Продукты реакции в этом случае имеют фиолетовую или синюю окраску.


В условиях биуретовой реакции белки дают фиолетовую окраску, что используется для их качественного и количественного анализа. Биуретовая реакция обусловлена присутствием в белках пептидных связей, которые в щелочной среде образуют с сульфатом меди (ІІ) окрашенные солеобразные комплексы меди.
2. Нингидриновая реакция – цветная реакция на α-аминокислоты, которую осуществляют нагреванием последних в избытке щелочного раствора нингидрина (гидрата 1,2,3-индантриона).


Образующееся в результате реакции соединение (дикетогидринимин – на рисунке самый левый продукт реакции) имеет фиолетово-синюю окраску. Данную используют для колориметрического количественного определения $alpha$-аминокислот, в том числе в автоматических аминокислотных анализаторах.
СПЕЦИФИЧЕСКИЕ ЦВЕТНЫЕ РЕАКЦИИ
1. Реакция Щульца-Распайли (аналогично проводится реакция Адамкевича, только с добавлением глиоксиловой кислоты) – является специфической реакцией на аминокислоту триптофан – взаимодействие раствора яичного белка с 10% раствором сахарозы и равным объемом концентрированной $H_2SO_4$. На границе двух жидкостей образуется красно-фиолетовое кольцо (при нагревании на водяной бане реакция идет быстрее – главное не смешивать жидкости).


2. Реакция Милона – используется для обнаружения тирозина, в составе которого имеется фенольный гидроксил. При добавлении к раствору белка реактива Милона (раствор $HgNO_3$ и $Hg(NO_3)_2$ в разбавленной азотной кислоты $HNO_3$, содержащей примесь азотистой кислоты $HNO_2$) образуется осадок, сначала окрашенный в розовый, а затем в пурпурно-красный цвет. Нагревание до $50^circ C$ ускоряет эту реакцию.


3. Ксантопротеиновая реакция – является специфической реакцией и используется для обнаружения $alpha$-аминокислот, содержащих в радикале ароматический цикл, например фенилаланина. Для ее осуществления к раствору белка прибавляют концентрированную азотную кислоту $HNO_3$ до тех пор, пока не прекратится образование осадка, который при нагревании окрашивается в желтый цвет. Окраска возникает в результате нитрования ароматических колец аминокислотных остатков белка (тирозина и триптофана). При добавлении к охлажденной жидкости избытка щелочи появляется оранжевое окрашивание, обусловленное образованием солей нитроновых кислот.



4. Реакция Фоля на серосодержащие аминокислоты (цистеин, метионин) – взаимодействие раствора яичного белка с 30% раствором NaOH и 5% раствором уксуснокислого свинца – $Pb(CH_3COO)_2$. При длительном нагревании жидкость буреет, выпадает черный осадок сульфида свинца.


Источник
Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы –NH2.
Природные аминокислоты можно разделить на следующие основные группы:
| 1) Алифатические предельные аминокислоты (глицин, аланин) | NH2-CH2-COOH глицин NH2-CH(CH3)-COOH аланин |
| 2) Серосодержащие аминокислоты (цистеин) |  цистеин |
| 3) Аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2OH)-COOH серин |
| 4) Ароматические аминокислоты (фенилаланин, тирозин) |  фенилаланин
тирозин |
| 5) Аминокислоты с двумя карбоксильными группами (глутаминовая кислота) | HOOC-CH(NH2)-CH2-CH2-COOH глутаминовая кислота |
| 6) Аминокислоты с двумя аминогруппами (лизин) | CH2(NH2)-CH2-CH2-CH2-CH(NH2)-COOH лизин |
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
- Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:

- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):

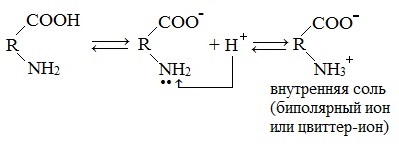
При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
![]()
1. Кислотно-основные свойства аминокислот
Аминокислоты — это амфотерные соединения.
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп.
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:

1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с основаниями:

2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
Например, глицин взаимодействует с азотистой кислотой:
![]()
3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
![]()
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
Например, глицин взаимодействует с этиловым спиртом:
![]()
5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
Например, глицин взаимодействует с гидроксидом бария при нагревании:
![]()
Например, глицин разлагается при нагревании:
![]()
6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Например, глицин реагирует с аланином с образованием дипептида (глицилаланин):

Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Источник
Амины
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н+.
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H+.
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
Получение аминов:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Получение анилина
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
C6H5-NO2 + 3Fe + 7HCl = [C6H5-NH3]+Cl- + 3FeCl2 + 2H2O
2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
[C6H5-NH3]+Cl— + NaOH = C6H5-NH2 + NaCl + H2O
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
С6H5−Cl + 2NH3 → C6H5NH2 + NH4Cl
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.

