Какие свойства проявляет высший гидроксид хрома

Низший оксид для элементов 6-й группы состава MeO получен только для хрома.
Физические свойства CrO(II):
- тугоплавкий порошок черного цвета;
- нерастворим в воде;
- устойчив на воздухе.
Химические свойства CrO(II):
- типичный основной оксид;
- реагирует с кислотами:
CrO+2HCl = CrCl2+H2O; - является сильным восстановителем;
- воспламеняется при нагревании или растирании на воздухе, сгорая до Cr2O3;
- при высокой температуре (1000°C) “забирает” кислород у углекислого газа:
- 2CrO+CO2 → Cr2O3+CO;
- в инертной атмосфере нагревание CrO (700°C) приводит к диспропорционированию:
3CrO → Cr2O3+Cr - CrO(II) получают путем воздействия на амальгаму хрома кислородом воздуха:
2Cr+O2 = 2CrO
Гидроксид хрома Cr(OH)2(II)
Физические свойства Cr(OH)2(II):
- вещество коричнево-желтого цвета;
- нерастворим в воде;
- быстро окисляется на воздухе.
Химические свойства Cr(OH)2(II):
- проявляет оснОвные свойства;
- реагирует с кислотами:
Cr(OH)2+H2SO4 = CrSO4+2H2O - Cr(OH)2(II) получают, как продукт реакции солей хрома с щелочью в отсутствии кислорода:
CrCl2+2NaOH = Cr(OH)2↓+2NaCl
Соединения хрома со степенью окисления +2 являются неустойчивыми, легко окисляются кислородом воздуха в более устойчивые соединения хрома со степенью окисления +3:
4Cr(OH)2+O2+2H2O = 4Cr(OH)3
Оксид хрома Cr2O3(III) – хромовая охра
Cr2O3 в мелкоизмельченном состоянии применяют в качестве абразивного материала (паста ГОИ), зеленого пигмента, катализатора в органическом синтезе. Оксид хрома (III) является основной добавкой к корунду при выращивании искусственных рубинов, используемых в ювелирной промышленности и часовом деле, а также в качестве лазерного материала в оптоэлектронике.
Физические свойства Cr2O3(III):
- тугоплавкий порошок серо-зеленого цвета, имеющий структуру корунда (α-Al2O3);
- нерастворим в воде;
- обладает высокой твердостью;
- меняет свой цвет от светло-зеленого до черного в зависимости от размеров кристаллов;
- при н.у. является полупроводником;
- при нагревании порошок приобретает коричневый цвет, при охлаждении зеленая окраска возвращается;
- Cr2O3 с корундом образует твердые растворы, в которых катионы хрома и алюминия заполняют пустоты анионной решетки, такие твердые растворы с содержанием Cr2O3 до 10% имеют красный цвет, и в природе известны под названием рубин, который является драгоценным камнем-минералом. Твердые растворы в которых содержание оксида хрома превышает 10%, имеют зеленый цвет (окраска твердого раствора зависит от расстояния связи металл-кислород).
Химические свойства Cr2O3(III):
- Cr2O3 амфотерный оксид – самое устойчивое соединение хрома;
- при н.у. плохо растворим в кислотах и щелочах;
- при сплавлении с щелочами (карбонатами щелочных металлов) образует метахромиты:
Cr2O3+2KOH = 2KCrO2+H2O
Cr2O3+Na2CO3 = 2NaCrO2+CO2↑ - с кислотами образует соли:
Cr2O3+6HCl = 2CrCl3+3H2O - с щелочами образует комплексные соединения хрома:
Cr2O3+6KOH+3H2O = 2K2[Cr(OH)6] - в промышленности Cr2O3 получают восстановлением дихромата калия серой или коксом:
K2Cr2O7+S = Cr2O3+K2SO4 - Cr2O3 также можно получить разложением дихромата аммония или прокаливанием гидроксида хрома:
(NH4)Cr2O7 = Cr2O3+N2+4H2O
2Cr(OH)3 = Cr2O3+3H2O
Гидроксид хрома Cr(OH)3(III)
Физические свойства Cr(OH)3(III):
- амфотерный малоустойчивый гидроксид различной окраски (голубой, фиолетовой, зеленой), которая зависит от условий получения;
- имеет различную химическую активность;
- плохо растворим в воде.
Химические свойства Cr(OH)3(III):
- реагирует с кислотами с образованием солей:
Cr(OH)3+3H2SO4 = Cr2(SO4)3+6H2O - реагирует с щелочами с образованием комплексных соединений хрома:
Cr(OH)3+NaOH = Na[Cr(OH)4] - осаждается при действии щелочей на соли хрома:
Cr(OH)3+3NaOH = Cr(OH)3↓+3NaCl - выпавший в осадок гидрооксид хрома растворим в кислотах:
Cr(OH)3+3HCl = CrCl3+3H2O - и в избытке щелочей:
Cr(OH)3+3NaOH = Na3[Cr(OH)6]
Оксид хрома CrO2(IV) (диоксид хрома)
Диоксид хрома применяется в производстве элементов памяти для компьютеров.
- все диоксиды элементов 6-й группы (Cr, Mo, W) имеют структуру рутила;
- не реагируют с водой и щелочами;
- диоксид хрома имеет черную окраску, обладает металлической проводимостью, является ферромагнетиком;
- диоксиды, как промежуточный прдукт реакции, получают при разложении или восстановлении высших оксидов (VI) соответствующих металлов, при темературах 250°(Cr), 450°C(Mo), 600°C(W):
3(NH4)Cr2O7 → 6CrO2+2N2+9H2O+2NH3
MoO3+H2 → MoO2+H2O
WO3+H2 → WO2+H2O - диоксид хрома получают нагреванием Cr2O3 в кислороде при 300°C и высоком давлении;
- устойчивость диоксида возрастает в ряду от хрома к вольфраму.
Оксид хрома CrO3(VI) (хромовый ангидрид)
Физические свойства CrO3(VI):
- кристаллы красно-фиолетового цвета;
- разлагаются при комнатной температуре;
- расплывается на воздухе по причине высокой гигроскопичности;
- хорошо растворим в воде.
Химические свойства CrO3(VI):
- CrO3(VI) является кислотным оксидом;
- растворяясь в воде, образует хромовые кислоты:
- хромовая кислота: CrO3+H2O(изб) = H2CrO4
- дихромовая кислота: 2CrO3+H2O(нед) = H2Cr2O7
- реагирует с основаниями:
CrO3+2KOH = K2CrO4+H2O - CrO3 окисляет углерод, серу, фосфор, йод, образуя оксид хрома (III):
4CrO3+3S = 3SO2+2Cr2O3 - нагретый до температуры выше 250°C, триоксид хрома разлагается на молекулярный кислород и оксид хрома (III):
4CrO3 = 2Cr2O3+3O2
Триоксид хрома получают действием концентрированной серной кислоты на концентрированные растворы хроматов/дихроматов калия/натрия:
K2Cr2O7+H2SO4 = 2CrO3↓+K2SO4+H2O
Гидроксиды хрома
К гидроксидам хрома относятся две кислоты – хромовая и дихромовая, существующие только в водных растворах, но образующие очень устойчивые соли – хроматы и дихроматы соответственно. Хроматы окрашивают раствор в желтый цвет; дихроматы – в оранжевый.
Кислоты образуются в результате взаимодействия с водой триоксида хрома – если вода присутствует в избытке, образуется хромовая кислота, если в недостатке – дихромовая:
CrO3+H2O(изб) = H2CrO4
2CrO3+H2O(нед) = H2Cr2O7
Примечательно, что хромат-ионы и дихромат-ионы при изменении среды растворов без проблем переходят друг в друга, меняя при этом окраску раствора:
- в кислой среде хроматы переходят в дихроматы, меняя желтый цвет раствора на оранжевый:
2CrO42-+2H+ ↔ Cr2O72-+H2O
2K2CrO4+H2SO4 ↔ K2Cr2O7+K2SO4+H2O - в щелочной среде все происходит наоборот – дихроматы переходят в хроматы, а оранжевый цвет раствора меняется на желтый:
Cr2O72-+2OH- ↔ 2CrO42-+H2O
K2Cr2O7+2KOH = 2K2CrO4+H2O
Хроматы получают сплавлением хромистого железняка или оксида хрома (III) с карбонатами в присутствии кислорода (t=1000°C):
4Fe(CrO2)2+8Na2CO3+7O2 = 8Na2CrO4+2Fe2O3+8CO2
Дихроматы получают из растворов хроматов, подкисляя их.
Источник
Цель: углубить знания учащихся по теме занятия.
Задачи:
- дать характеристику хрома как простого вещества;
- познакомить учащихся с соединениями хрома разной степени окисления;
- показать зависимость свойств соединений от степени окисления;
- показать окислительно – восстановительные свойства соединений хрома;
- продолжить формирование умений учащихся записывать уравнения химических
реакций в молекулярном и ионном виде, составлять электронный баланс; - продолжить формирование умений наблюдать химический эксперимент.
Форма занятия: лекция с элементами самостоятельной работы учащихся и
наблюдением за химическим экспериментом.
Ход занятия
I. Повторение материала предыдущего занятия.
1. Ответить на вопросы и выполнить задания:
– Какие элементы относятся к подгруппе хрома?
– Написать электронные формулы атомов
– К какому типу элементов относятся?
– Какие степени окисления проявляют в соединениях?
– Как изменяется радиус атомов и энергия ионизации от хрома к вольфраму?
Можно предложить заполнить учащимся заполнить таблицу, используя табличные
величины радиусов атомов, энергии ионизации и сделать выводы.
Образец таблицы:
| Элемент | Электронные формулы | Радиус атома нм | Энергия ионизации эВ | Степень окисления |
| хром | …3s23p63d54s1 | 0,125 | 6,76 | +2,+3,+6 |
| молибден | …4s24p64d55s1 | 0,136 | 7,10 | +3,+4,+5,+6 |
| вольфрам | …5s25p65d46s2 | 0,140 | 7,98 | +3,+4,+5,+6 |
2. Заслушать сообщение учащегося по теме «Элементы подгруппы хрома в природе,
получение и применение».
II. Лекция.
План лекции:
- Хром.
- Соединения хрома. (2)
- Оксид хрома; (2)
- Гидроксид хрома. (2)
- Соединения хрома. (3)
- Оксид хрома; (3)
- Гидроксид хрома. (3)
- Соединения хрома (6)
- Оксид хрома; (6)
- Хромовая и дихромовая кислоты.
- Зависимость свойств соединений хрома от степени окисления.
- Окислительно – восстановительные свойства соединений хрома.
1. Хром.
Хром – это белый с голубоватым отливом блестящий металл, очень твердый
(плотность 7, 2 г/см3), температура плавления 1890˚С.
Химические свойства: хром при обычных условиях неактивный металл. Это
объясняется тем, что его поверхность покрыта оксидной пленкой (Сr2О3). При
нагревании оксидная пленка разрушается, и хром реагирует с простыми веществами
при высокой температуре:
- 4Сr +3О2 = 2Сr2О3
- 2Сr + 3S = Сr2S3
- 2Сr + 3Cl2 = 2СrСl3
Задание: составить уравнения реакций хрома с азотом, фосфором, углеродом и
кремнием; к одному из уравнений составить электронный баланс, указать окислитель
и восстановитель.
Взаимодействие хрома со сложными веществами:
При очень высокой температуре хром реагирует с водой:
- 2Сr + 3 Н2О = Сr2О3 + 3Н2↑
Задание: составить электронный баланс, указать окислитель и восстановитель.
Хром реагирует с разбавленной серной и соляной кислотами:
- Сr + Н2SО4 = СrSО4 + Н2↑
- Сr + 2НСl= СrСl2 + Н2↑
Задание: составить электронный баланс, указать окислитель и восстановитель.
Концентрированные серная соляная и азотная кислоты пассивируют хром.
2. Соединения хрома. (2)
1. Оксид хрома (2) – СrО – твердое ярко – красное вещество, типичный основной
оксид (ему соответствует гидроксид хрома (2) – Сr(ОН)2), не растворяется в воде,
но растворяется в кислотах:
- СrО + 2НСl = СrСl2 + Н2О
Задание: составить уравнение реакции в молекулярном и ионном виде
взаимодействия оксида хрома (2) с серной кислотой.
Оксид хрома (2) легко окисляется на воздухе:
- 4СrО+ О2 = 2Сr2О3
Задание: составить электронный баланс, указать окислитель и восстановитель.
Оксид хрома (2) образуется при окислении амальгамы хрома кислородом воздуха:
2Сr (амальгама) + О2 = 2СrО
2. Гидроксид хрома (2) – Сr(ОН)2 – вещество желтого цвета, плохо растворимо в
воде, с ярко выраженным основным характером, поэтому взаимодействует с
кислотами:
- Сr(ОН)2 + Н2SО4 = СrSO4 + 2Н2О
Задание: составить уравнения реакций в молекулярном и ионном виде
взаимодействия оксида хрома (2) с соляной кислотой.
Как и оксид хрома (2), гидроксид хрома (2) окисляется:
- 4 Сr(ОH)2 + О2 + 2Н2О = 4Сr(ОН)3
Задание: составить электронный баланс, указать окислитель и восстановитель.
Получить гидроксид хрома (2) можно при действии щелочей на соли хрома (2):
- CrCl2 + 2KOH = Cr(OH)2↓ + 2KCl
Задание: составить ионные уравнения.
3. Соединения хрома. (3)
1. Оксид хрома (3) – Сr2О3 – порошок темно – зеленого цвета, нерастворим в воде,
тугоплавкий, по твёрдости близок к корунду (ему соответствует гидроксид хрома
(3) – Сr(ОН)3). Оксид хрома (3) имеет амфотерный характер, однако в кислотах и
щелочах растворяется плохо. Реакции со щелочами идут при сплавлении:
- Сr2О3 + 2КОН = 2КСrО2(хромит К) + Н2О
Задание: составить уравнение реакции в молекулярном и ионном виде
взаимодействия оксида хрома (3) с гидроксидом лития.
С концентрированными растворами кислот и щелочей взаимодействует с трудом:
- Сr2О3 + 6 КОН + 3Н2О = 2К3[Сr(ОН)6]
- Сr2О3 + 6НСl = 2СrСl3 + 3Н2О
Задание: составить уравнения реакций в молекулярном и ионном виде
взаимодействия оксида хрома (3) с конценрированной серной кислотой и
концентрированным раствором гидроксида натрия.
Оксид хрома (3) может быть получен при разложении дихромата аммония:
- (NН4)2Сr2О7 = N2 + Сr2О3 +4Н2О
2. Гидроксид хрома (3) Сr(ОН)3 получают при действии щелочей на на растворы
солей хрома (3):
- СrСl3 +3КОН = Сr(ОН)3↓ + 3КСl
Задание: составить ионные уравнения
Гидроксид хрома (3) представляет собой осадок серо – зеленого цвета, при
получении которого, щелочь надо брать в недостатке. Полученный таким образом
гидроксид хрома (3), в отличие от соответствующего оксида легко взаимодействует
с кислотами и щелочами, т.е. проявляет амфотерные свойства:
- Сr(ОН)3 + 3НNО3 = Сr(NО3)3 + 3Н2О
- Сr(ОН)3 + 3КОН = К3[Сr(ОН)6](гексагидроксохромит К)
Задание: составить уравнения реакций в молекулярном и ионном виде
взаимодействия гидроксида хрома (3) с соляной кислотой и гидроксидом натрия.
При сплавлении Сr(ОН)3 со щелочами получаются метахромиты и ортохромиты:
- Cr(OH)3 + KOH = KCrO2(метахромит К) + 2H2O
- Cr(OH)3 + KOH = K3CrO3(ортохромит К)+ 3H2O
4. Соединения хрома. (6)
1. Оксид хрома (6) – СrО3 – темно – красное кристаллическое вещество, хорошо
растворимо в воде – типичный кислотный оксид. Этому оксиду соответствует две
кислоты:
- СrО3 + Н2О = Н2СrО4(хромовая кислота – образуется при избытке воды)
- СrО3 + Н2О =Н2Сr2О7(дихромовая кислота – образуется при большой концентрации
оксида хрома (3)).
Оксид хрома (6) – очень сильный окислитель, поэтому энергично взаимодействует
с органическими веществами:
- С2Н5ОН + 4СrО3 = 2СО2 + 2Сr2О3 + 3Н2О
Окисляет также иод, серу, фосфор, уголь:
- 3S + 4CrO3 = 3SO2 + 2Cr2O3
Задание: составить уравнения химических реакций оксида хрома (6) с йодом,
фосфором, углем; к одному из уравнений составить электронный баланс, указать
окислитель и восстановитель
При нагревании до 2500С оксид хрома (6) разлагается:
- 4CrO3 = 2Cr2O3 + 3O2
Оксид хрома (6) можно получить при действии концентрированной серной кислоты
на твердые хроматы и дихроматы:
- К2Сr2О7 + Н2SО4 = К2SО4 + 2СrО3 + Н2О
2. Хромовая и дихромовая кислоты.
Хромовая и дихромовая кислоты существуют только в водных растворах, образуют
устойчивые соли, соответственно хроматы и дихроматы. Хроматы и их растворы имеют
желтую окраску, дихроматы – оранжевую.
Хромат – ионы СrО42- и дихромат – ионы Сr2О72- легко переходят друг в друга
при изменении среды растворов
В кислой среде раствора хроматы переходят в дихроматы:
- 2К2СrО4 + Н2SО4 = К2Сr2О7 + К2SО4 + Н2О
В щелочной среде дихроматы переходят в хроматы:
- К2Сr2О7 + 2КОН = 2К2СrО4 + Н2О
При разбавлении дихромовая кислота переходит в хромовую кислоту:
- H2Cr2O7 + H2O = 2H2CrO4
5. Зависимость свойств соединений хрома от степени окисления.
| Степень окисления | +2 | +3 | +6 |
| Оксид | СrО | Сr2О3 | СrО3 |
| Характер оксида | основной | амфотерный | кислотный |
| Гидроксид | Сr(ОН)2 | Сr(ОН)3 – Н3СrО3 | Н2СrО4 Н2Сr2О7 |
| Характер гидроксида | основной | амфотерный | кислотный |
→ ослабление основных свойств и усиление | |||
6. Окислительно – восстановительные свойства соединений хрома.
Реакции в кислотной среде.
В кислотной среде соединения Сr+6 переходят в соединения Сr+3 под действием
восстановителей: H2S, SO2, FeSO4
- К2Сr2О7 +3Н2S +4Н2SО4 = 3S + Сr2(SО4)3 + K2SO4+ 7Н2О
- S-2 – 2e → S0
- 2Cr+6 + 6e → 2Cr+3
Задание:
1. Уравнять уравнение реакции методом электронного баланса, указать окислитель и
восстановитель:
- Na2CrO4 + K2S + H2SO4 = S + Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O
2. Дописать продукты реакции, уравнять уравнение методом электронного баланса,
указать окислитель и восстановитель:
- K2Cr2O7 + SO2 + H2SO4 = ? +? +Н2О
Реакции в щелочной среде.
В щелочной среде соединения хрома Сr+3 переходят в соединения Сr+6 под
действием окислителей: J2, Br2, Cl2, Ag2O, KClO3, H2O2, KMnO4:
- 2KCrO2 +3 Br2 +8NaOH =2Na2CrO4 + 2KBr +4NaBr + 4H2O
- Cr+3 – 3e → Cr+6
- Br20 +2e → 2Br-
Задание:
Уравнять уравнение реакции методом электронного баланса, указать окислитель и
восстановитель:
- NaCrO2 + J2 + NaOH = Na2CrO4 + NaJ + H2O
Дописать продукты реакции, уравнять уравнение методом электронного баланса,
указать окислитель и восстановитель:
- Cr(OH)3 + Ag2O + NaOH = Ag + ? + ?
Таким образом, окислительные свойства последовательно усиливаются с
изменением степеней окисления в ряду: Cr+2→ Сr+3 → Сr+6. Соединения хрома (2) –
сильные восстановители, легко окисляются, превращаясь в соединения хрома (3).
Соединения хрома (6) – сильные окислители, легко восстанавливаются в соединения
хрома (3). Соединения хрома (3) при взаимодействии с сильными восстановителями
проявляют окислительные свойства, переходя в соединения хрома (2), а при
взаимодействии с сильными окислителями проявляют восстановительные свойства,
превращаясь в соединеня хрома (6)
К методике проведения лекции:
- Для активизации познавательной деятельности учащихся и поддержания интереса,
целесообразно в ходе лекции проводить демонстрационный эксперимент. В
зависимости от возможностей учебной лаборатории можно демонстрировать учащимся
следующие опыты:
- получении оксида хрома (2) и гидроксида хрома (2), доказательство их
основных свойств; - получение оксида хрома (3) и гидроксида хрома (3), доказательство их
амфотерных свойств; - получение оксида хрома (6) и растворение его в воде (получение хромовой и
дихромовой кислот); - переход хроматов в дихроматы, дихроматов в хроматы.
- Задания самостоятельной работы можно дифференцировать с учетом реальных
учебных возможностей учащихся. - Завершить лекцию можно выполнением следующих заданий: напишите уравнения
химических реакций с помощью которых можно осуществить следующие превращения:
- Cr→ CrCl2→ Cr(OH)2→ Cr(OH)3→ Cr(NO3)3→ Cr2O3→ Cr
- Cr →Cr(NO3)3→ Cr(OH)3→ K3[Cr(OH)6]→ Cr(OH)3→ CrCl3
- Cr2(SO4)3→ Cr(OH)3→ CrCl3
.III. Домашнее задание: доработать лекцию (дописать уравнения химических
реакций)
Перечень рекомендуемой литературы:
- Васильева З.Г. Лабораторные работы по общей и неорганической химии. -М.:
«Химия», 1979 – 450 с. - Егоров А.С. Репетитор по химии. – Ростов-на-Дону: «Феникс», 2006.-765 с.
- Кудрявцев А.А. Составление химических уравнений. – М., «Высшая школа»,
1979. – 295 с. - Петров М.М. Неорганическая химия. – Ленинград: «Химия», 1989. – 543 с.
- Ушкалова В.Н. Химия: конкурсные задания и ответы. – М.: «Просвещение»,
2000. – 223 с.
Источник
Хром
Твердый металл голубовато-белого цвета. Этимология слова “хром” берет начало от греч. χρῶμα — цвет, что связано с большим
разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 – амфотерные,
+6 – кислотные.

В природе хром встречается в виде следующих соединений.
- Fe(CrO2)2 – хромистый железняк, хромит
- (Mg, Fe)Cr2O4 – магнохромит
- (Fe, Mg)(Cr, Al)2O4 – алюмохромит

Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из
его оксида.
Fe(CrO2)2 + C = Fe + Cr + CO
Cr2O3 + Al = Al2O3 + Cr
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома III – Cr2O3 –
происходит пассивирование. Реагирует с неметаллами при нагревании.
Cr + O2 = (t) Cr2O3
Cr + S = (t) Cr2S3
Cr + N2 = (t) CrN
Cr + C = Cr2C3

Протекает в раскаленном состоянии.
Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑

Cr + H2SO4(разб.) = CrSO4 + H2↑
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Cr + CuSO4 = CrSO4 + Cu
Соединения хрома II
Соединение хрома II носят основный характер. Оксид хрома II окисляется кислородом воздуха до более устойчивой формы – оксида хрома III,
реагирует с кислотами, кислотными оксидами.

CrO + O2 = Cr2O3
CrO + H2SO4 = CrSO4 + H2O
CrO + SO3 = CrSO4
Гидроксид хрома II, как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами,
кислотными оксидами.

Cr(OH)2 = (t) CrO + H2O
Cr(OH)2 + HCl = CrCl2 + H2O
Cr(OH)2 + SO3 = CrSO4 + H2O
Соединения хрома III
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома III гидроксид хрома III.

Оксид хрома III реагирует как с растворами щелочей, образуя комплексные соли, так и с кислотами.
Cr2O3 + Ba(OH)2 = Ba(CrO2)2 + H2O (прокаливание, хромит бария)
Cr2O3 + NaOH + H2O = Na3[Cr(OH)6] (нет прокаливания – в водном растворе, гексагидроксохромат натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления)

Оксид хрома III реагирует с более активными металлами (например, при алюминотермии).
Cr2O3 + Al = Al2O3 + Cr
При окислении соединение хрома III получают соединения хрома VI (в щелочной среде).
K3[Cr(OH)6] + H2O2 = K2CrO4 + KOH + H2O
Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
Соединения хрома VI
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома VI – CrO3, и две кислоты, находящиеся в
растворе в состоянии равновесия: хромовая – H2CrO4 и дихромовая кислоты – H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают
раствор в желтый цвет, а дихроматы – в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый – образуется хромат.
Na2Cr2O7 + NaOH = Na2CrO4 + H2O
Разложение дихромата аммония выглядит очень эффектно и носит название “вулканчик” 🙂
(NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O
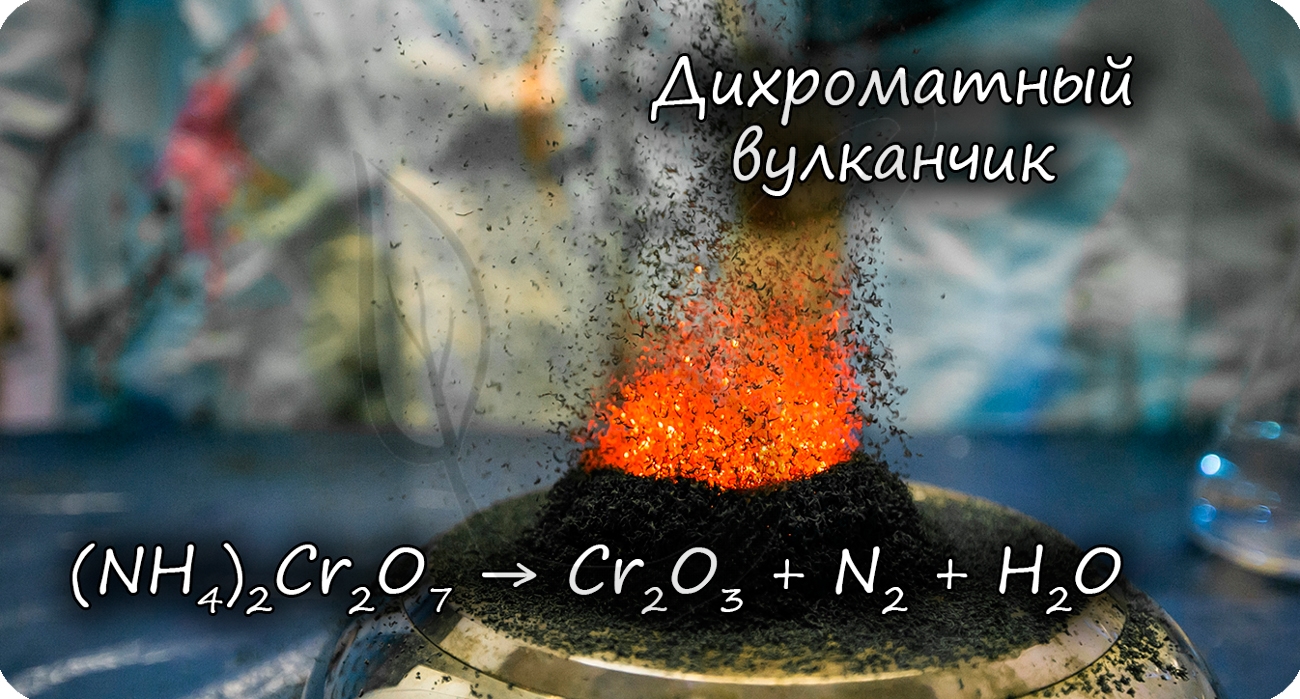
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
K2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.

Для железа характерны две основные степени окисления +2, +3, +6.

В природе железо встречается в виде следующих соединений:
- Fe2O3 – красный железняк, гематит
- Fe3O4 – магнитный железняк, магнетит
- Fe2O3*H2O – бурый железняк, лимонит
- FeS2 – пирит, серый или железный колчедан
- FeCO3 – сидерит

Получение
Получают железо восстановлением из его оксида – руды. Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается
бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- Реакции с солями
- Восстановительные свойства
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t
Fe + O2 = Fe3O4 (при горении железа образуется железная окалина – Fe3O4 – смесь двух оксидов
FeO*Fe2O3)
При нагревании железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
Fe + Cl2 = (t) FeCl3
Fe + P = (t) FeP
Fe + C = (t) Fe3C
Fe + Si = (t) FeSi

Железо активнее водорода, способно вытеснить его из кислот.
Fe + HCl = FeCl2 + H2↑
На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными
серной и азотной кислотами.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.

Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Железо способно восстанавливать соединения железа III до II.
Fe + Fe2O3 = (t) FeO
Fe + FeCl3 = (t) FeCl2
Соединения железа II проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа II
распадается на соответствующий оксид и воду.
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + HCl = FeCl2 + H2O
Fe(OH)2 = (t) FeO + H2O

При хранении на открытом воздухе соли железа II приобретают коричневый цвет из-за окисления до железа III.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью – K3[Fe(CN)6] –
гексацианоферратом III калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + NaCl
Соединения железа III проявляют амфотерные свойства. Оксид и гидроксид железа III реагирует и с кислотами, и с щелочами.
Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа III – ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании
легко распадается на воду и соответствующий оксид.

Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6].
В результате реакции образуется берлинская лазурь (прусский синий).
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Реакция хлорида железа III с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко
красного цвета.
FeCl3 + KCNS = Fe(CNS)3 + KCl

И еще одна качественная реакция на ионы Fe3+ – взаимодействие с щелочью (гидроксидом натрия). В результате
выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + NaCl
Соединения железа VI – ферраты – соли несуществующей в свободном виде железной кислоты. Обладают выраженными
окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3
в щелочи.
Fe + KOH + H2O = (электролиз) K2FeO4 + H2↑
Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O

Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.

Основные степени окисления меди +1, +2.

Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 – медный колчедан, халькопирит
- Cu2S – халькозин
- Cu2CO3(OH)2 – малахит

Получение
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
CuFeS2 + O2 = Cu2S + FeS + SO2↑
Cu2S + O2 = Cu2O + SO2
Cu2O + Cu2S = Cu + SO2
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди
более активными металлами, например – железом.
CuSO4 + Fe = Cu + FeSO4

Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь – на катоде, кислород – на аноде)
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С оксидами неметаллов
Во влажном воздухе окисляется с образованием основного карбоната меди.
Cu + CO2 + H2O + O2 = (CuOH)2CO3
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)

Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной
– реакция идет.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O
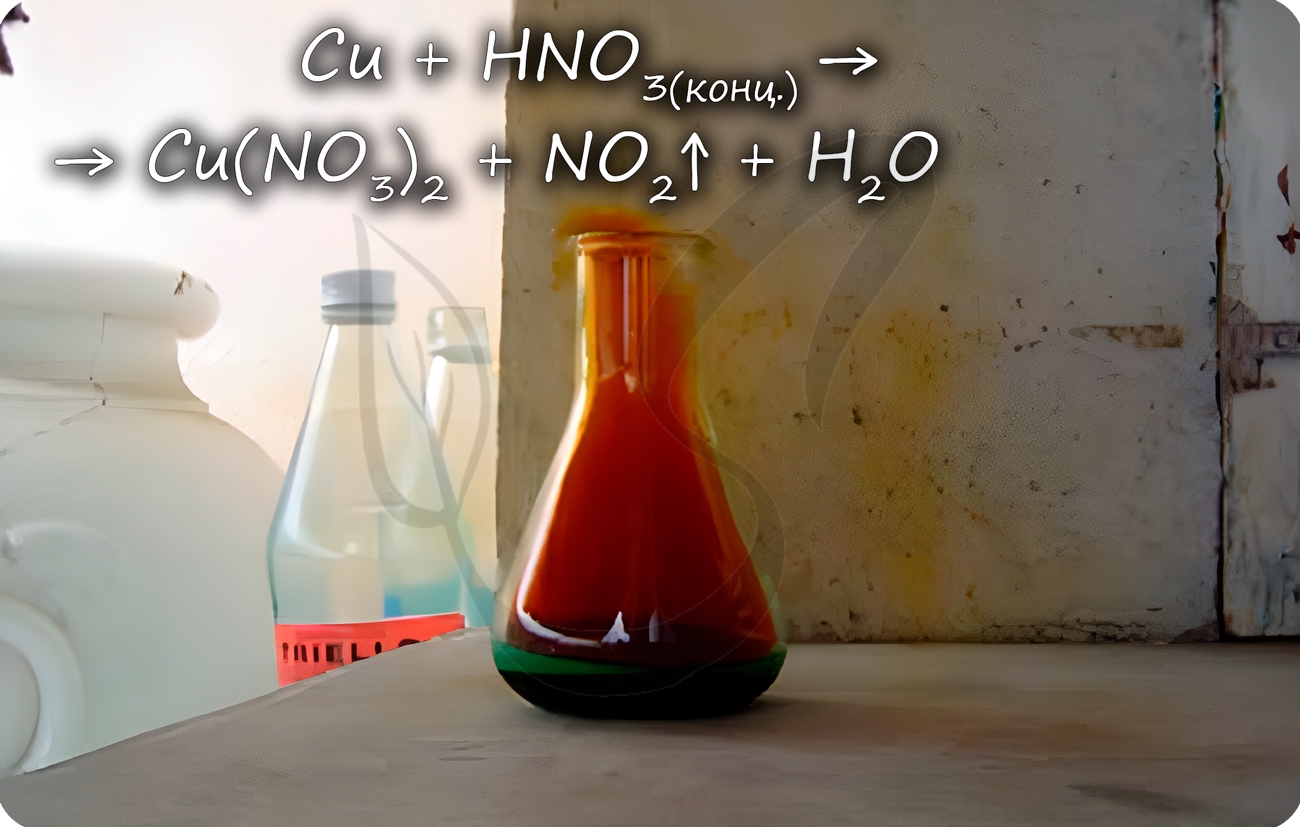
Реагирует с царской водкой – смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) CuO + S
Cu + NO2 = (t) CuO + N2↑
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди I можно получить путем восстановления соединений меди II.
CuCl2 + Cu = CuCl
CuO + Cu = Cu2O
Оксид меди I можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Cu2O + CO = (t) Cu + CO2
Cu2O + Al = (t) Cu + Al2O3
Cu2O + H2 = (t) Cu + H2O
Оксид меди I окисляется кислородом до оксида меди II.
Cu2O + O2 = (t) CuO
Оксид меди I вступает в реакции с кислотами.
Cu2O + HCl = CuCl + H2O
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
CuOH → Cu2O + H2O
Соединения меди II
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2.
Данные соединения проявляют преимущественно основные свойства.
Оксид меди II получают в реакциях термического разложения гидроксида меди II, реакцией избытка кислорода с медью при нагревании.
Cu(OH)2 = (t) CuO + H2O
Cu + O2 = (t) CuO
Химические свойства
- Реакции с кислотами
- Разложение
- Восстановление
CuO + H2SO4 = CuSO4 + H2O
CuO + HCl = CuCl2 + H2O
CuO = (t) Cu2O + O2
CuO + CO = Cu + CO2
CuO + C = Cu + CO
CuO + H2 = Cu + H2O
Гидроксид меди II – Cu(OH)2 – получают в реакциях обмена между растворимыми солями меди и щелочью.

CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
При нагревании гидроксид меди II, как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди II носит преимущественно основный характер, однако способен проявлять и амфотерные свойства.
В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди II – (CuOH)2CO3)
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
